岩藻多糖酶产生菌的筛选及其酶解产物的结构表征、抗氧化研究
2024-01-18杨柳顾秋亚王聪聪李熙文余晓斌
杨柳,顾秋亚,王聪聪,李熙文,余晓斌
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
岩藻多糖也称褐藻糖胶、岩藻聚糖硫酸酯、褐藻多糖硫酸脂等,是一类来自于褐藻的纯天然、阴离子型[1]水溶性杂多糖,主要由含硫酸基的岩藻糖[2]组成,并伴有少量的半乳糖、甘露糖、木糖、鼠李糖、糖醛酸[3]等,这种独特的化学结构赋予其抗肿瘤[4-5]、抗氧化[6]、降血脂[7]、抗炎[8]、抗凝血[9]、促益生菌[10]等生物活性。岩藻多糖作为一种性能优良、功效独特的海洋源[11]健康产品,其丰富的生理活性能够有效提高人类健康水平,基于岩藻多糖在生命健康领域中的应用价值,开展研究其功能和应用具有重要的意义。
岩藻多糖作为一种大分子杂多糖,存在分子质量大、溶解性差、不容易被吸收等问题,严重制约了其应用。而以岩藻多糖为原料生产的低分子质量岩藻多糖(low molecular weight fucoidan,LMWF)具有黏度低、溶解性好、易吸收等优点,表现出较好的生物利用性。LMWF往往通过化学降解法[12]和生物降解法获得,其中化学降解反应条件剧烈、活性物质易被破坏、产物分离纯化难,限制了其应用和发展。生物降解法主要指酶降解法,目前常用的酶为岩藻多糖酶[13],酶降解条件温和、催化效率高、分子质量易于控制,不会破坏多糖本身结构,可形成生物相容的活性产物,因此酶水解制备LMWF是当前最理想的制备方法,拥有广阔的应用前景。
然而酶降解亦存在成本高、工业化生产难度大等缺点,故建立高效的产酶菌株筛选方法,筛选一株低成本、酶活性高的菌株是当前的研究之重。目前常用于岩藻多糖酶产生菌筛选的检测方法多为还原糖法、碳水化合物-聚丙烯酰胺凝胶电泳[14]以及对羟基苯甲酰肼法[15]。本研究首次利用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC),从茶叶中筛选得到一株具有岩藻多糖酶活性的菌株,丰富了岩藻多糖酶产生菌的来源,为岩藻多糖酶产生菌的筛选提供了新思路。另外制备了低于10 kDa的LMWF,分析了其结构特点,以及分子质量大小与特定的生物活性之间的关系,为LMWF的研究和应用提供了理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
茶叶购自市场,菌株分离自茶叶。
1.1.2 试剂
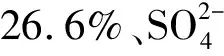
1.2 仪器与设备
ZHJH-C1115B超净工作台,上海智诚分析仪器制造有限公司;高压灭菌锅,美国致微仪器有限公司;SPX-250-Z恒温培养箱,上海跃进医疗器械厂;7GI-16M高速冷冻离心机、ICS-5000离子色谱仪,美国赛默飞世尔科技公司;1260高效液相色谱仪,美国安捷伦科技公司;NEXUS傅里叶变换红外光谱仪,美国尼高力仪器公司。
1.3 实验方法
1.3.1 培养基配制
改良PDA培养基(g/L):马铃薯200、茶叶25、蔗糖40、琼脂20,pH自然。
筛选培养基(g/L):岩藻多糖10、NH4NO32、MgSO40.05、琼脂20、青霉素0.05,pH自然。
固态发酵培养基(250 mL摇瓶):麸皮10 g、岩藻多糖0.3 g、UP水8 mL,pH 6.0。
上述培养基均在115 ℃灭菌30 min。
1.3.2 菌株筛选
取10 g黑毛茶溶于100 mL无菌水中,30 ℃摇床振荡培养4 h。取1 mL培养液进行10倍梯度稀释,吸取200 μL稀释液(10-1~10-7)涂布于筛选培养基上,30 ℃培养3~6 d,挑取生长良好、形态不同的单菌落进行分离纯化。所得菌株划线于改良PDA平板,30 ℃培养4 d。使用内含玻璃珠的无菌水将其制备成孢子数量为106个/mL的孢子悬液[16],吸取200 μL接种至固态发酵培养基中,于30 ℃恒温培养箱中静置培养4 d。发酵结束后向固态培养基中加入50 mL柠檬酸-柠檬酸钠(0.1 mol /L、pH 6.0)缓冲液搅拌均匀,4 ℃浸提12 h,浸提后的酶液用纱布过滤,滤液离心(8 000 r/min、15 min)后获得的上清液即为发酵粗酶液。
使用0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH 6.0)将粗酶液稀释至适当浓度,分别取25 mL稀释后粗酶液与25 mL 1%岩藻多糖溶液(0.1 mol /L柠檬酸-柠檬酸钠缓冲液,pH 6.0)混合均匀,50 ℃反应24 h后,沸水浴10 min终止反应。冷却后向其中添加1/4体积的Sevage[17][V(氯仿)∶V(正丁醇)=4∶1]溶液除蛋白,充分振摇30 min后去除有机相,重复操作多次至蛋白完全去除。减压浓缩去除残留有机溶液,使用500 Da透析袋低温透析48 h除盐,后减压浓缩至5 mL;取1 mL样品用0.22 μm微孔滤膜过滤除菌,通过HPGPC测定其重均分子质量(Mw)。在同一酶解条件下,酶解产物中LMWF相对含量越高证明其酶活力越大。
1.3.3 菌株鉴定
形态特征:将菌株接种于改良PDA培养基上,30 ℃培养4 d,选取生长状态良好的单菌落观察形态,并置于光学显微镜和电子显微镜下观察孢子形态。
系统发育分析:将培养4 d的含菌平板送至上海生工生物工程有限公司测定其ITS全序列,测序结果于NCBI数据库进行BLAST比对,比对结果利用MEGA7构建系统发育树[18],确定其生物学种属。
1.3.4 LMWF制备
实验前进行酶解工艺优化[19],分别优化了酶解反应温度(40、45、50、55、60 ℃);底物质量浓度(5、10、15、20、25 g/L);反应pH(4.0、5.0、6.0、7.0、8.0、9.0);以及最适反应时间(6、12、24、36、48 h)。在最佳酶解条件(50 ℃、1.5%、pH 6.0、36 h)下扩大反应体系,反应结束后煮沸灭活酶液,并进行除蛋白除盐操作,后用10 kDa超滤管超滤分级,收集低于10 kDa的组分,减压浓缩至适宜的体系,过0.22 μm的微孔滤膜除菌,冷冻干燥后存放于真空干燥皿待用。
1.3.5 岩藻多糖和LMWF初级结构表征
1.3.5.1 硫酸基团(SO42-)含量测定
采用BaCl2-明胶比浊法[20]测定硫酸基团含量。分别称取2种岩藻多糖样品0.05 g于具塞试管中,加入5 mL HCl(1 mol/L),在121 ℃下水解5 h,取0.1 mL水解液待测。标准曲线:称取烘干至恒重的K2SO4217.5 mg,以HCl(1 mol/L)溶解并定容至100 mL,摇匀得硫酸根标准液(1.2 mg/mL),硫酸根标准溶液用1 mol/L的HCl溶液稀释至不同浓度,吸取50 μL于试管中,向其中加入200 μL BaCl2-明胶溶液、750 μL三氯乙酸溶液并混匀,室温下静置反应25 min,测定360 nm下的吸光度。
1.3.5.2 单糖组成分析
参考俞所银等[21]的方法,取5 mg样品于指定容器中然后加入300 μL 2 mol/L的三氟乙酸(trifluoroacetic acid,TFA),于100 ℃金属浴反应8 h;冷却至室温后用氮吹仪吹干,添加300 μL甲醇再次吹干,重复上述步骤多次,直至TFA完全除去。然后加入25 mL超纯水溶解残余物,稀释10倍后过0.22 μm微孔滤膜除菌,使用离子色谱仪进行色谱分析。分析柱Carbo Pac PA20,流动相:A(超纯水)、B(0.25 mol/L NaOH);流速0.5 mL/min;柱温30 ℃;检测器为脉冲安培检测器;进样体积20 μL。分别检测样品和1 mg/mL(岩藻糖、氨基半乳糖、鼠李糖、阿拉伯糖、氨基葡萄糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、半乳糖醛酸、葡萄糖醛酸)的单糖标准品。
1.3.5.3 分子质量的测定
使用HPGPC测定样品重均分子质量,将待测多糖配成10 mg/mL的样品,过0.22 μm微孔滤膜除菌。色谱柱为UltrahydrogelTMLinear(300 mm×7.8 mm id×2),流动相为0.1 mol/L NaNO3,流速0.9 mL/min,柱温45 ℃,检测器为示差检测器;进样体积20 μL。标准曲线:将已知分子质量的葡聚糖标准品(DextrantT系列)配为10 mg/mL的标准溶液,经HPGPC检测后,以保留时间为横坐标、重均分子质量的对数(lgMw)为纵坐标建立回归方程。
1.3.5.4 傅里叶变换红外光谱分析
将待测多糖烘干至恒重,取10 mg左右样品于傅里叶变换红外光谱仪[22]进行红外扫描,采用全反射法,扫描区域为4 000~500 cm-1。
1.3.6 抗氧化活性测定
将待测多糖配制成适宜浓度的样品溶液,按照测试试剂盒中的说明书分别测定岩藻多糖和LMWF的·OH、DPPH自由基清除能力,以及FRAP。
1.4 数据统计分析
结果报告为平均值±标准偏差(n=3),数据采用Origin 2021绘图。
2 结果与分析
2.1 岩藻多糖酶产生菌的筛选与鉴定
2.1.1 菌株筛选
以岩藻多糖为唯一碳源,共从茶叶中筛选获得真菌23株,经过分离纯化,选取7株生长较快、形态特征不一的菌株转接至改良PDA培养基进行固态发酵,30 ℃培养4 d后,利用其粗酶液在50 ℃下酶解岩藻多糖24 h,使用HPGPC法对酶解产物进行检测。结果如图1所示,横坐标为出峰时间,随着出峰时间的延长分子质量由大变小,因此大分子质量的多糖先被检测到;纵坐标为电压响应值,电压响应值大小与其样品浓度呈正相关,即样品中同一聚合度的多糖浓度越高电压响应值越大。表1中面积百分占比为其相对含量占比。水解前岩藻多糖分子质量为277 kDa,无LMWF存在。如图1所示,菌株JH-5酶解产物出峰时间最晚,说明其中LMWF占比较多,相对含量为59.4%(表1),除了菌株JH-1酶解产物中未检测到LMWF,余下菌株酶解产物中LMWF相对含量均在10%左右,说明其中只有少数岩藻多糖被水解,菌株发酵粗酶液酶活力较低。此外,分散系数(Mw/Mn)用来衡量多聚物分子质量分布的分散程度,当分散系数为1时,表明聚合物是由均一分子质量的聚合物组成的,分散系数越大,表明聚合物的分子质量分布范围越宽。菌株JH-5来源的岩藻多糖酶水解产物分散系数为2.15,表明聚合物LMWF链长差距较大,分子质量分布范围相对较宽。在相同的酶解条件下,菌株JH-5来源的岩藻多糖酶的酶解产物中LMWF相对含量最高,因此确定菌株JH-5为出发菌株进行后续研究。
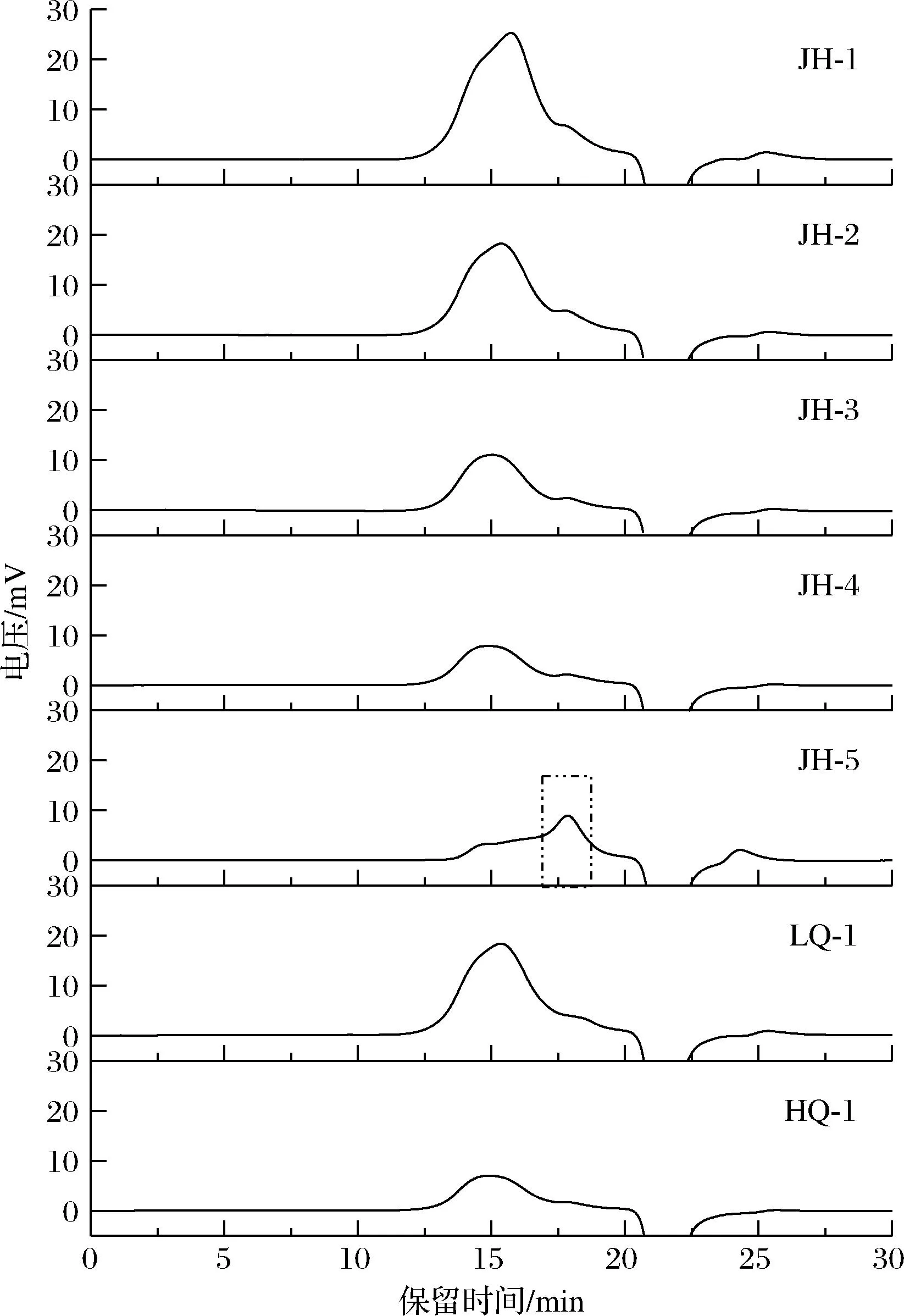
图1 菌株发酵粗酶液酶解岩藻多糖的HPGPC分析Fig.1 HPGPC analysis of fucoidan hydrolyzed by crude enzyme solution fermented by strain

表1 产物中LMWF的分子质量及占比Table 1 Molecular weight and proportion of LMWF in products
2.1.2 菌株鉴定
如图2-a所示,菌株JH-5于改良PDA固体培养基上生长4 d后,观察到其菌落呈现为椭圆形,表面粉末状,颜色有数环;菌落随生长时间的增加,从内向外依次呈绿色、黄色,边缘为新生菌落,呈白色丝绒状,产孢囊孢子。通过光学显微镜可以观察到多个伞状孢囊孢子(图2-b);通过扫描电子显微镜(图2-c)可以观察到,菌株JH-5的分生孢子顶部膨大成孢囊,分生孢子呈辐射状孢子链,孢子链有隔。根据其形态特征,初步鉴定为曲霉属(Aspergillussp.)。
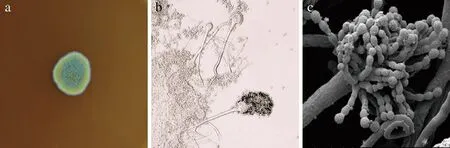
a-菌落形态;b-光学显微镜下孢囊孢子形态; c-电子显微镜下孢囊孢子形态图2 JH-5的菌落及显微镜下的孢子形态Fig.2 Colony and microscopic spore morphology of JH-5
系统发育分析:将培养4 d的含菌平板送至上海生工生物工程有限公司进行ITS测序,测序结果在NCBI 数据库中进行BLAST比对,将对比结果通过MEGA7软件构建系统发育树(图3)。综合形态学和分子生物学的鉴定结果,菌株JH-5被鉴定为Aspergillusamstelodami。
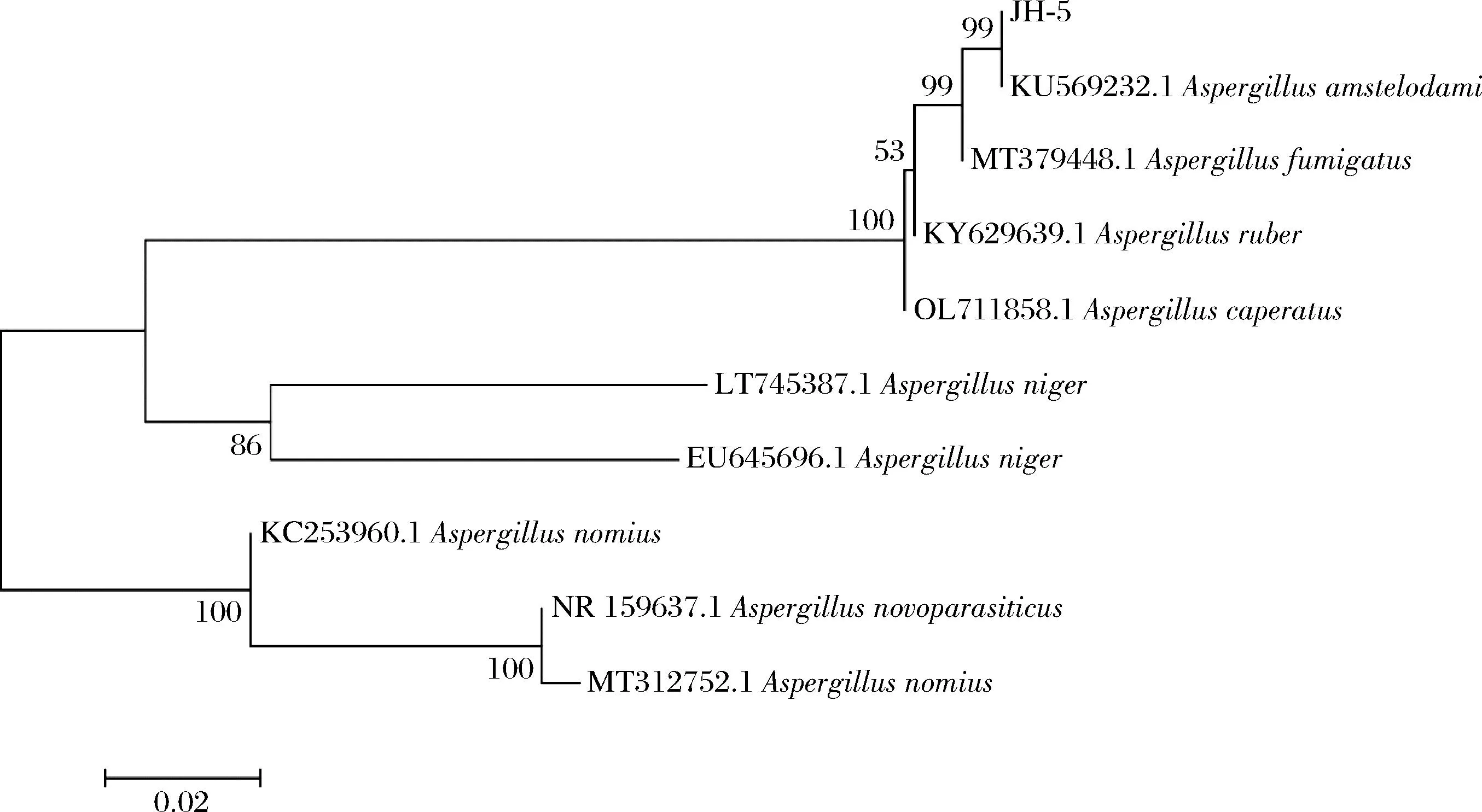
图3 菌株JH-5的系统发育进化树Fig.3 Phylogenetic tree of strain JH-5
2.2 岩藻多糖和LMWF的初级结构表征
2.2.1 硫酸基团含量测定
岩藻多糖主要是由含有硫酸基的岩藻糖构成的水溶性多糖,其分子结构的主要成分是L-岩藻糖和硫酸基,ZAYED等[23]研究发现硫酸基结构和含量与其活性密切相关,因此有必要检测产物的硫酸基变化。水解前岩藻多糖硫酸基团含量为(33.0±0.3)%,水解后的LMWF硫酸基团含量为(32.4±0.9)%,表明在水解过程中硫酸基损失较小,来源于菌株JH-5的岩藻多糖酶可以温和地降解岩藻多糖,水解后的产物LMWF不会因为硫酸基变化而影响其生物活性。
2.2.2 单糖组成分析
利用离子色谱测定F、LMWF的单糖组成。结果如表2所示,F主要由岩藻糖和半乳糖组成,此外还含有少量的木糖和葡萄糖醛酸,表明岩藻多糖是由多种单糖组成的非均一性杂多糖[24],其单糖组成符合裙带菜来源的岩藻多糖成分特征[25]。对酶解产物LMWF的单糖组成进行检测,其中的岩藻糖的摩尔百分含量相较于F略有下降,半乳糖和葡萄糖醛酸的摩尔百分含量略有升高,木糖的摩尔百分含量无明显变化,表明水解产物的单糖组成和含量相对稳定,不会因为组分的变化而过多的影响其生物活性。

表2 F和LMWF的单糖摩尔百分比Table 2 Molar percentage of monosaccharide in F and LMWF
2.2.3 分子质量的测定
使用HPGPC法测定F、LMWF的分子质量。结果如图4所示,F的分子质量为277 kDa,LMWF的分子质量为2 997 Da,分散系数为2.7(表3),表明该聚合物中LMWF链长差距大,分子质量分布范围相对较宽,表明酶解产物LMWF是非均一性的多糖。

图4 F和LMWF的HPGPC分析Fig.4 HPGPC analysis of F and LMWF

表3 F和LMWF的分子质量Table 3 Molecular weight of F and LMWF
2.2.4 傅里叶变换红外光谱分析
如图5所示,F在3 391 cm-1处的吸收峰是—OH的伸缩振动,在2 934 cm-1附近有小吸收峰,是由C—H 的伸缩振动引起的,1 633 cm-1处的吸收峰表明存在羧基的C—O键振动,1 376 cm-1吸收峰属于δ-CH2的弯曲振动,1 217 cm-1处的吸收峰是C—O—C的伸缩振动引起的,1 017 cm-1处的峰表明存在吡喃糖环,826 cm-1处是α-糖苷键的吸收峰。LMWF在3 405 cm-1的宽吸收峰是—OH的伸缩振动引起的,2 935 cm-1处的吸收峰是由于C—H的伸缩振动,1 637 cm-1的吸收峰由于羧基的C—O键存在引起的,1 372 cm-1处的吸收峰属于δ-CH2的弯曲振动,1 225 cm-1和1 148 cm-1处的吸收峰归因于C—O—C的伸缩振动,1 019 cm-1属于吡喃糖环的吸收峰,824 cm-1处是α-糖苷键的吸收峰。2种多糖在890 cm-1处均没有特征吸收峰,说明不存在β-糖苷键,2种多糖均以α-糖苷键为主,符合岩藻多糖糖苷键的结构类型。图中显示样品在1 550 cm-1附近没有吸收峰,不存在酰胺键(—CO—NH—C—),表示样品中的蛋白质去除比较彻底。
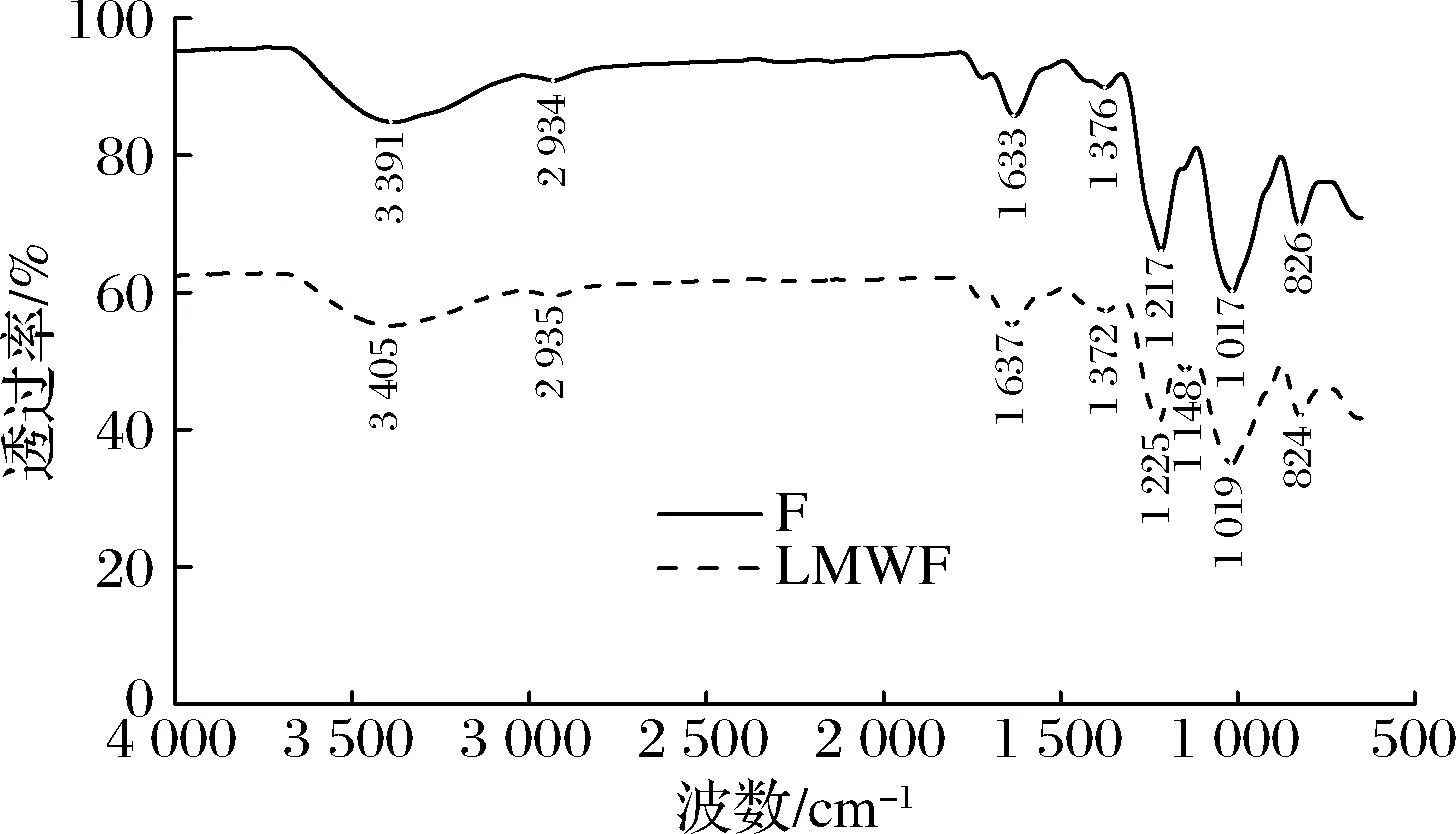
图5 F和LMWF的傅里叶变换红外光谱图Fig.5 FTIR patterns of F and LMWF
2.3 抗氧化活性测定
如图6所示,各样品随着浓度上升其抗氧化能力呈现不断上升的趋势,并表现出一定的浓度依赖性。当样品浓度较低时,F和LMWF清除活性差异较小;随着浓度的增加,LMWF抗氧化活性快速增长,与F的差距逐渐加大,优势变得明显。LMWF具有明显优于未水解岩藻多糖的抗氧化活性,表明抗氧化活性受岩藻多糖分子质量影响较大,其分子质量与生物活性功能之间存在着一定的关系。
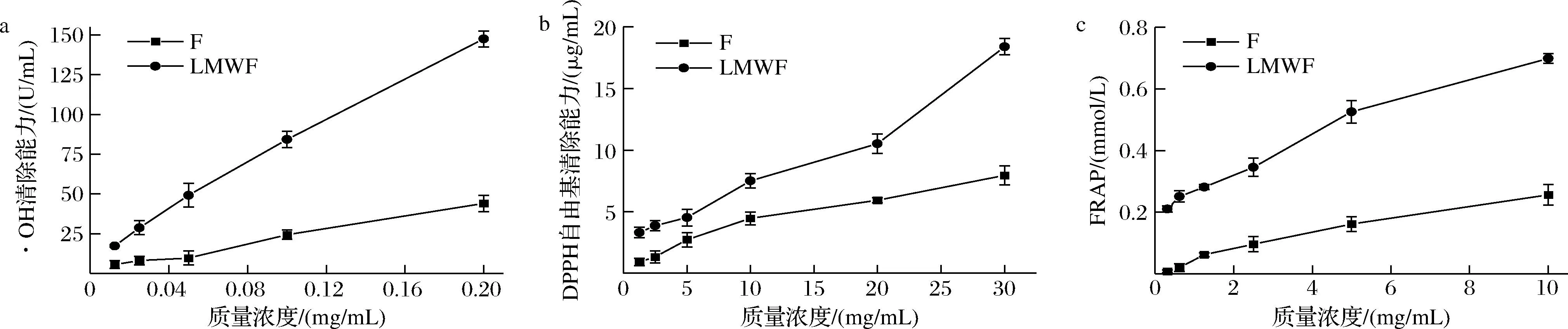
a-·OH清除能力;b-DPPH自由基清除能力;c-FRAP图6 F和LMWF的抗氧化活性Fig.6 Antioxidant activity of F and LMWF
3 结果与讨论
利用HPGPC检测酶解产物分子质量的变化,建立了一种新的岩藻多糖酶产生菌筛选的检测方法,为后续岩藻多糖酶产生菌的筛选提供了新的方向。对发酵粗酶液酶解制备的LMWF结构解析表明,该酶可以温和稳定地水解岩藻多糖,不会破坏产物的结构以及有效活性成分。对水解前后岩藻多糖的抗氧化研究结果显示,LMWF对于清除·OH、DPPH自由基,以及FRAP明显高于岩藻多糖,并随着浓度的增加差异逐渐增大,表明其抗氧化活性受分子质量影响巨大,突出了LMWF的应用潜力,未来可用于具有抗氧化功能的保健品以及食品加工生产中的功能性成分。后续对岩藻多糖的研究,应继续探究其结构与生物活性之间的关系,阐明其作用机制,为岩藻多糖的开发和利用提供更多的理论依据。