产甘油假丝酵母25S rRNA甲基转移酶BMT5对乙酸胁迫耐受的影响及应用
2024-01-18周柳陆信曜宗红诸葛斌
周柳,陆信曜,宗红,诸葛斌*
1(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,工业微生物及 多元醇研究设计中心,江苏 无锡,214122)
木质纤维素乙醇的开发利用是解决能源危机的有效途径[1]。木质纤维素预处理过程会释放大量抑制微生物菌体生长和发酵的抑制剂,如乙酸、糠醛、5-甲基糠醛和酚类物质等[2]。提高微生物菌株对发酵抑制剂的耐受性有利于纤维素乙醇生产技术的发展[3]。
产甘油假丝酵母(Candidaglycerinogenes)WL2002-5是一株有自主知识产权与多重抗逆性能的工业安全菌株[4],具有生长与发酵速率快、耐高温和耐高渗透压等特性[5],在生物合成化合物方面有重要应用[6-7]。但是通过转录组数据不能获得其大量的功能基因。因此前期实验构建了C.glycerinogenes基因组文库,通过文库的筛选[8],获得能够提高酵母菌株乙酸耐受性的基因CgBmt5。CgBmt5编码25S rRNA甲基转移酶,负责25S rRNA甲基化,预测参与核糖体的生物发生[9]。
本研究以C.glycerinogenes的CgBmt5为研究对象,通过在S.cerevisiae中过表达CgBmt5初步确定CgBmt5的乙酸胁迫耐受性;其次在C.glycerinogenes中过表达CgBmt5,考察过表达菌株在乙酸及未脱毒纤维素水解液中的乙醇发酵性能,为工业菌株的利用和纤维素乙醇技术发展提供新的生物材料。
1 材料与方法
1.1 菌株与质粒
本研究所使用的菌株和质粒如表1所示,设计的引物如表2所示。

表2 本实验设计引物Table 2 Primers used in this study
1.2 试剂与仪器
酵母粉和蛋白胨,OXOID公司;酵母无氨基氮源(yeast nitrogen base, YNB)与酵母基因组DNA快速抽提试剂盒,生工生物工程(上海)股份有限公司;Ex Taq DNA聚合酶、限制性内切酶和pMD19-T Vector Cloning Kit, TaKaRa公司;AB clonal MultF Seamless Assembly Mix,武汉爱博泰克生物科技有限公司;AceQ Universal SYBR qPCR Master Mix,南京诺唯赞生物科技股份有限公司;质粒提取试剂盒、柱回收试剂盒和凝胶回收试剂盒,上海捷瑞生物工程有限公司;所用引物由无锡天霖技术有限公司合成;过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒,索莱宝公司。
PCR扩增仪和实时荧光定量基因扩增仪、AminexHPX-87H柱,Bio-Rad公司;高效液相色谱仪,江苏汉邦科技有限公司;RI-101折射率检测器,Shodex;紫外分光光度计,北京普析通用公司。
1.3 培养基与培养方法
LB培养基(g/L):NaCl 10.0,蛋白胨10.0,酵母提取物5.0;抗性平板需添加100 μg/mL的氨苄青霉素。
MM培养基(g/L):YNB 6.7,葡萄糖20.0,pH值为7.0。
YPD培养基(g/L):蛋白胨20.0,酵母提取物10.0,葡萄糖20.0。
发酵培养基(g/L):蛋白胨20.0,酵母提取物10.0,葡萄糖160.0,乙酸85 mmol/L或120 mmol/L,30 ℃,100 r/min。
固体培养基需要添加20 g/L的琼脂粉。
1.3 统计学分析 建立Epidate数据库,通过SPSS 11.5软件进行统计学检验。计量资料采用采用均数±标准差(±s)描述、组间资料采用独立样本t检验或单因素方差分析进行统计学处理。患者与照顾者之间相关性分析用Person相关性分析。
培养方法:E.coliJM109在含有100 μg/mL氨苄青霉素LB培养基中于37 ℃培养,用以本研究中所有质粒构建;S.cerevisiaeCEN PK2-1C用于所有重组质粒的转化,并于30 ℃条件下利用YPD培养基进行培养;C.glycerinogenes/ΔURA5用于所有过表达菌株的转化,并于30 ℃条件下利用MM培养基培养。
1.4 重组菌生长耐受验证
点板验证:取1%~2%重组菌株一级种子液于10 mL YPD培养基中于30 ℃、200 r/min培养12~14 h后,6 000 r/min离心2 min收集菌体,并用生理盐水洗涤细胞2~3次,调整到相同的初始OD600值(1.0),10倍比依次稀释,点种于含85 mmol/L乙酸的YPD平板上,30 ℃培养3 d。
摇瓶验证:重组S.cerevisiae菌株在YPD培养基中转接2次,待菌株生长至对数生长期时,调整初始OD600值为0.1,接种至装有100 mL YPD培养基的250 mL锥形瓶中,并在胁迫条件下培养,每6 h取样用于胁迫生长分析,生物量以OD600表示。
1.5 CgBmt5在C.glycerinobgenes中过表达
在C.glycerinogenes中过表达CgBmt5。使用同源重组的方法构建过表达载体,将构建好的过表达载体采用PEG/LiAc法转化C.glycerinogenes/ΔURA5感受态细胞。获得的过表达菌株在YPD培养基中转接2次,待菌株生长至对数生长期时,调整初始OD600值为0.1,接种至装有50 mL YPD培养基的250 mL锥形瓶中,并在胁迫条件下培养,每6 h取样用于胁迫生长分析,生物量以OD600表示。
1.6 RNA提取和实时荧光定量PCR
将C.glycerinogenes过表达菌株在YPD培养基中摇瓶培养至对数期,以1%接种量转接至装有50 mL YPD培养基的250 mL锥形瓶中,待培养至对数期,加入120 mmol/L乙酸培养2 h,6 000 r/min离心5 min收集细胞,并在液氮中储存。样品的总RNA提取等依据产品说明书进行,根据琼脂糖凝胶电泳的检测结果评估总RNA质量。用于转录水平测定,每种样品设置4个重复。
1.7 脂质过氧化水平测定
对数生长期酵母细胞胁迫处理4 h,6 000 r/min,5 min收集菌体,无菌水洗2次后,加入1 mL 2-硫代巴比妥酸(2-thiobarbituric acid,TBA)试剂(0.25 mol/L HCl,质量分数15%三氯乙酸,和质量分数0.375% TBA),100 ℃煮沸15 min后12 000 r/min,4 ℃离心20 min取上清液,用紫外分光光度计测定其在532 nm处的吸光值,TBA试剂为空白对照。脂质过氧化水平通过每克菌体蛋白所占硫代巴比妥酸值即硫代巴比妥酸反应物(2-thiobarbituric acid reactive substances,TBARS)表示。
1.8 CAT和SOD活性测定
将C.glycerinogenes过表达菌株在YPD培养基中摇瓶培养至对数期,以1%接种量转接至装有50 mL YPD培养基的250 mL锥形瓶中,待培养至对数期,加入120 mmol/L乙酸胁迫处理4 h,6 000 r/min,5 min收集菌体后按照试剂盒方法检测CAT和SOD活性。
1.9 过表达菌株在未脱毒纤维素水解液中乙醇发酵
1.10 葡萄糖、甘油和乙醇含量测定
生物量以OD600表示。葡萄糖、乙醇和甘油含量通过HPLC测量,发酵液10 000 r/min离心5 min,取上清液经0.22 μm微孔滤膜过滤,使用AminexHPX-87H柱和RI-101折射率检测器,温度60 ℃。流动相为5 mmol/L H2SO4溶液,流速为0.6 mL/min。
2 结果与分析
2.1 CgBmt5对酿酒酵母乙酸耐受和发酵性能的影响
经基因组文库筛选、测序比对,获得促进菌株耐受乙酸的基因CgBmt5。与对照菌(S.cerevisiae/p414-kan)相比,重组菌S.cerevisiae/p414-kan-CgBmt5在85 mmol/L乙酸下生长更优(图1-a),滞后期缩短约12 h,乙醇产量60.5 g/L,提高17.7%;单位菌体乙醇产量12.9 g/L,提高27.7%;转化率41.6%,提高17.8%,生产强度提高17.6%,生物量无明显变化(图1-b)。上述结果表明,CgBmt5可以提高乙酸胁迫下酿酒酵母的生长及乙醇发酵性能。
2.2 过表达CgBmt5对C.glycerinogenes胁迫耐受的影响
120 mmol/L乙酸胁迫下,在C.glycerinogenes中过表达CgBmt5,过表达菌株滞后期缩短24 h,乙醇产量62.7 g/L,提高17.6%,单位菌体乙醇产量12.3 g/L,提高17.1%;转化率46.1%,提高17.6%;生产强度提高47.7%,终生物量无明显差异(图2-a)。 结果表明,在C.glycerinogenes中过表达CgBmt5可提高120 mmol/L乙酸胁迫下的乙醇发酵性能。
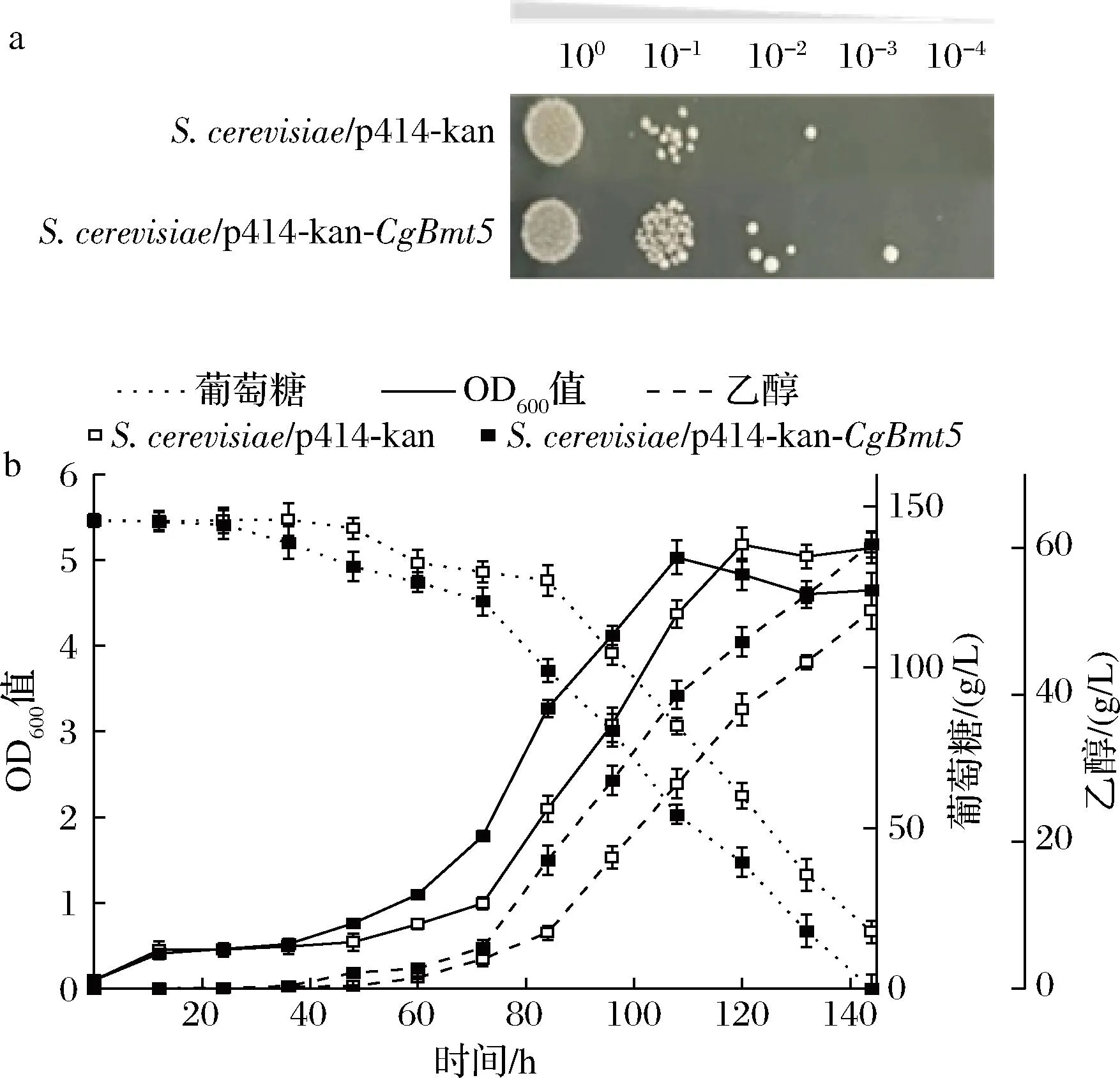
a-85 mmol/L乙酸胁迫下点板结果; b-85 mmol/L乙酸胁迫下乙醇发酵性能图1 CgBmt5对S.cerevisiae乙酸耐受及发酵性能的影响Fig.1 Effects of CgBmt5 on acetic acid tolerance and fermentation performance of S. cerevisiae
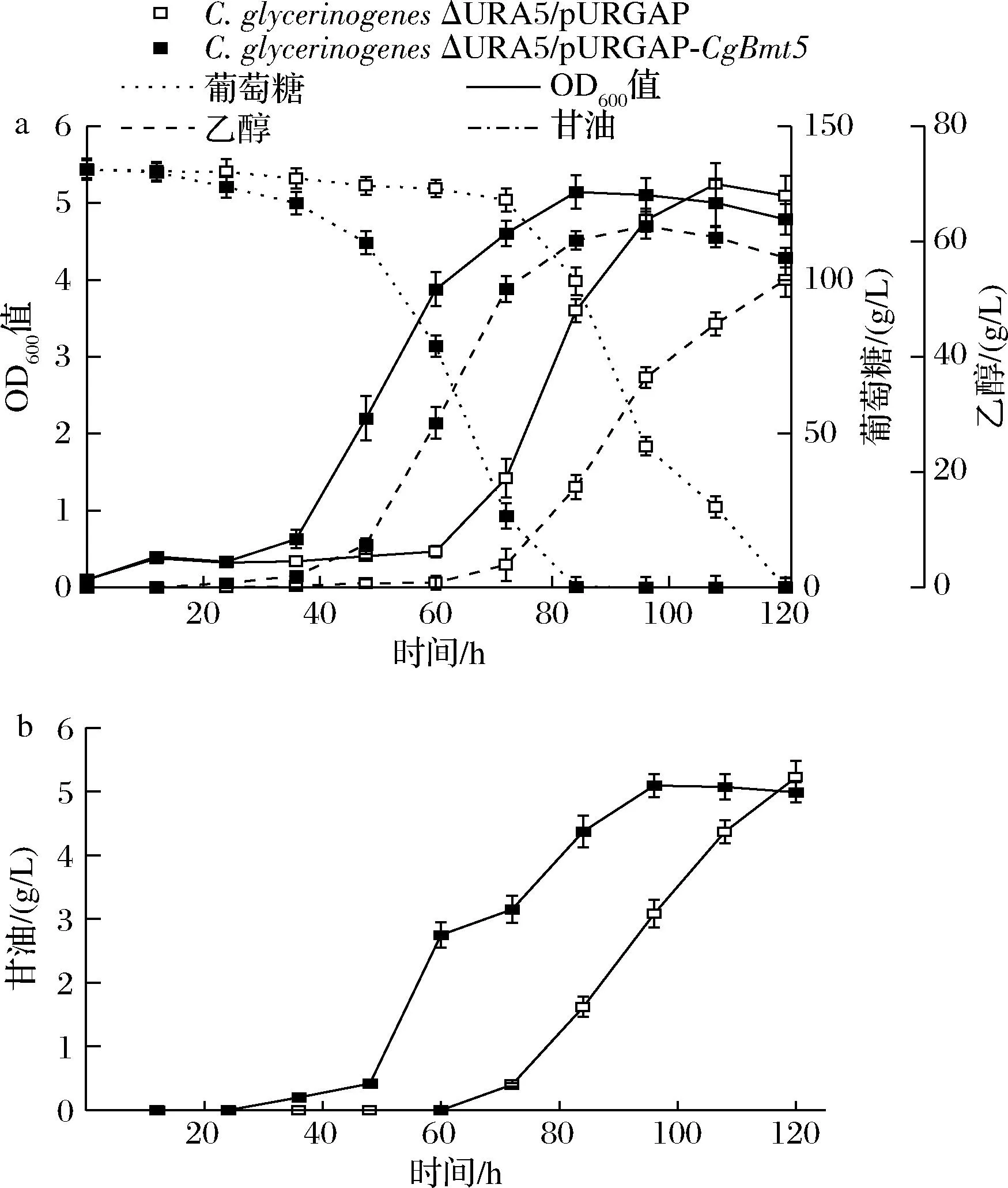
a-C.glycerinogenes乙醇发酵;b-乙醇发酵副产物甘油产量图2 过表达CgBmt5对C.glycerinogenes乙醇 发酵性能的影响Fig.2 Effect of overexpression of CgBmt5 on the ethanol fermentation performance of C.glycerinogenes
如图2-b所示,甘油是乙醇发酵的副产物,产量5.1 g/L,单位菌体甘油产量1.0 g/L,与对照无明显差异,生产强度提高了20.5%。 结果表明,乙酸胁迫下,过表达CgBmt5不能提高菌株甘油积累量。
为了探索过表达菌株的耐酸机制,进一步分析了过表达菌株的细胞膜脂质过氧化水平以及CAT和SOD的活性(图3)。在正常条件下,对照菌和过表达菌株的脂质过氧化水平相似。而在乙酸胁迫下,过表达菌株脂质过氧化水平降低18.1%(图3-a),表明CgBmt5可能通过降低过表达菌株的膜脂质过氧化水平调控细胞应对乙酸胁迫;过表达菌株CAT和SOD活性分别为9.2 U/mg蛋白、34.7 U/mg蛋白(图3-b),增加73.6%和53.5%,表明过表达CgBmt5后菌株乙酸耐受性的变化与抗氧化酶活性增高有关。
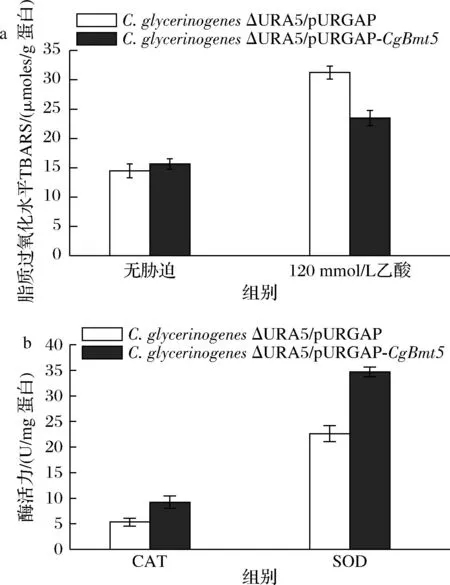
a-C.glycerinogenes脂质过氧化水平; b-C.glycerinogenes过氧化物酶活性图3 过表达CgBmt5对C.glycerinogenes脂质 过氧化水平及过氧化物酶活力的影响Fig.3 Effect of overexpression of CgBmt5 on lipid peroxidation level and peroxidase activity of C.glycerinogenes注:胁迫条件均为120 mmol/L乙酸。
为研究CgBmt5对菌株胞内代谢的调控机制,检测了乙酸耐受相关基因甘油-3-磷酸脱氢酶基因(Gpd1)、鸟氨酸氨基甲酰转移酶基因(Arg3)、质膜P2型H+-ATP酶基因(Pma1)、磷酸果糖激酶基因1(Pfk1)和细胞色素c氧化酶亚基Ⅲ基因(Cox3)的相关转录水平。乙酸胁迫下,这些基因部分上调(图4),其中Arg3的转录水平提高了4.8倍,糖酵解途径关键酶基因Pfk1上调1.5倍。以上结果表明,过表达CgBmt5能够影响上述酸胁迫响应基因的转录。
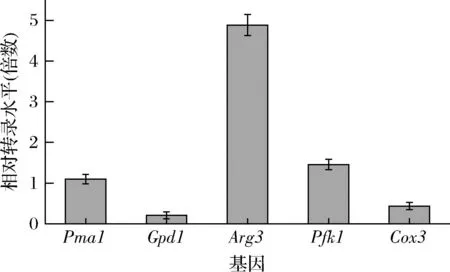
图4 乙酸耐受相关基因转录水平Fig.4 Transcription levels of genes related to acetic acid tolerance注:Gpd1为甘油合成途径关键限速酶,甘油的生物合成有助于细胞的氧化还原平衡,和氧化、高渗胁迫有关;Pma1将质子泵出细胞,是细胞质pH和质膜电位的主要调节因子;Pfk1是糖酵解途径关键酶,其活性与糖代谢相关;Arg3是精氨酸合成关键酶,精氨酸可以通过精氨酸脱亚胺酶途径产生NH3用于中和胞内质子,同时产生的ATP 通过ATPase将胞内质子泵出胞外;Cox3是细胞色素氧化酶,乙酸胁 迫会影响电子传递链。
2.3 过表达菌株利用纤维素水解液发酵乙醇
将CgBmt5过表达菌株C.glycerinogenesΔURA5/pURGAP-CgBmt5应用于纤维素水解液发酵乙醇,过表达菌株长势优于对照,生物量提高了67.6%;乙醇产量21.8 g/L,提高71.7%;单位菌体乙醇产量2.9 g/L,提高26.1%;转化率36.3%,提高65.0%,生产强度提高155.7%。综上所述,在C.glycerinogenes菌株中过表达CgBmt5可以显著提高菌株对多重胁迫、复杂环境的耐受性,从而提高纤维素水解液的乙醇发酵性能。
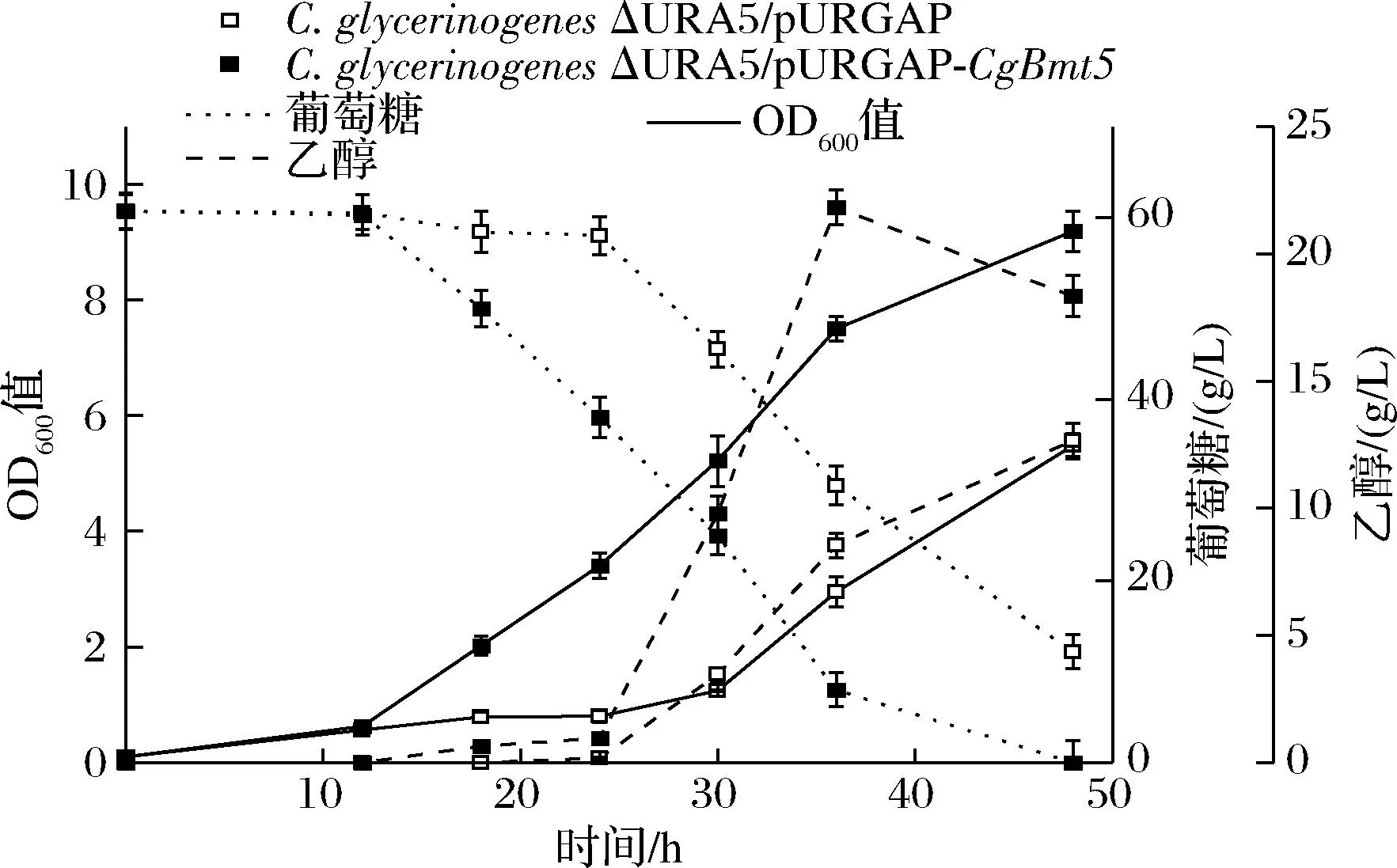
图5 CgBmt5过表达菌株利用纤维素水解液发酵乙醇Fig.5 CgBmt5 overexpressed strain ferments ethanol with fiber hydrolysateh
3 结论与讨论
rRNA存在糖和碱基部分甲基化或尿苷异构化为假尿苷2种类型的修饰,参与翻译起始、易位、终止及mRNA的结合等,从而影响翻译和基因调控[10-12]。动物细胞中,敲除28S rRNA甲基转移酶NML减少了60S亚基数量,增加RPL11-MDM2相互作用并诱导p53激活,使细胞凋亡、细胞周期停滞和蛋白质合成受抑制,从而影响细胞增殖[13]。敲除16S rRNA甲基转移酶YebU使得大肠杆菌生长变慢、环境适应性降低[14]。Bmt2和Bmt3与Bmt5具相同结构域,其缺陷株对茴香霉素和过氧化物敏感,表明rRNA拓扑结构变化[15-16]。敲除Bmt4导致pre-rRNA加工缺陷,显著影响60S核糖体的发生[17]。因此,Bmt家族可以改变rRNA的加工和结构等影响细胞表型。Bmt5是25S rRNA的甲基转移酶,但缺失Bmt5的酿酒酵母在不同温度下未见生长缺陷和抗生素敏感,也不影响核糖体的化学计量和翻译[9],表明不同rRNA甲基转移酶对核糖体功能和细胞表型的影响存在差异。本研究中,过表达CgBmt5对S.cerevisiae和C.glycerinogenes的乙酸耐受和发酵表型均有促进作用,进一步说明不同来源rRNA甲基转移酶功能上存在差异。
乙酸胁迫会使胞内发生氧化应激而损害细胞组分,如蛋白质、脂质和DNA等,细胞膜脂质过氧化是细胞发生氧化应激的直接体现之一[18]。本研究发现,乙酸胁迫下过表达CgBmt5菌株的脂质过氧化水平降低,表明CgBmt5对应对胞内氧化应激胁迫具有优势。同时,过表达菌株SOD和CAT活性明显增加,SOD在氧自由基解毒中起重要作用,所产生的过氧化氢由CAT分解,从而保护酵母细胞免受氧化损伤[19],这与过表达菌株细胞膜脂质过氧化水平降低相印证,因此过表达CgBmt5后菌株乙酸耐受性的改善与脂质过氧化水平的降低及SOD和CAT活性增加有关。
酿酒酵母中,敲除Bmt1后3-磷酸甘油酸激酶等9个糖代谢关键酶下调[20-21]。而CgBmt5的过表达上调了磷酸果糖激酶Pfk1,使得胁迫下单位菌体耗糖能力增加。Gpd1下调,但甘油积累和单位菌体甘油产量却无明显差异,表明甘油作为乙醇的副产物,上游碳供给是其积累的限制性因素,酶活力对其合成影响不大。质膜ATP酶Pma1转录水平未见明显变化,表明Bmt5可能对其无明显调控。乙酸胁迫会下调参与呼吸的细胞色素c氧化还原酶(Cor1,Cox11等)[22]。过表达CgBmt5,Cox3进一步下调,表明GgBmt5可能进一步抑制了电子传递链。精氨酸可以通过精氨酸脱亚胺酶途径(ADI)产生NH3用于中和胞内质子,同时产生的ATP通过ATPase将胞内质子泵出胞外[23-24]。鸟氨酸氨基甲酰转移酶Arg3是精氨酸合成关键酶,Arg3上调有助于胞内精氨酸积累,增强菌株对乙酸的耐受性[25]。
综上,本研究证实CgBmt5通过影响过氧化物酶SOD和CAT的活性,缓解ROS对细胞造成的损伤以及影响C.glycerinogenesΔURA5酸胁迫响应基因Pfk1、Gpd1、Cox3、Arg3的转录,通过促进胞内精氨酸合成途径、上调磷酸果糖激酶Pfk1等方式提高菌株对乙酸的耐受性及乙酸胁迫下的乙醇发酵性能,增强纤维素水解液乙醇的单位菌体产量和底物转化率,为酵母胁迫耐受的研究和纤维素乙醇技术发展提供新的生物材料。