碳、氮营养对2 株茶菌核心菌株生长和产酸的影响
2024-01-18刘斌杰
◎ 唐 倩,刘斌杰
(1.福建师范大学生命科学学院,福建 福州 350117;2.三明医学科技职业学院,福建 三明 365000)
茶菌,又名康普茶,是起源于中国的一种发酵茶饮料。传统的茶菌以红茶和白糖为主要原料,经过酵母菌、醋酸菌和乳酸菌的混合发酵而制成[1]。用于制作茶菌的原料(如不同茶叶、不同糖类)是影响茶菌风味、品质和生理功能的决定性因素之一[2]。发酵原料所提供的碳、氮营养不仅是茶菌微生物生长所必需的营养因子,同时是影响发酵微生物菌株互作关系和菌群动态的重要因素[3]。在碳源营养方面,李璐璐[4]通过比较不同碳源物质对茶菌发酵的影响,发现10%葡萄糖作为碳源时发酵液的pH 值下降最快;添加无机氮源对发酵液pH 值和总酸的变化没有显著影响。BRUNA 等[5]发现以绿茶为发酵基质制备茶菌,发酵液乙酸产量和抗高血压活性值较高,而pH 值和乙醇值较低;以红茶为发酵基质,发酵液总多酚含量较高;以马黛茶为发酵基质,发酵液pH 值较高而抗高血压活性值较低。CAMILA 等[6]分析碳源成分对不同酵母菌株的影响,发现真贝酿酒酵母(Saccharomyces eubayanus)在不同碳源的培养条件下生长速度不同,葡萄糖和蔗糖的混合有利于菌株的生长。这些研究大多分析不同营养物质对茶菌发酵液成分和功能的影响,对发酵菌株生长和代谢的作用研究很少。茶菌发酵过程中,微生物所需氮素营养主要来源于茶叶或其他植物原料。由于植物含氮物质丰富,种类各异,和碳源营养相比,有关氮源营养对茶菌发酵液和发酵菌株的影响,研究更为缺乏。
布鲁塞尔酒香酵母和葡萄糖醋杆菌是茶菌发酵的核心菌株[7-9]。本研究分析碳、氮营养对布鲁塞尔酒香酵母和葡萄糖醋杆菌单独培养条件下菌株生长、发酵液pH 值和酸度的影响,为进一步研究两菌株的互作关系,以及利用两菌株构建人工混合菌剂奠定基础。
1 材料与方法
1.1 供试菌株
酵母菌菌株Q3(布鲁塞尔酒香酵母Brettanomyces bruxellensis)和醋酸菌菌株Q4(葡萄糖醋杆菌Komagataeibacter rhaeticus)均为前期从红茶菌中分离得到的菌株[10-11],保藏于中国典型培养物菌种保藏中心(China Center for Type Culture Collection,CCTCC)。
1.2 培养基和试剂
酵母菌培养基、醋酸菌培养基和红茶糖水液体培养基参照汪鹏辉等[11]的配方和方法。酵母氮源基础培养基,自配[无氨基和硫酸铵酸酵母氮源(Yeast Nitrogen Base,YNB)6.7 g·L-1,葡萄糖35 g·L-1,配制10×YNB 基础母液,0.22 μm 滤膜过滤除菌,置于2~8 ℃保存]。红茶,福建省福州市好茗天茶叶有限公司;硝酸钾、亚硝酸钠、硫酸铵、氯化铵、无水葡萄糖、无水乙醇、碳酸钙和氢氧化钠(分析纯),西陇化工股份有限公司;乳糖、半乳糖、麦芽糖、酵母浸膏和琼脂,国药集团化学试剂有限公司;果糖、纤维二糖,上海麦克林生化科技有限公司;YNB 培养基(基础母液),上海生工生物工程有限公司。
1.3 试验方法
1.3.1 菌种的活化及培养条件
保藏于4 ℃条件下的菌株Q3 和Q4,无菌操作将菌株Q3 转接到酵母菌培养基、菌株Q4 转接到醋酸菌培养基,置于28 ℃恒温下活化培养2~3 d。后挑取两菌株单菌落分别接种至酵母菌液体培养基和醋酸菌液体培养基中,于28 ℃ 180 r·min-1培养48 h。随后,参照汪鹏辉等[11]的方法进行菌株Q3 和Q4 的单独培养。
1.3.2 碳源对菌株Q3、Q4 生长的产酸的影响
以未接菌的红茶糖水培养液作为对照组,将对照组中的白糖分别换成质量分数为3.5%的不同碳源物质(纤维二糖、果糖、乳糖、半乳糖、葡萄糖、麦芽糖),各取150 mL 不同碳源的培养液分装于250 mL 的锥形瓶中,冷却至室温,分别接入活化的菌株Q3 和Q4,置于28 ℃恒温静置培养12 d。培养过程中,每隔2 d取一次样,测定发酵液OD600值(表征菌株生长情况)、pH 值和总酸含量。每组试验设置3 个重复,每份样品测定3 次取平均值。
1.3.3 氮源对菌株Q3、Q4 生长和产酸的影响
以未接菌的YNB 培养液作对照组,在YNB 培养液中分别加入质量分数为0.5%的不同氮源物质(茶氨酸、谷氨酸、硝酸钾、亚硝酸钠、氯化铵和硫酸铵),各取150 mL YNB 培养液分装于250 mL 的锥形瓶中,冷却至室温,分别接入活化的菌株Q3 和Q4,于28 ℃恒温静置培养12 d。在培养过程中,每隔2 d 取一次样,测定发酵液OD600值(表征菌株生长情况)、pH 值和总酸含量。每组试验设置3 个重复,每份样品测定3 次取平均值。
1.4 测定方法
(1)OD600测定方法。参考汪鹏辉等[11]的测定方法,使用紫外可见光分光光度计,在波长600 nm 下测定菌液的OD600[11]。
(2)pH 的测定。用Starter 2100 pH 计测定发酵液的pH 值。
(3)总酸的测定。参照《食品安全国家标准 食品中总酸的测定》(GB/T 12456—2021)的方法操作,采用氢氧化钠滴定法测定总酸含量。
1.5 数据分析
数据用SPSS 19.0 软件进行方差分析,采用Origin 2021 作图。
2 结果与分析
2.1 碳源对菌株Q3 生长和产酸的影响
2.1.1 碳源对菌株Q3 生长的影响
由图1 可知,供试的7 种碳源物质均能促进菌株Q3 的生长,但促进作用的程度存在差异。添加乳糖和半乳糖为碳源时,菌株Q3 生长速度较为缓慢。果糖、葡萄糖、蔗糖、麦芽糖和纤维二糖为碳源时,菌株Q3的生长趋势一致。菌株Q3 的生长速度总体表现为果糖>葡萄糖>蔗糖>麦芽糖>纤维二糖>半乳糖>乳糖。

图1 碳源物质对菌株Q3 单独培养OD600 的影响图
2.1.2 碳源对菌株Q3 发酵液pH 值的影响
由图2 可知,在发酵0~2 d 时,不同碳源营养的菌株发酵液pH 值下降趋势较明显。发酵6~12 d,以乳糖为碳源的发酵液pH 值趋于稳定,维持在4.75~4.80。随着培养时间的延长,以其他糖类为碳源的发酵液pH 值持续下降。培养至12 d,除乳糖外,其他糖类的发酵液pH 值在4.20~4.40,差异不显著(P>0.05)。

图2 碳源物质对菌株Q3 单独培养pH 值的影响图
2.1.3 碳源对菌株Q3 发酵液总酸的影响
由图3 可知,除乳糖外,其他糖类为碳源的菌株Q3 发酵液酸度均随发酵时间延长逐渐上升。发酵12 d后,以乳糖为碳源的菌株发酵液总酸含量为0.28 g·L-1,与对照组差异不显著(P>0.05);其他糖类为碳源的发酵液总酸浓度在1.00~1.20 g·L-1,与对照相比差异极极显著(P<0.001)。

图3 碳源物质对菌株Q3 单独培养总酸的影响图
2.2 碳源对菌株Q4 生长和产酸的影响
2.2.1 碳源对菌株Q4 生长的影响
由图4 可知,菌株Q4 在葡萄糖为碳源的培养基中生长迅速,培养至6 d 时发酵液OD600达到最大值0.46,随后,OD600值急剧下降,培养12 d 时发酵液OD600值为0.18。与葡萄糖相比,菌株Q4 在其他6 种碳源的培养基中培养2 d 后生长较为缓慢,菌体浓度的变化趋势相似,均大体呈上升态势,OD600值没有显著差异(P>0.05)。
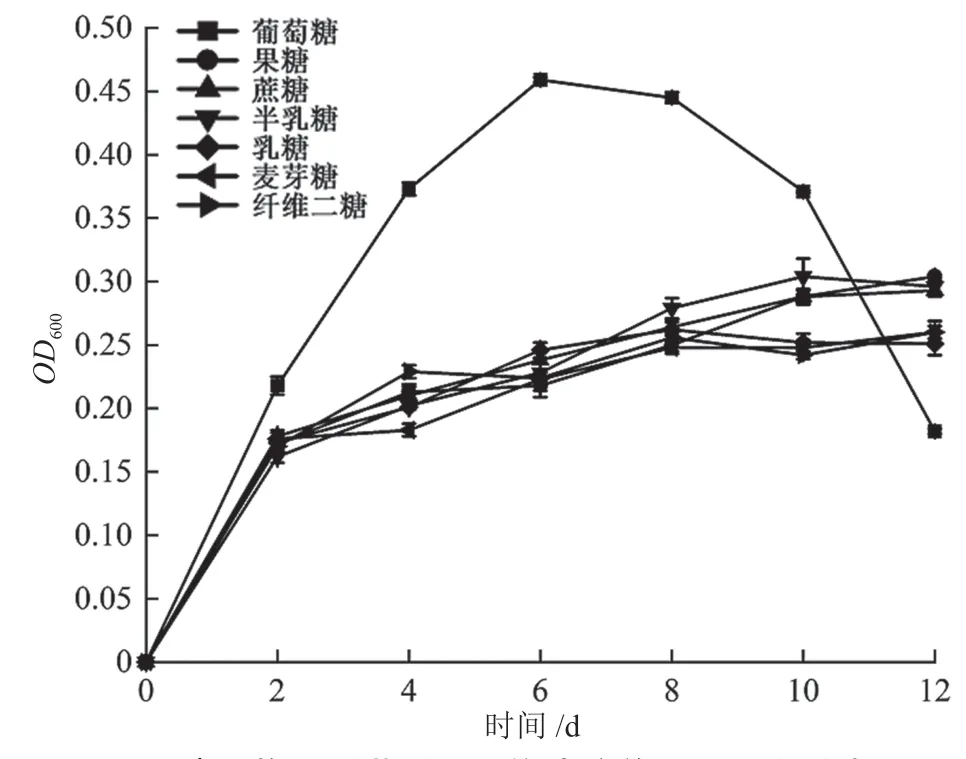
图4 碳源物质对菌株Q4 单独培养OD600 的影响图
2.2.2 碳源对菌株Q4 发酵液pH 值的影响
由图5 可知,菌株Q4 在不同碳源营养的培养液中发酵后,发酵液pH 值随发酵时间的延长呈现下降的趋势。其中,以葡萄糖为碳源的发酵液pH 值下降快,与对照和其他碳源的发酵液相比差异极极显著(P<0.001)。
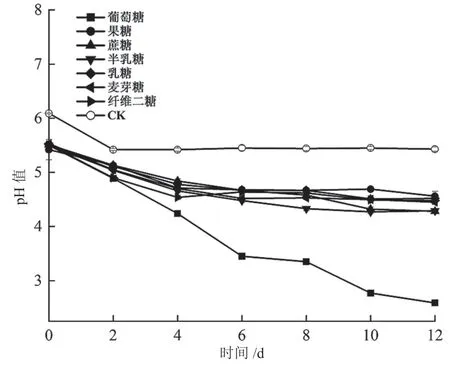
图5 碳源物质对菌株Q4 单独培养pH 的影响图
2.2.3 碳源对菌株Q4 发酵液总酸的影响
由图6 可知,培养4 d 后,以葡萄糖为碳源的菌株Q4 发酵液总酸含量急剧上升,培养到12 d,发酵液总酸含量达到4.94 g·L-1,与对照和其他碳源的发酵液相比差异极极显著(P<0.001)。其余6 种碳源的菌株发酵液总酸含量低于0.50 g·L-1,与对照相比差异不显著(P>0.05)。
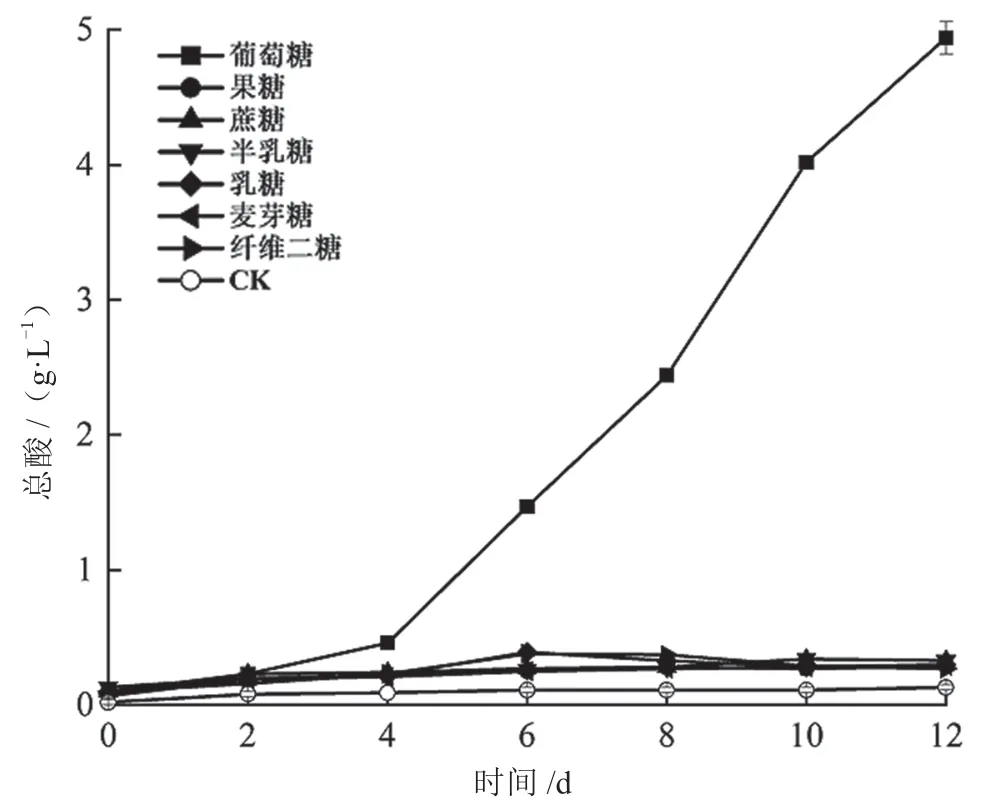
图6 碳源物质对菌株Q4 单独培养总酸的影响图
2.3 氮源对菌株Q3 生长和产酸的影响
2.3.1 氮源对菌株Q3 生长的影响
由图7 可知,菌株Q3 能够在以硫酸铵、氯化铵、茶氨酸、硝酸钾和谷氨酸为氮源的培养基中生长,但在以亚硝酸钠为氮源的培养基中几乎不生长。硫酸铵、氯化铵和茶氨酸为氮源能明显促进菌株Q3 生长;特别是两种铵盐,与其他氮源相比对菌株Q3 生长促进作用极极显著(P<0.001)。
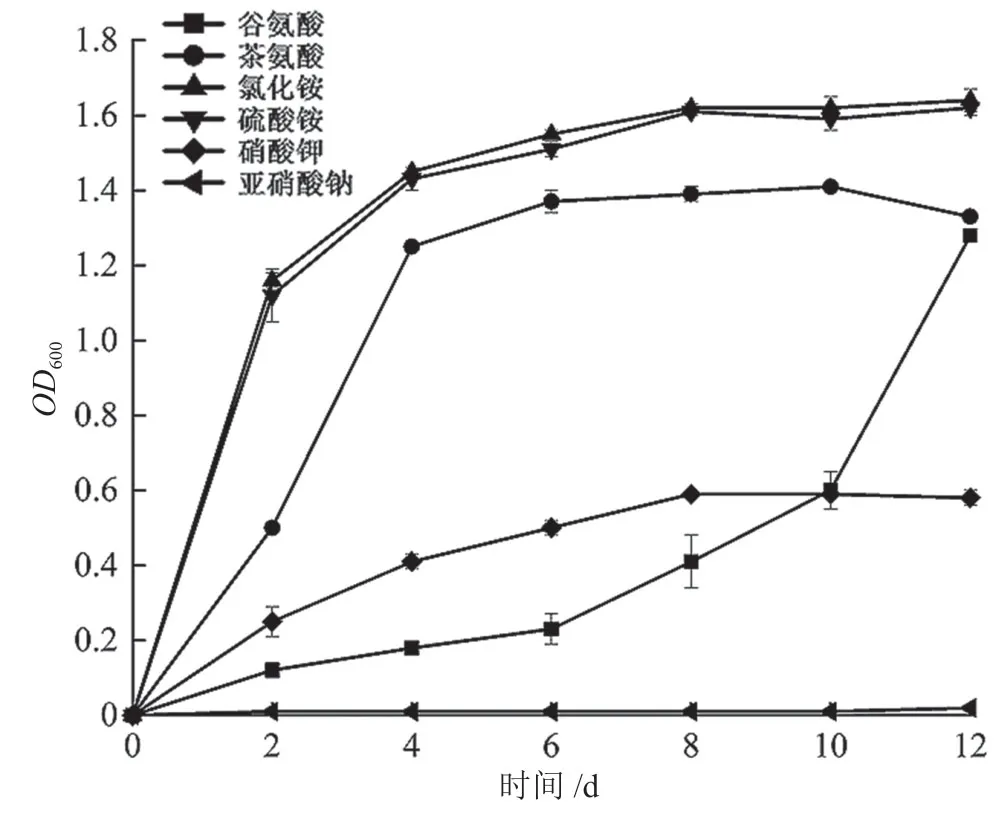
图7 氮源物质对菌株Q3 单独培养OD600 的影响图
2.3.2 氮源对菌株Q3 发酵液pH 值的影响
由图8 可知,添加亚硝酸钠为氮源时,pH 值高于对照组;其他5 种氮源发酵液的pH 值低于对照组。添加亚硝酸钠为氮源时,菌株Q3 发酵液pH 值呈现缓慢上升的趋势;以谷氨酸为氮源时,发酵液的pH 值变化不明显;添加其他4 种氮源物质发酵液pH 值逐渐下降。与对照组相比较,以两种铵盐为氮源,发酵液pH 值下降最明显(P<0.001)。
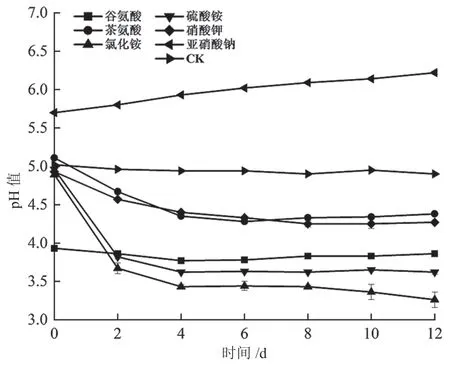
图8 氮源物质对菌株Q3 单独培养pH 的影响图
2.3.3 氮源对菌株Q3 发酵液总酸的影响
由图9 可知,除亚硝酸钠外,添加其他氮源物质的菌株Q3 发酵液总酸含量呈现上升的趋势。发酵12 d后,发酵液总酸量表现为谷氨酸>氯化铵>硫酸铵>茶氨酸>硝酸钾>亚硝酸钠。

图9 氮源物质对菌株Q3 单独培养总酸的影响图
2.4 氮源对菌株Q4 生长和产酸的影响
2.4.1 氮源对菌株Q4 生长的影响
由图10 可知,菌株Q4 在以茶氨酸为氮源的培养基中生长迅速,12 d 后菌体浓度极极显著大于其他5 种供试氮源物质(P<0.001)。在培养后期,以茶氨酸和谷氨酸为氮源的瓶中产生絮状物质(醋酸纤维),分析原因,可能是茶氨酸和谷氨酸这两种氨基酸为菌株Q4 提供生长所需的营养物质,这些营养物质刺激菌株Q4 分泌胞外多糖和蛋白质等物质产生絮状物质。

图10 氮源物质对菌株Q4 单独培养OD600 的影响图
2.4.2 氮源对菌株Q4 发酵液pH 值的影响
由图11 可知,以亚硝酸钠为氮源的发酵液pH 值维持在5.78~5.99,以其他5 种物质为氮源的菌株发酵液pH 值均呈缓慢下降趋势,菌株以谷氨酸为氮源的发酵液初始pH 值最低。

图11 氮源物质对菌株Q4 单独培养pH 的影响图
2.4.3 氮源对菌株Q4 发酵液总酸的影响
由图12 可知,以茶氨酸、谷氨酸、氯化铵和硫酸铵为氮源培养时,菌株Q4 发酵液总酸含量随时间变化而逐渐升高;培养10 d 后,以茶氨酸为氮源的发酵液总酸达到最大值5.30 g·L-1,极极显著高于对照组发酵液的总酸含量(P<0.001)。以亚硝酸钠和硝酸钾为氮源时,菌株发酵液的总酸含量变化较小,相对平稳。
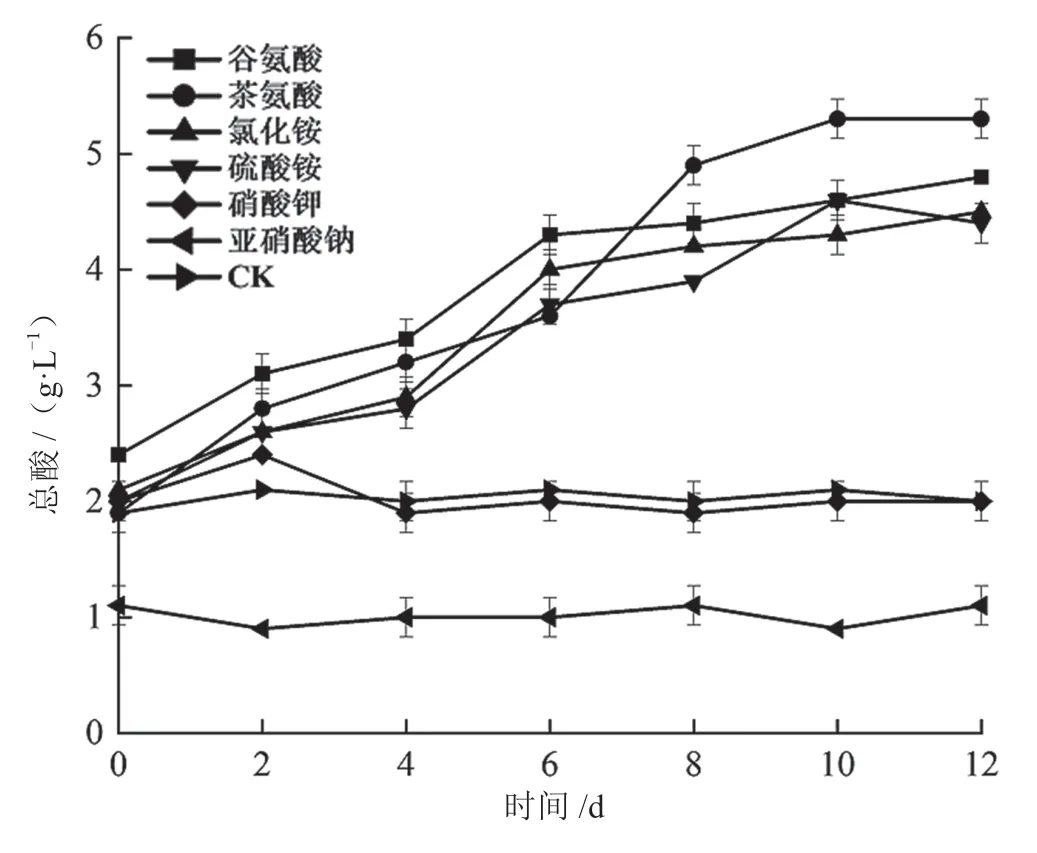
图12 氮源物质对菌株Q4 单独培养总酸的影响图
3 结论与讨论
布鲁塞尔酒香酵母和葡糖醋酸杆菌是茶菌自然发酵的优势菌株[1,3]。与葡萄酒、果醋和生物乙醇发酵相比,布鲁塞尔酒香酵母和葡糖醋酸杆菌菌株的营养需求和发酵性能在茶菌发酵系统中了解很少。
果糖、葡萄糖和蔗糖是菌株Q3 生长和产酸的良好碳源物质;硫酸铵、氯化铵是良好的氮源营养,而乳糖、硝酸钾对菌株Q3 生长和产酸促进作用弱,亚硝酸钠不利于菌株Q3 的生长和产酸。酒香酵母属的菌株碳源谱广,可利用丰富的碳水化合物,以葡萄糖作碳源较为适合[8]。在有氧和营养缺乏的条件下,酒香酵母可以利用乙醇和乙酸作为唯一碳源而生存;但在无氧条件下,酒香酵母又可以成为优良的乙醇生产菌株,可以耐受15%的乙醇含量和pH=3 的酸性环境[12]。酒香酵母可利用的氨基酸氮源广泛,以谷氨酰胺较好[13]。在单独培养条件下,菌株Q3 在茶糖水培养液中发酵产酸能力强于菌株Q4,尤其是谷氨酸对菌株Q3 产酸的促进作用,值得进一步关注。
相较于菌株Q3,菌株Q4 对供试碳源和氮源物质的选择更为严格;葡萄糖和茶氨酸分别是促进菌株Q4生长的最佳碳源和氮源物质。KOLESOVS 等[14]发现对菌株K.rhaeticusMSCL 1463 产膜有利的碳源成分是葡萄糖,而乳糖和半乳糖不利于产膜。简单碳源如甘露醇、甘油、葡萄糖和果糖有利于醋酸菌生长和产细菌纤维素膜[15]。在产纤维素醋酸菌的研究中,相对于碳源成分,对K.rhaeticus菌株氮源成分的研究明显不够。ASWINI 等[16]发现丰富氮源如酵母浸膏和牛肉浸膏对醋酸菌的产膜有利,而硝酸铵、硝酸钙和硝酸钠等硝态氮、胺态氮不利于纤维素的生产。
不同菌株的营养需求差异可能是茶菌发酵过程中菌株互作关系和菌群动态变化的基础[2]。茶菌发酵过程中微生物对茶叶成分的生物转化研究较多,茶叶成分的转化是形成茶菌营养、风味和生理功能的基础[1-2]。但是,营养成分如何影响发酵过程中微生物的生长、代谢和种群更迭,研究很缺乏。因此,分析碳、氮营养对菌株Q3 和Q4 生长和产酸特性的作用,可以为今后人工菌群的构建和发酵基质的开发打下基础。
