乳酸对ST 段抬高型心肌梗死患者PCI 后1 年内发生主要不良心脑血管事件的预测价值
2024-01-16王璐璐罗婷张盈盈
王璐璐,罗婷,张盈盈
作者单位:430022湖北省武汉市中西医结合医院 武汉市第一医院心内科
急性冠脉综合征(acute coronary syndrome,ACS)仍然是全世界死亡的主要原因[1]。急性冠状动脉事件全球注册中心研究表明,ACS患者1年后死亡率约为15%,5年后累积死亡率高达20%[2]。因此,早期风险分层对预防和治疗ACS非常重要[3]。研究表明,心脏缺血发作期间其代谢会迅速发生变化,表现为缺氧抑制脂肪酸、碳水化合物、酮和氨基酸的氧化代谢,并激活无氧糖酵解以控制氧气的使用[4];在氧气吸入和缺血代谢物排出的再灌注过程中,各种底物的氧化代谢被特异性启动,导致有氧糖酵解增加[5]。因此,心脏缺血和早期再灌注期间的代谢变化在很大程度上决定了心脏是否发生实际性损伤。乳酸为糖酵解的终产物,研究表明,乳酸是ACS患者预后的独立预测因素,其有助于识别预后不良患者[6]。乳酸水平升高提示组织的氧供应和代谢不足[7]。研究表明,对于合并难治性心源性休克或难治性心搏骤停的ACS患者,乳酸是唯一的生存预测因子[8]。然而,在接受经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的ST段抬高型心肌梗死(ST elevation myocardial infarction,STEMI)患者中,乳酸水平与临床结果之间的关系尚未得到充分评估。本研究旨在探讨乳酸对STEMI患者PCI后1年内主要不良心脑血管事件(major adverse cardiac and cerebrovascular events,MACCE)的预测价值。
1 对象与方法
1.1 研究对象
回顾性选取2019年1月—2022年1月在武汉市中西医结合医院住院的STEMI患者为研究对象。纳入标准:(1)符合《急性ST段抬高型心肌梗死诊断和治疗指南(2019)》[9]中STEMI的诊断标准;(2)接受PCI;(3)年龄18~80岁。排除标准:(1)过去3个月内有大手术、外伤或出血史者;(2)合并恶性肿瘤者;(3)肝脏或肾脏严重损伤者;(4)存在抗凝和抗血小板治疗禁忌证者;(5)临床资料不完整者。共有307例患者符合纳入标准,其中34例患者因未完成随访被排除,最终有273例患者被纳入统计分析。
1.2 资料收集
收集患者的临床资料,包括一般资料(年龄、性别、体质指数、心率、SBP、DBP、Killip分级、吸烟史、高血压史、糖尿病史、贫血史)、实验室检查指标〔乳酸、白细胞计数、中性粒细胞与血小板比值、血小板计数、白蛋白、空腹血糖、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、总胆固醇、三酰甘油、HDL-C、LDL-C、尿酸、肾小球滤过率(glomerular filtration rate,GFR)〕、病变血管数量、三支病变情况、支架数量、左心室射血分数(left ventricular ejection fraction,LVEF)、服用药物〔阿司匹林、氯吡格雷/替卡格雷、降胆固醇药、β-受体阻滞剂、血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)/血管紧张素Ⅱ受体拮抗剂(angiotensin Ⅱ receptor blocker,ARB)〕。
1.3 分组
根据乳酸水平三分位数将患者分为3个组:Q1组(乳酸≤1.60 mmol/L,n=91)、Q2组(1.60 mmol/L<乳酸≤2.00 mmol/L,n=91)和Q3组(乳酸>2.00 mmol/L,n=91)。
1.4 预后
通过门诊或电话随访1年,随访截至2023-02-01,记录STEMI患者PCI后MACCE发生情况,MACCE包括全因死亡、靶血管血运重建、心肌梗死、需要住院治疗的不稳定型心绞痛、心力衰竭、脑卒中或短暂性脑缺血发作等。
1.5 统计学方法
采用SPSS 19.0统计学软件进行数据处理。计数资料以相对数表示,组间比较采用χ2检验;计量资料符合正态分布以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验,两组间比较采用成组t检验;计量资料不符合正态分布以M(P25,P75)表示,多组间比较采用Kruskal-WallisH检验,两组间比较采用Mann-WhitneyU检验;采用Kaplan-Meier法绘制生存曲线,三组MACCE发生率比较采用Log-rank检验;STEMI患者PCI后1年内发生MACCE的影响因素分析采用多因素Cox比例风险回归分析;采用ROC曲线分析乳酸对STEMI患者PCI后1年内发生MACCE的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 三组临床资料比较
三组年龄、男性占比、心率、Killip分级>1级者占比、有吸烟史者占比、有贫血史者占比、白细胞计数、中性粒细胞与血小板比值、空腹血糖、HbA1c、尿酸、GFR、病变血管数量、支架数量、LVEF、服用阿司匹林者占比、服用氯吡格雷/替卡格雷者占比、服用降胆固醇药者占比、服用β-受体阻滞剂者占比、服用ACEI/ARB者占比比较,差异无统计学意义(P>0.05);三组体质指数、SBP、DBP、有高血压史者占比、有糖尿病史者占比、血小板计数、白蛋白、总胆固醇、三酰甘油、HDL-C、LDL-C、三支病变者占比比较,差异有统计学意义(P<0.05);其中,Q2组有糖尿病史者占比、血小板计数、总胆固醇、三酰甘油、HDL-C、LDL-C高于Q1组,Q3组体质指数、SBP、DBP、有高血压史者占比、有糖尿病史者占比、总胆固醇、三酰甘油、HDL-C、LDL-C、三支病变者占比高于Q1组,Q3组SBP、DBP、总胆固醇、三酰甘油高于Q2组,差异有统计学意义(P<0.01),见表1。
2.2 三组MACCE发生率比较
生存曲线分析结果显示,三组MACCE发生率比较,差异有统计学意义(χ2=17.30,P<0.001);其中Q2组和Q3组MACCE发生率高于Q1组,差异有统计学意义(P<0.01),见图1。

图1 三组MACCE发生率的生存曲线Figure 1 Survival curve of MACCE incidence of the three groups
2.3 STEMI患者PCI后1年内发生MACCE影响因素的单因素分析
STEMI 患者PCI 后1 年内发生MACCE100 例(36.6%)。发生MACCE者与未发生MACCE者男性占比、体质指数、心率、SBP、DBP、Killip分级>1级者占比、有吸烟史者占比、有高血压史者占比、有糖尿病史者占比、有贫血史者占比、白细胞计数、中性粒细胞与血小板比值、血小板计数、白蛋白、空腹血糖、HbA1c、总胆固醇、HDL-C、LDL-C、GFR、病变血管数量、三支病变者占比、支架数量、LVEF、服用阿司匹林者占比、服用氯吡格雷/替卡格雷者占比、服用降胆固醇药者占比、服用β-受体阻滞剂者占比、服用ACEI/ARB者占比比较,差异无统计学意义(P>0.05);发生MACCE者年龄小于未发生MACCE者,乳酸、三酰甘油、尿酸高于未发生MACCE者,差异有统计学意义(P<0.05),见表2。
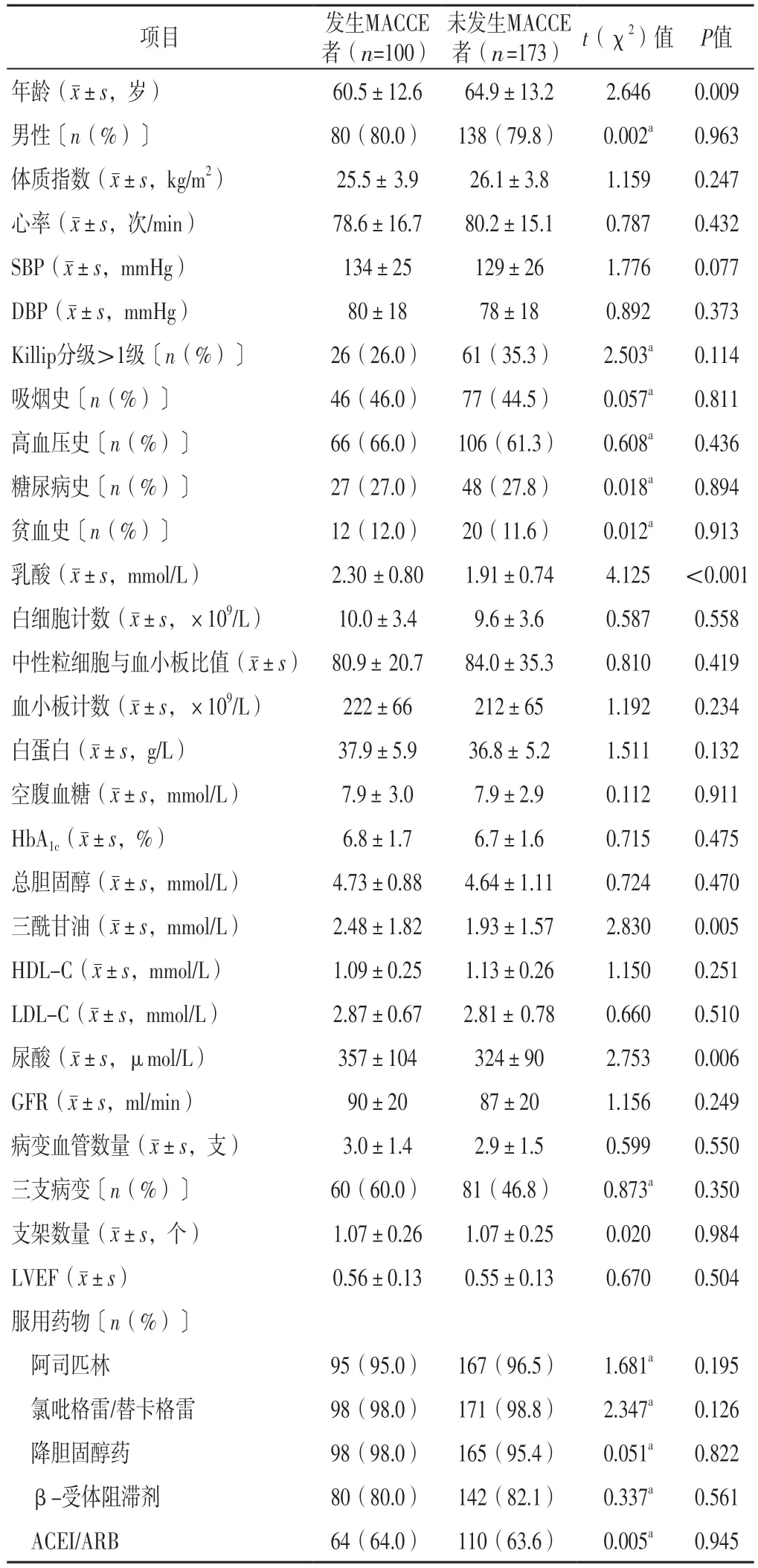
表2 STEMI患者PCI后1年内发生MACCE影响因素的单因素分析Table 2 Univariate analysis of influencing factors for MACCE within one year after PCI in patients with STEMI
2.4 STEMI患者PCI后1年内发生MACCE影响因素的多因素Cox比例风险回归分析
以STEMI患者PCI后1年内是否发生MACCE(赋值:否=0,是=1)为因变量,以表2中差异有统计学意义的项目(年龄、乳酸、三酰甘油、尿酸)为自变量(均为实测值),进行多因素Cox比例风险回归分析,结果显示,年龄、乳酸、尿酸为STEMI患者PCI后1年内发生MACCE的独立影响因素(P<0.05),见表3。
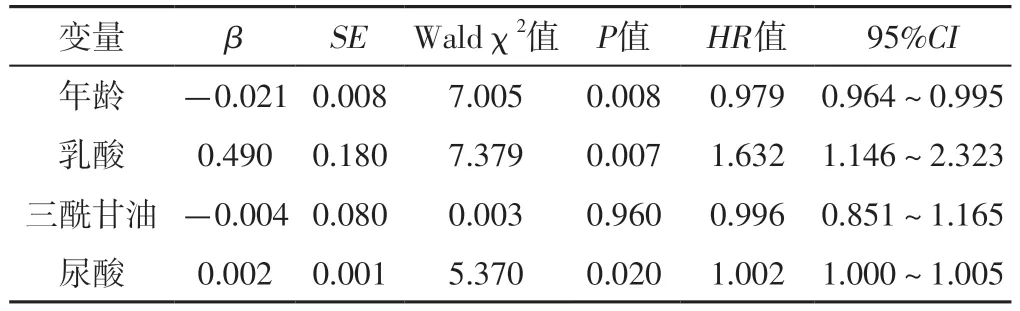
表3 STEMI患者PCI后1年内发生MACCE影响因素的多因素Cox比例风险回归分析Table 3 Multivariate Cox proportional risk regression analysis of influencing factors for MACCE within one year after PCI in patients with STEMI
2.5 乳酸对STEMI患者PCI后1年内发生MACCE的预测价值
ROC 曲线分析结果显示,乳酸预测STEMI 患者PCI后1年内发生MACCE的AUC为0.636〔95%CI(0.568~0.703)〕,最佳截断值为2.15 mmol/L,灵敏度为54.0%,特异度为60.7%,见图2。
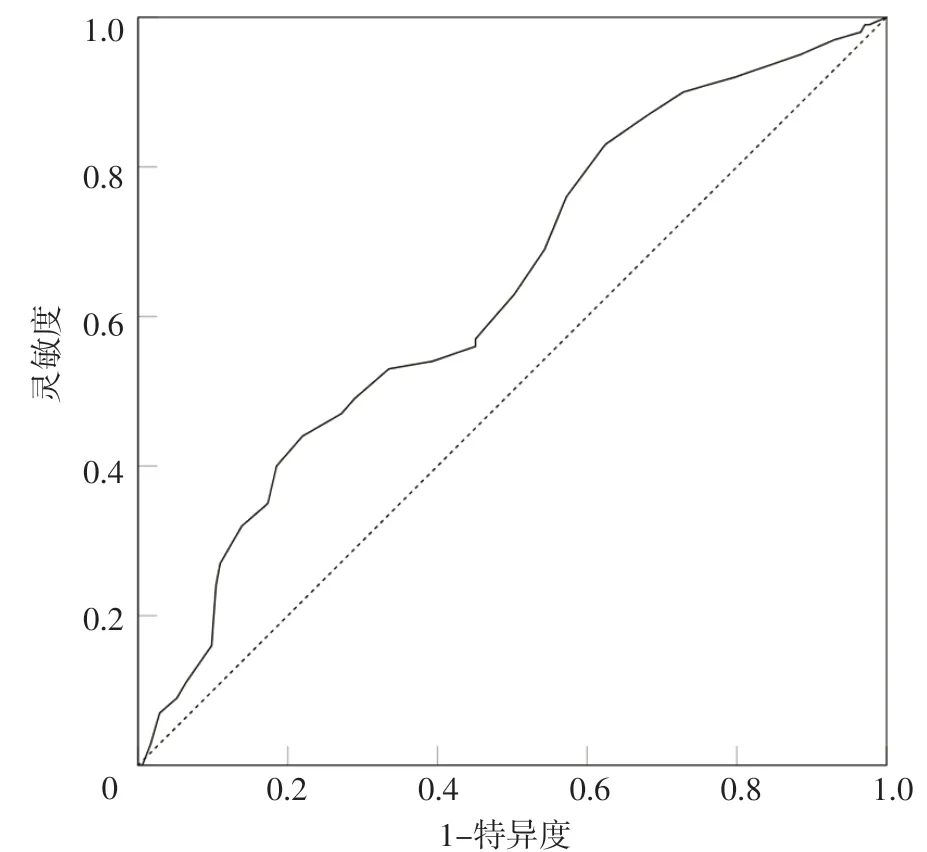
图2 乳酸预测STEMI患者PCI后1年内发生MACCE的ROC曲线Figure 2 ROC curve of the lactic acid for predicting MACCE within one year after PCI in patients with STEMI
3 讨论
乳酸被认为是缺氧期间糖酵解的最终产物,其可反映糖酵解途径的变化[10]。在急性组织局部缺血的情况下,体内乳酸生成增加[11]。乳酸是多种生理和病理过程中的活性信号分子[12]。乳酸盐穿梭于细胞质和细胞内,细胞内乳酸盐运输包括胞质溶胶-线粒体和胞质溶胶-过氧化物酶体穿梭,表明糖酵解和有氧代谢之间有联系[13]。目前,越来越多的证据表明,乳酸参与了多种疾病过程,如心肌梗死、脓毒症[14-15]。临床研究表明,乳酸水平升高与心力衰竭患者死亡率增加相关[16]。本研究结果显示,Q3组三支病变者占比高于Q1组,表明乳酸在一定程度上可反映STEMI的严重程度。据报道,糖酵解衍生的乳酸盐通过在组蛋白赖氨酸残基上添加乳糖酶基直接改变组蛋白,并在心脏纤维化过程中控制促纤维化基因的表达[17]。这些结果表明,乳酸参与了心肌梗死的病理过程。
就心脏的能量供应而言,正常心脏在静息时,脂肪酸的β-氧化可提供60%~90%的能量,而丙酮酸产生10%~40%的能量。由糖酵解合成的丙酮酸脱氢产生的乳酸,是心脏应激的重要能量来源[18]。运动时,心肌中乳酸的摄取和使用增加[19]。FREUND等[20]研究发现,乳酸水平升高(>2.00 mmol/L)与心源性休克患者短期死亡率增加独立相关。在STEMI患者中,较高的乳酸水平(≥1.80 mmol/L)与30 d死亡率和PCI总体不良反应独立相关[21]。一项纳入1 865例ACS患者的研究显示,入院时乳酸水平升高(≥1.80 mmol/L)是患者30 d和180 d全因死亡的独立预测因素[6]。此外,一项多中心观察性队列研究显示,心源性休克患者早期乳酸清除率升高可降低住院和12个月全因死亡率;心源性休克发病后24 h内乳酸清除率≥64%的患者可能会有良好的预后,尤其是那些初始血清乳酸>5.00 mmol/L的患者[22]。本研究结果显示,Q2组和Q3组MACCE发生率高于Q1组,乳酸为STEMI患者PCI后1年内发生MACCE的独立影响因素,乳酸预测STEMI患者PCI后1年内发生MACCE的AUC为0.636。STEMI后高乳酸血症可能是由血流动力学障碍后缺氧引起,或由儿茶酚胺诱导的糖酵解对压力的反应引起[23]。这些研究表明,乳酸可能在ACS过程中发挥重要作用,需要开展更多的研究来阐明乳酸与STEMI和代谢紊乱之间的确切机制。
4 结论
综上所述,乳酸>1.60 mmol/L的STEMI患者PCI后1年内MACCE发生率较高,且乳酸为STEMI患者PCI后1年内发生MACCE的独立影响因素,但其对STEMI患者PCI后1年内发生MACCE的预测价值有限。但本研究存在以下局限性:首先,本研究为单中心回顾性研究,可能存在偏倚,且随访时间不长;其次,未分析随访期间乳酸水平变化;再者,未纳入其他混杂因素,如心肺健康、营养情况和锻炼习惯等。今后需要更大样本量、更长随访时间和多中心研究验证本研究结论。
作者贡献:王璐璐进行文章的构思与设计,论文撰写,负责文章的质量控制及审校,对文章整体负责、监督管理;罗婷进行研究的实施与可行性分析,资料整理,统计学处理;王璐璐、罗婷进行资料收集;张盈盈进行论文的修订。
本文无利益冲突。
