RHO 分子筛空分性能评价
2024-01-16夏海月胡云峰包强孙鹏来王博萱梁丹
夏海月,胡云峰,包强,孙鹏来,王博萱,梁丹
(东北石油大学 化学化工学院,黑龙江 大庆 163318)
空气是宝贵的自然气体资源,其中氮气和氧气应用于众多工程以及制造业,这使得空分在商业上具有重要意义[1]。N2与O2的动力学直径仅相差0.18Å,通常从空气中将二者分离是利用低温蒸馏技术,但在冷却和压缩空气的过程中伴随着高成本的能耗[2]。20世纪70年代变压吸附(PSA)技术的出现[3],使空气分离过程变得更加经济。此外,选取合适的吸附剂也会对吸附分离空气产生较大的影响。
目前,用于空分的多孔材料分为两类,即N2选择性吸附剂和O2选择性吸附剂。工业上,一些N2选择性多孔材料如5A 沸石和13X 沸石在PSA空分领域得到了广泛的研究[4-6]。CHAO[7]等首次发明的Li-LSX 沸石因极化率较大的Li+与具有较高四极矩的N2相互作用,从而获得了更高的N2吸附容量。YANG[8]等以纯Ca-LSX 为例进行研究,发现其N2吸附能力比Li-LSX 更强。但考虑到空气中N2的体积分数是O2的4倍,如果使用O2选择性吸附剂,它所需要的工作量是用N2选择性吸附剂进行相同分离所需要工作量的四分之一[9],可使空分中吸附剂用量最小化。特别是在纯N2生产中,可以减少设备投资和能耗。因此,开发具有氧选择性的吸附剂可以显著地满足商业需求。实际上,应用4A 沸石和碳分子筛(CMS)进行空分制氮的工艺已经相对成熟。这类吸附剂进行空气分离是基于动力学分离的原理,利用混合组分的扩散、吸附速率差来实现的[10-11]。碱金属离子交换的RHO分子筛是一类新型O2选择性吸附剂,它是基于分子筛筛分效应对动力学直径小的O2进行择形吸附,从而实现空气分离。
RHO分子筛是一种双八元环均匀地连接在α笼上的小孔合成沸石,孔道尺寸(3.6 Å×3.6 Å)介于N2和O2的动力学直径之间[12-13]。RHO结构内有带负电荷的硅铝酸盐骨架,外有带正电荷的骨架外阳离子,这些框架外阳离子可以优先分布在3个位点上:单八元环(s8r)、双八元环(d8r)和单六元环(s6r),如图1所示[14]。
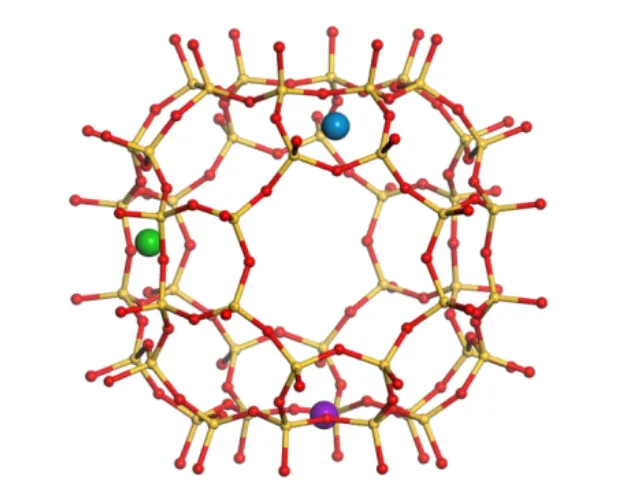
图1 RHO分子筛笼内阳离子位点
1 实验部分
1.1 试剂与仪器
主要试剂:18-冠醚-6、氢氧化钠、氢氧化铯、偏铝酸钠,纯度≥98%,上海阿拉丁生化科技股份有限公司;硅溶胶,碱性30%,青岛海洋化工厂;硝酸锂、氯化铯 ,纯度99%,上海阿拉丁生化科技股份有限公司;硝酸钠 ,纯度≥98.5%,北京化工厂;硝酸钾,纯度99%,辽宁市华东试剂厂;氮气、氧气,纯度≥99.9%,大庆雪龙石化技术开发有限公司。
主要仪器:电子天平,M204,梅特勒-托利多仪器有限公司; DF-101S 集热式恒温加热磁力搅拌器,上海羌强仪器设备有限公司;动态晶化烘箱;202-1A 电热恒温干燥箱,天津是泰斯特仪器有限公司;X 射线衍射仪,DMAX-2000 型,丹东通达科技有限公司;扫描电子显微镜,JEX-636OLA,日本JEOL 公司;高温高压气体吸附仪,3H-2000PH,贝士德仪器科技有限公司。
1.2 实验方法
1.2.1 Na,Cs-RHO 的合成
向烧杯中分别加入有机模板剂18-冠醚-6、去离子水、氢氧化铯和氢氧化钠,搅拌至完全溶解,然后向上述混合物中加入硅溶胶,继续在室温下陈化24 h 得到n(NaO2)∶n(CsO2)∶n(Al2O3)∶n(SiO2)∶n(18-C-6)∶n(H2O)=1.5∶0.8∶3∶25∶0.2∶100 的均匀凝胶[15]。将凝胶转移至高压反应釜中,然后在110 ℃的动态晶化箱中晶化96 h。反应停止后将产物抽滤,洗涤,100 ℃干燥12 h。最后放置在550 ℃的马弗炉中焙烧4 h,得到无水分以及模板剂的原粉Na,Cs-RHO 分子筛。
1.2.2 离子交换
在80 ℃水浴温度下,将3 g 分子筛原粉与150 mL 0.2 mol·L-1的M(NO3)x(M 代表Li+、Na+、K+和Cs+)进行混合并持续加热搅拌2 h,分别制备出Li-RHO、Na-RHO、K-RHO 和Cs-RHO。将上述样品洗涤,抽滤,然后100 ℃干燥12 h,再完成一次以上流程即可得到离子交换形式的 RHO 分子筛[16]。
1.2.3 结构表征
使用内部配有Cu 靶Kα 辐射光源的X 射线衍射仪采集了所有RHO 样品在2θ=5°~55°范围内的衍射数据,然后根据XRD 谱图中衍射峰的位置和强度确定样品的晶体结构。用扫描电子显微镜(SEM)对样品的晶体形貌进行表征。
1.3 吸附剂性能评价
吸附等温曲线测定:取1 g 样品,使用高温高压气体吸附仪测定25 ℃时0~1 000 kPa 压力下的单组分气体吸附容量。以压力为横坐标、吸附容量为纵坐标绘制吸附等温曲线,并利用Langmuir 模型方程对曲线进行拟合。
Langmuir 模型方程[17]:
式中:q—吸附剂的吸附容量,mmol·g-1;
qm—吸附剂的饱和吸附容量,mmol·g-1;
p—吸附压力,kPa;
b—Langmuir 参数。
分离性能参数S:
式中:i—纯组分O2;
j—纯组分N2;
Δq—对应组分的工作容量,mmol·g-1。
2 结果与分析
2.1 表征分析
2.1.1 X 射线衍射光谱分析
XRD 是测定沸石晶体结构最常用的分析方法,沸石的衍射峰强度可以判断沸石的结晶度。通过将每个样品的特征吸收峰强度和位置与标准卡片对照,可以确认沸石合成的准确性。
所有RHO 样品的XRD 谱图如图2 所示,与标准谱图(PDF#27-0015)的特征峰完全一致,衍射角度2θ均在8.32°、14.42°、18.66°、25.19°、27.85°、30.32°、33.73°、35.87°处呈现RHO 结构的特征峰。尽管阳离子交换后的RHO 分子筛衍射峰强度与Na,Cs-RHO 相比稍弱,但交换后的RHO 沸石衍射峰的衍射角并没有发生改变,所以阳离子交换并没有改变分子筛的骨架结构。
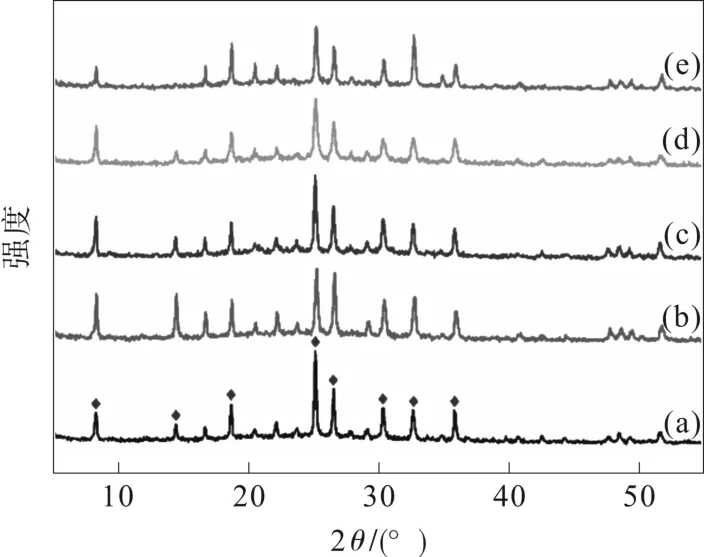
图2 RHO 分子筛XRD 图
2.1.2 扫描电镜分析
通过扫描电子显微镜对沸石的形貌和尺寸进行分析,图3 呈现了每个样品SEM 图像。从图像中可以清楚地看到完整的球形晶体颗粒,颗粒尺寸约为1~2μm。在进行阳离子交换后,颗粒形貌依然完整,观察到分子筛表面微微地被腐蚀,结晶度略低于Na,Cs-RH O。虽然阳离子的引入对结晶度有一定影响,但RHO晶体结构并没有坍塌,这与XRD 结果一致。

图3 RHO 分子筛SEM图
2.2 纯组分吸附分离评价
测定单组分气体的吸附等温线,来评价不同碱金属阳离子交换的RHO分子筛的O2/N2分离能力。298K 时0~1000kPa 下分别测定Na,Cs-RHO、Li-RHO、Na-RHO、K-RHO和Cs-RHO对O2和N2的吸附等温线,如图4所示。所有实验吸附数据均采用Langmuir 模型拟合,拟合参数见表1。分离性能参数是衡量混合气体分离性能的一个重要指标,因此利用Langmuir 模型拟合的吸附数据对分离性能参数进行计算,以便于更精准地对不同样品进行评价。

图4 所有RHO分子筛对O2和N2的吸附等温线
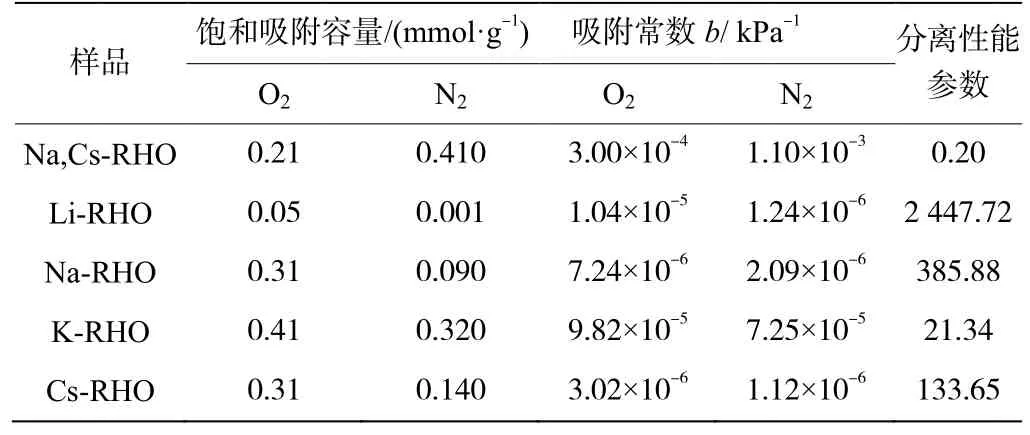
表1 Langmuir模型拟合单组分O2和N2在RHO分子筛上的吸附等温线以及O2/N2分离性能参数
吸附测试结果表明,原粉Na,Cs-RHO的N2饱和吸附容量明显高于O2,而通过4种碱金属阳离子交换的RHO分子筛则体现出对O2的择形吸附。一般情况下,分子筛主要根据2种吸附分离机理对不同组分进行选择性吸附[18],其一是择性吸附,当动力学尺寸小的吸附质分子均可通过沸石孔道时,选择性吸附主要体现在吸附质分子之间的四极矩、极化率和偶极矩的差异导致与分子筛产生不同强度的作用,分子极性越强越易被吸附;其二是择形吸附,指的是吸附质分子的动力学尺寸小于沸石孔径并且形状适宜,可以自由地扩散到沸石内部,而其它尺寸较大的分子被限制在外面,这是一种尺寸筛分效应[19]。Na,Cs-RHO主要是择性机理占主导地位,通过对其吸附等温结果分析,直径小的两种分子均可通过Na,Cs-RHO沸石孔道,因此O2和N2的饱和吸附容量较高。
O2和N2的气体物理参数如表2所示。由表2可知,O2和N2的极化率相似,N2的四极矩是O2的4 倍,因而高的N2饱和吸附容量是Na,Cs-RHO沸石的场梯度与N2的四极矩发生强相互作用的结果。

表2 O2和N2的气体物理参数
分析图4 和表1 的数据发现4 种碱金属阳离子交换的RHO 分子筛对O2和N2的吸附分离机理改变,择形吸附使得它们的O2饱和吸附容量均高于N2,并且 O2的饱和吸附容量由大到小顺序为K-RHO、Na-RHO、Cs-RHO、Li-RHO。由于RHO分子筛原粉中存在一定数量的Na+和Cs+,理论上当交换比它们半径小的阳离子后,动力学尺寸小的吸附质分子的饱和吸附容量应该增加,反之减少。然而事实并非如此,Li-RHO 和K-RHO 对O2饱和吸附容量出现明显反常,这可能是由于RHO 的有效孔径变化不仅与引入的阳离子半径有关,而且阳离子在分子筛框架中占据的位置也起到决定性的作用。已有研究表明,Li+优先占据s6r位点,Na+优先占据s8r位点,K+优先占据s8r和d8r位点,Cs+优先占据d8r位点[12,20]。RHO 分子筛框架中引入Li+后,没有与s8r和d8r窗口位置的Na+和Cs+交换,而是直接作用在α 笼内的s6r位点,此时需要电荷平衡这个位点,因而分子筛框架会发生扭曲导致形变,从而使Li-RHO 的窗口有效孔径明显减小,择形性明显增加。当RHO 分子筛框架中引入K+后,K+同时与s8r位点的Na+和d8r位点的Cs+交换。另外,据K-RHO 对O2和N2的饱和吸附容量数据分析,K+与半径更大的Cs+交换的数量可能多于Na+,所以导致RHO 分子筛的窗口有效孔径明显增大,O2和N2的饱和吸附容量均增加,同时伴随着O2/N2分离性能参数急剧下降。
2.3 混合组分分离评价
2.3.1 Aspen Adsorption 模拟穿透曲线
一般的O2选择性吸附剂依据混合组分的扩散、吸附速率差进行分离。因此为了将Li-RHO 分子筛与4A 沸石和碳分子筛(CMS)等传统O2选择性吸附剂进行比较,本研究借助Aspen Adsorption 软件模拟了空气在3 种吸附剂上的穿透曲线,见图5。原料气由79%N2/21%O2组成,进料温度为298.15 K,吸附压力为2 bar,解吸压力为0.3 bar,进料流量为0.4 m3·h-1。
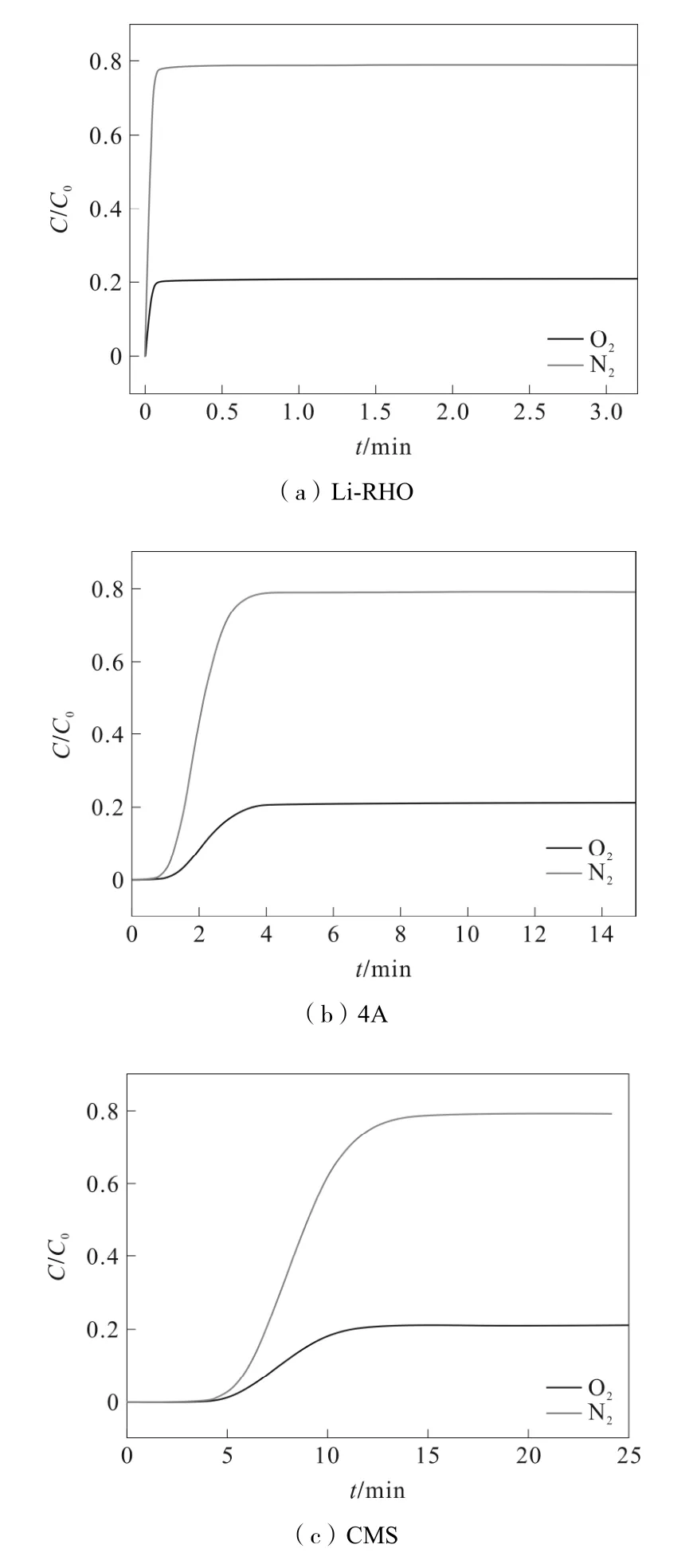
图5 O2/N2混合组分在3 种分子筛上的穿透曲线
由图5 可知,弱吸附组分(N2)优先穿透吸附床层,O2因强吸附而后穿出。随着吸附剂孔径尺寸的增加,混合组分吸附容量增加,扩散速率减小,因此穿透时间较长。根据混合气在3 种吸附剂上的穿透曲线,计算了每一组分的扩散速率以及混合组分的动力学分离因子,如表3 所示。
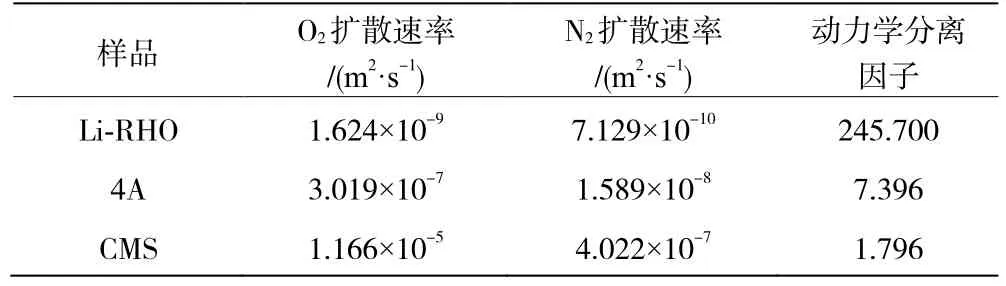
表3 O2/N2混合组分在3 种分子筛上的动力学分离性能
由表3 可知,Li-RHO 的O2和N2扩散速率最小,说明它们的吸附容量不高,但O2/N2分离因子最大,充分体现了Li-RHO 分子筛的有效孔径对O2的选择性。这一结果与Li-RHO 的择形吸附分离机理完全吻合,实验表明Li-RHO 可能是一种很有应用前景的空分吸附剂。
2.3.2 Aspen Adsorption 模拟双塔PSA 空气分离工艺
为了进一步评价Li-RHO 分子筛的性能,再一次借助Aspen Adsorption 软件进行双塔PSA 空气分离模拟,原料气的组成以及实验条件同上。将双塔PSA 空分制氮的能耗、纯度和回收率作为评价3 种O2选择性吸附剂的指标,为了便于比较,将N2的纯度最高优化至91%~92%,表4 呈现了模拟结果。实验表明,3 种吸附剂制得相似纯度的N2时,所消耗的能量相近,其中Li-RHO 的N2回收率为95.79%,明显高于4A 沸石和CMS。此模拟结果进一步验证Li-RHO 可能是一种新颖的空分吸附剂。

表4 Aspen Adsorption 双塔PSA 空分模拟结果
3 结 论
Li+交换改性后的RHO 分子筛仍保持原有结构以及晶体形貌。吸附等温曲线和穿透曲线均体现了Li-RHO 分子筛对O2的择形吸附作用,O2/N2的分离选择性参数最大,主要由Li+占据特定的位点使分子筛框架扭曲所致。另外,Aspen Adsorption 软件模拟Li-RHO 双塔PSA 空分制得的N2回收率超过已经工业化的CMS。
