新型氮肥增效剂N-life 对棉花生理特性、氮肥利用率、产量和纤维品质的影响
2024-01-16马心雨祝越熠石钇琦祝水金赵天伦
马心雨,祝越熠,石钇琦,祝水金*,赵天伦*
(1.浙江大学海南研究院,海南三亚 572025;2.浙江大学农业与生物技术学院,杭州 310058)
棉花是重要的经济作物,但棉花单位面积的肥料投入量远远超过一般的大田作物[1]。 在诸多的肥料投入中,氮肥用量占比最大,为60%左右,对棉花产量的影响也最为显著[2]。 氮肥投入过量或不足均会影响棉花产量[3]。 过量施氮会导致棉花营养生长旺盛,生殖生长养分供应减少,植株总干物质积累量升高,但生殖器官干物质积累量降低,棉花单株结铃数和铃重提升不明显,对产量造成不利影响[3-4]。 施氮量不足不利于果枝生物量积累,进而影响皮棉产量和纤维品质[5]。 李伶俐等[6]发现施氮量不足会导致叶片光合速率降低,光合产物减少,叶片早衰,进而导致严重减产。 适量的氮肥投入有利于棉花生殖生长,从而获得高产。 我国棉田普遍存在氮肥施用量高而利用率低的问题[7],氮肥单季利用率仅有30%~35%,远低于世界发达国家水平[8-10]。此外,过量施入氨肥后,不仅导致氮肥利用率下降,且土壤中的氨含量超出土壤库容时会造成硝态氮淋溶及氨挥发,引发环境问题[10-11]。 因此,探究提高棉花氮肥利用率的方法具有重要的意义。
硝化作用是造成氮素损失的重要原因之一。硝化抑制剂直接影响土壤氮素转化过程,间接影响作物的生长发育、产量和品质[12]。我国与氮肥配施的硝化抑制剂主要有双氰胺(dicyandiamide,DCD)、3,4-二甲基吡唑磷酸盐(3,4-dimethylpyrazole phosphate,DMPP)、2- 氯-6(三氯甲基)吡啶(简称氯啶,nitrapyrin)和乙炔(C2H2)等[13],它们主要通过降低耕作层土壤中的氨氧化古菌(ammoniaoxidizing archaea,AOA)和氨氧化细菌(ammoniaoxidizing bacteria,AOB)的种群丰度,改变微生物群落结构,从而影响土壤硝化作用[14]。 研究表明,氯啶能使根际土壤氮素含量增加28%,活性氮气体排放量降低51%,氮素淋失减少16%,最终使作物产量提高7%[15]。 Zhang 等[16]研究发现氯啶能够使N2O 的排放量降低6.6%~21.8%。氯啶可降低土壤中纤维素降解微生物群落的多样性,对土壤CO2的排放也有一定的缓解作用[16]。 此外,氯啶还影响种子发芽。 陶瑞等[17]发现氯啶浸种能够提升棉花种子在盐胁迫下的抗氧化酶活性,提高种子发芽率和发芽势。 然而,氯啶在常温常压下易发生明显的挥散,虽通过加入土壤中可以减少挥散作用[18],但因其熔点低,在产品流通、保存和施用过程中易发生升华而失效。 基于此,浙江大学生物纳米工程中心采用纳米技术负载氯啶,研发出氮肥增效剂N-life。 与普通氯啶相比,N-life具有货架期长和作用时间长等特点,能充分发挥其硝化抑制作用。
本研究以棉花品种浙大12 号为材料,2021―2022 年在海南省三亚市开展大田试验和大棚盆栽试验,在不同减氮水平下施用N-life,通过对棉花的农艺性状、生理生化指标、氮肥利用率以及产量和纤维品质等进行调查研究,探究N-life 应用于棉花生产的效果,为N-life 在棉花生产中的应用提供依据。
1 材料与方法
1.1 试验材料
本研究的试验材料为杂交棉品种浙大12号, 由浙江大学海南研究院2020 年在海南三亚制种。
N-life 是由浙江大学生物纳米工程中心研发的硝化抑制剂(暂无产品登记证号)。 该抑制剂是以尿素为载体,采用纳米技术用有机和无机材料分层包裹氯啶,具有抑制氯啶升华、货架时间长和缓释的特点。 本试验选用2020 年8 月份生产的产品。
试验用氮肥为尿素(含纯N 46%),复合肥为15-15-15 通用型复合肥(纯N、P2O5、K2O 质量分数均为15%)。
1.2 试验地概况
试验设于海南省三亚市崖城区,属热带气候区。 海南省气象局统计数据显示,该地区光照充足,雨量充沛,温暖湿润,年平均气温为24.5 ℃,年平均地面温度为28.3 ℃, 年平均降水量为1 347.5 mm,全年无霜,年平均日照时间为2 534 h,年平均蒸发量为1 223.7 mm。 试验点土壤基础肥力详见表1。

表1 试验地土壤基础肥力Table 1 The original soil-fertility in the experimental field
1.3 试验设计
1.3.1大田试验。 采用两因素裂区试验设计,主区为每667 m2N-life 施用量A1:1.5 kg、A2:0 kg,副区为每667 m2纯氮施用水平B1:19.0 kg、B2:17.1 kg、B3:15.2 kg (2021 年);2022 年增加B4:13.3 kg,其中B1 为常规氮肥用量,B2~B4 为减氮用量。 每个处理设4 次重复,小区行长6 m,6 行区,行距为65 cm,株距为30 cm 小区面积为20.5 m2。 分别于2021 年10 月3 日和2022 年10月12 日播种,采用地膜覆盖。 覆膜前采用沟施方式将N-life 和尿素一次性施入棉田。 由于N-life是以尿素为主要载体,因此不施用N-life 的处理每667 m2增施1.5 kg 尿素,各处理尿素和N-life 的具体用量见表2。 每667 m2基施复合肥50 kg。 其他栽培管理措施同当地常规棉田。
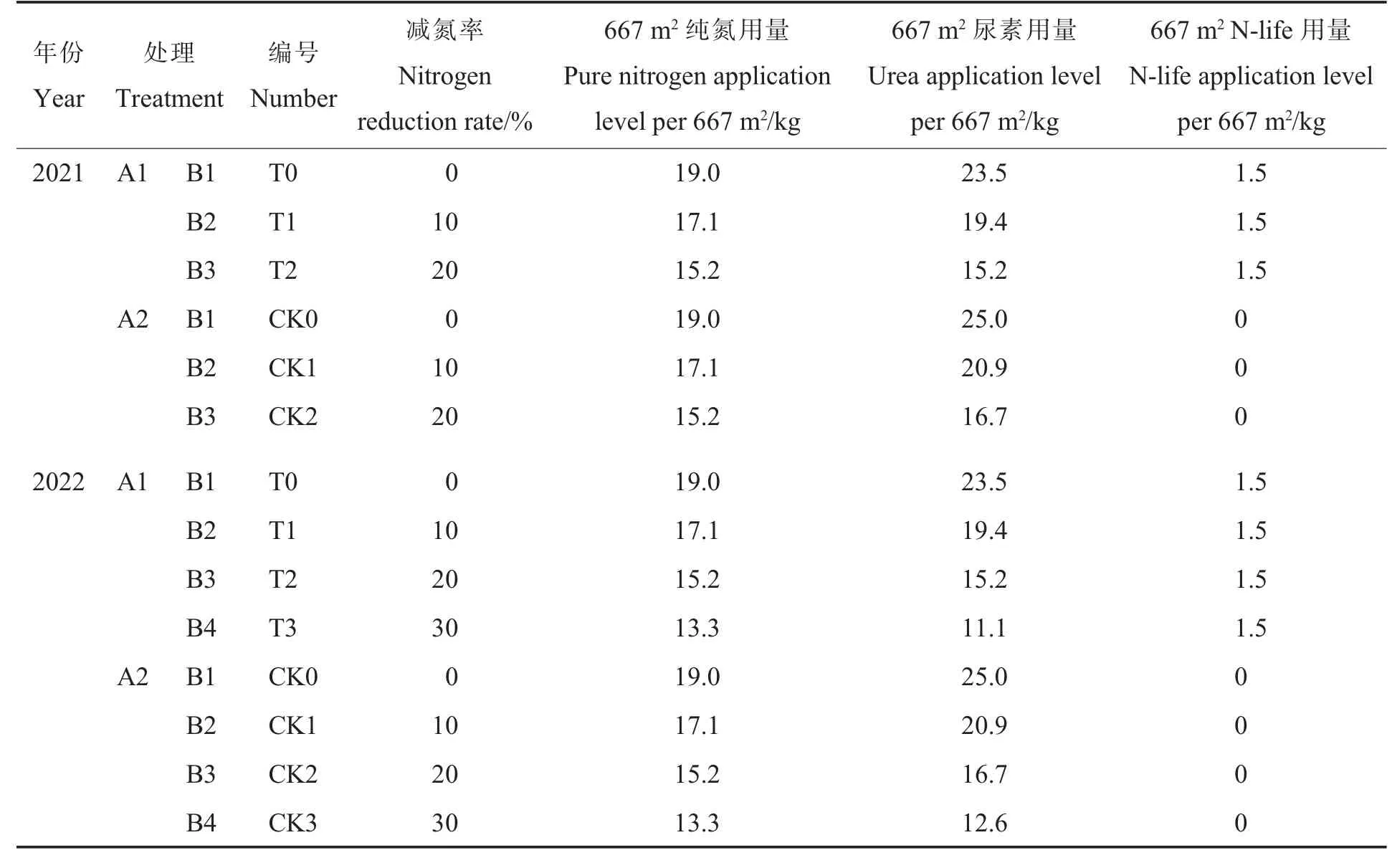
表2 不同处理氮素及N-life 的用量Table 2 Application levels of nitrogen and N-life in different treatments
1.3.2盆栽试验。 为精确测定施用N-life 对棉花氮肥利用率的影响,本研究同时设计避雨盆栽试验。 将直径为20 cm、高24.5 cm、内装15 kg 与大棚相同土质(砂壤土)的塑料盆分别于2021 年10月10 日和2022 年10 月15 日埋入大棚试验地中,盆口与试验地相平,每盆种植1 株棉花。 播种前将尿素和N-life 均匀施于土中。 各处理具体的尿素和N-life 用量见表3, 每个处理重复10 次。整个试验周期避雨以防氮素淋失。 浇水、除草等田间管理措施同大棚棉花管理。
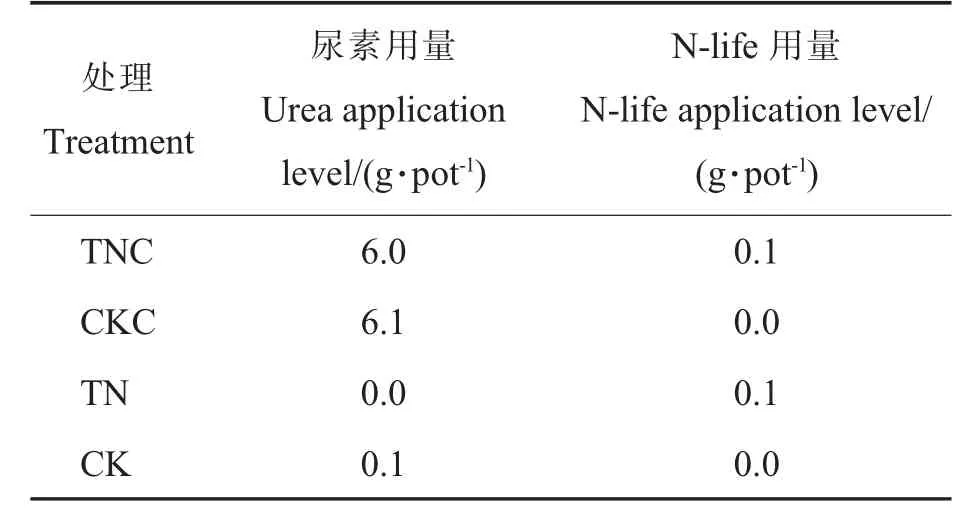
表3 大棚盆栽试验处理Table 3 Treatments of the pot experiment in greenhouse
1.4 性状指标测定
1.4.1酶活性和丙二醛(malondialdehycle,MDA)含量测定。 棉花苗期、花铃期和吐絮期,在每个小区分别取生长状况一致的5 株棉花的倒4叶,混合样品,重复3 次测定酶活性。 超氧化物歧化酶(superoxide dismutase,SOD)活性测定采用氮蓝四唑(nitro-blue tetrazolium, NBT)光还原法[19],过氧化物酶(peroxidase,POD)活性测定采用愈创木酚法[17],过氧化氢酶(catalase, CAT)活性测定采用紫外分光光度计比色法[20],MDA 含量测定采用硫代巴比妥酸法[21],棉花硝酸还原酶(nitrate reductase,NR)活性测定采用苏州格锐思生物科技有限公司硝酸还原酶(NR)试剂盒。
1.4.2光合作用指标测定。 使用LI-6800 光合仪(美国LI-COR 公司)测定棉花苗期、花铃期和吐絮期光合作用指标,每个小区随机选择3 株棉花的倒4 叶,测定指标包括:净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、胞间CO2浓度(intercellular carbon dioxide concentration,Ci)和气孔导度(stomatal conductance,Gs),重复测定3 次。
1.4.3氮含量测定和相关指标计算方法。 收获期取所有盆栽棉株分别装入牛皮纸袋中,105 ℃杀青30 min,80 ℃烘干至质量恒定, 测定其干物质质量。 采用凯式定氮法测定单株氮含量和盆栽土壤中的初始氮含量及试验结束时的最终氮含量。氮损失(g·pot-1)=土壤初始氮含量-土壤最终氮含量-植株氮含量,氮肥利用率(%)=棉株氮素积累总量/(土壤初始氮含量-土壤最终氮含量)×100%。
1.4.4棉花农艺性状和产量性状测定。 棉花吐絮期(3 月中旬),每个小区随机选取生长正常的10株棉花,调查其株高、单株果枝数、单株青铃数、单株吐絮铃数和单株烂铃数。 每个小区随机收取正常吐絮棉铃50 个,测定铃重,轧花后测定皮棉质量用于计算衣分,以实际收获计产,折算为每667 m2籽棉产量,根据籽棉产量和衣分计算皮棉产量。
1.4.5纤维品质测定。每个小区取20 g 皮棉样品送农业农村部棉花品质监督检验测试中心(河南安阳)测定纤维上半部平均长度、长度整齐度指数、断裂比强度、马克隆值和断裂伸长率。
1.5 数据统计与分析
采用Microsoft Excel 2019 对数据进行整理。用SPSS 26 软件进行统计分析,用图基(Tukey)检验法进行差异显著性分析,用Origin 2021 软件作图。
2 结果与分析
2.1 N-life 对棉花植株生理生化指标的影响
2.1.1SOD 活性。 如图1 所示,在2 年的田间试验中,苗期施用N-life 对减氮处理下的棉花叶片SOD 活性无显著影响。 花铃期,2021 年施用N-life 处理(T0、T1、T2)的棉花叶片SOD 活性分别较各自对照(CK0、CK1、CK2)提升7.1%、26.8%和32.3%,2022 年施用N-life 处理(T0、T1、T2、T3) 的棉花叶片SOD 活性分别较各自对照(CK0、CK1、CK2、CK3)提升10.6%、26.3%、33.3%和33.8%。 吐絮期,施用N-life 对棉花叶片SOD活性提升效果显著,2021 年和2022 年的增幅分别为17.4%~29.4%和19.8%~30.7%,其中减氮20%处理的增幅最大。 与不施用N-life 的对照相比,施用N-life 可以显著提升减氮处理下花铃期和吐絮期棉花叶片的SOD 活性。

图1 N-life 对不同发育时期棉花叶片SOD、POD 和CAT 活性的影响Fig.1 Effects of N-life on SOD, POD, and CAT activity of cotton leaves at different developmental stages
2.1.2POD 活性。 与对照相比,施用N-life 对苗期、 花铃期和吐絮期棉花叶片的POD 活性均有一定提升效果(图1)。 苗期,2021 年施用N-life处理(T0、T1、T2)的POD 活性与各自对照(CK0、CK1、CK2)相比分别提升19.0%、0.5%和4.8%,2022 年T0、T1、T2、T3 处理的POD 活性较CK0、CK1、CK2、CK3 处理分别提升11.1%、6.1%、1.0%和5.5%,2 年试验中N-life 均对不减氮处理的棉花叶片POD 活性提升效果最明显。 花铃期,2021 年施用N-life 处理(T0、T1、T2)的棉花叶片POD 活性较各自对照显著提升15.4%~39.1%,2022 年施用N-life 处理(T0、T1、T2、T3)的棉花叶片POD 活性较其对照显著提升11.8%~38.8%,其中减氮20%处理的增幅最大。 吐絮期,2021 年和2022 年田间试验中施用N-life 处理对POD 活性的提升幅度分别为37.2%~65.3%和30.9%~84.5%,均与对照存在显著差异。综上,花铃期和吐絮期施用N-life 的棉花叶片POD 活性显著高于对照。
2.1.3CAT 活性。 苗期,2021 年T0 处理的棉花叶片CAT 活性显著高于CK0;减氮处理中,施用N-life 处理的棉花叶片CAT 活性与其对照无显著差异。 花铃期和吐絮期施用N-life 处理(花铃期T0 处理除外)的棉花叶片CAT 活性显著高于其对照。 2021 年,花铃期和吐絮期施用N-life 处理(T0、T1 和T2)的棉花叶片CAT 活性较各自对照(CK0、CK1 和CK2)分别增加6.8%~30.8%和19.7%~34.3%,2022 年花铃期和吐絮期棉花叶片的CAT 活性增幅分别为10.3%~32.3%和22.0%~24.5%(图1)。综上,施用N-life 可以有效提升棉花生长发育中后期叶片的CAT 活性。
2.1.4MDA 含量。 2021 年,苗期T0 处理的棉花叶片MDA 含量显著低于CK0,花铃期T1 和T2处理的棉花叶片MDA 含量显著低于其对照(CK1 和CK2),吐絮期T0、T1 和T2 处理的棉花叶片MDA 含量均显著低于其对照(CK0、CK1 和CK2)。2022 年,与各自对照相比,苗期施用N-life处理的棉花叶片MDA 含量无显著变化,花铃期CK1、CK2 和CK3 处理以及吐絮期CK0、CK1、CK2 和CK3 处理的叶片MDA 含量均显著降低(图2)。 说明施用N-life 可以显著减少棉花生长发育中后期叶片MDA 的积累量。
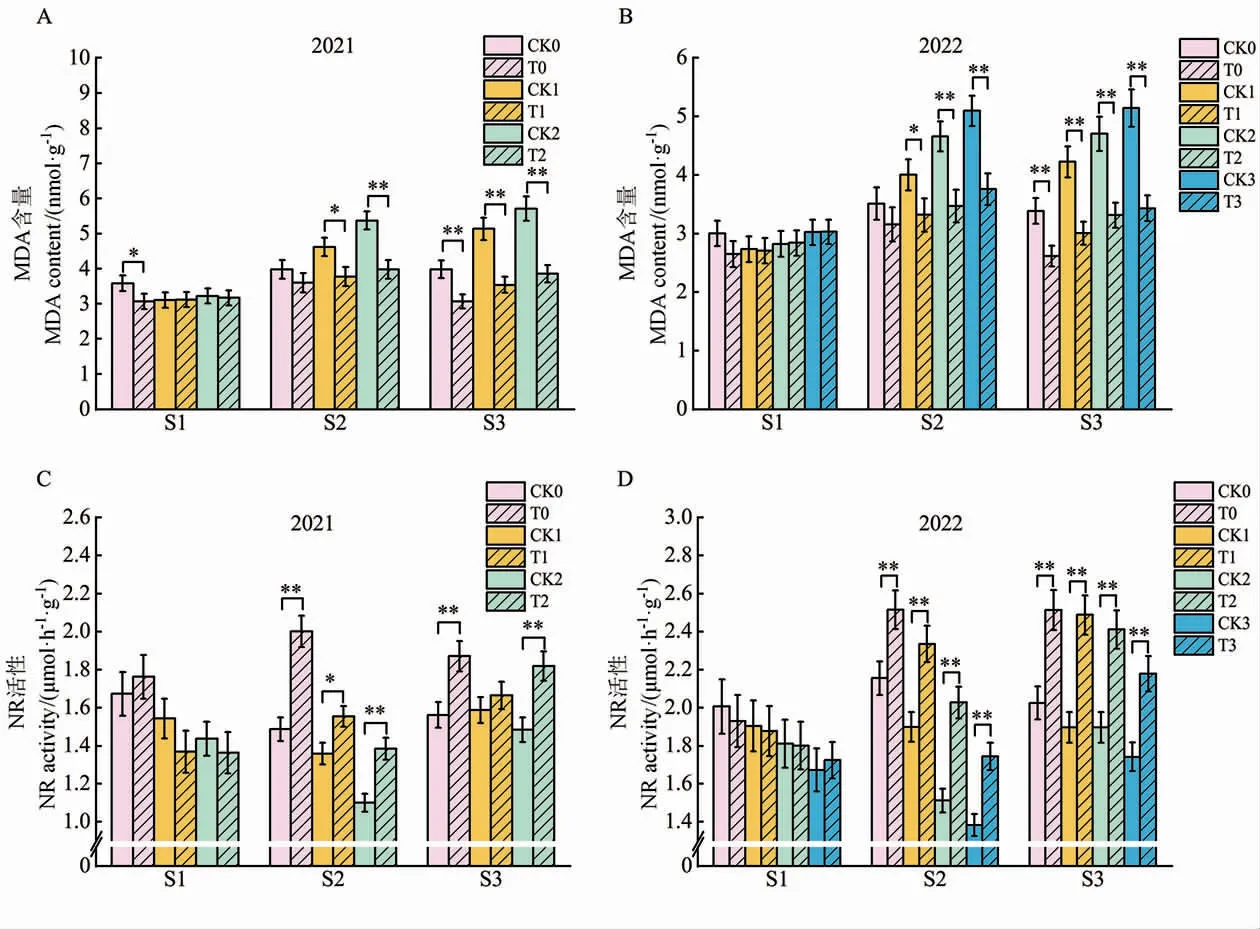
图2 N-life 对不同发育时期棉花叶片MDA 含量、NR 活性的影响Fig.2 Effects of N-life on MDA content and NR activity of cotton leaves at different developmental stages
2.1.5NR 活性。 2021 年, 苗期施用N-life 处理(T0、T1 和T2) 的棉花叶片NR 活性与各自对照相比无显著差异,花铃期施用N-life 处理的棉花叶片NR 活性分别较各自对照显著提高34.6%、14.5%和25.7%,吐絮期分别提高19.8%、4.9%和22.5%。 2022 年的结果与2021 年基本一致(图2)。 因此,N-life 对苗期棉花叶片的NR 活性无显著影响, 但可以显著提高花铃期与吐絮期的NR活性。
2.1.6光合作用效率。 与对照相比, 施用N-life可以提升苗期、花铃期和吐絮期棉花叶片的净光合速率(Pn),吐絮期尤为明显,但差异均未达到显著水平(表4)。其中2021 年吐絮期施用N-life 处理(T0、T1、T2)的Pn分别较各自对照(CK0、CK1、CK2)提升6.62%、1.22%和7.08%,2022 年T0、T1、T2 和T3 处理分别较其对照提升6.70%、9.01%、5.92%和8.83%。 此外,施用N-life 可导致苗期、花铃期和吐絮期棉花叶片胞间CO2浓度(Ci)降低,花铃期和吐絮期叶片蒸腾速率(Tr)增加、气孔导度(Gs)提升(2021 年花铃期T2 处理除外)(表4)。
2.2 N-life 对棉花氮肥利用率的影响
盆栽试验结果(表5)表明, 2021 年播种前CKC 与TNC 处理的土壤含氮量以及CK 与TN处理的土壤氮含量均无显著差异;棉花成熟收获后,TNC 和TN 处理的植株含氮量、 盆中土壤的氮含量以及氮肥利用率均显著高于其对照(CKC和CK),TNC 和TN 处理的氮素损失量显著低于其对照(CKC 和CK)。 2022 年的结果与2021 年的趋势基本一致。 可见,施用N-life 可以促进棉株对氮素的吸收,降低氮素损失,显著提高氮肥利用率。

表5 N-life 对棉花氮肥利用率的影响Table 5 Effects of N-life on the nitrogen use efficiency of cotton
2.3 N-life 对棉花农艺性状与产量性状的影响
在2021 年田间试验中, 与对照相比, 施用N-life 可以显著提高棉花单株总铃数和青铃数,降低烂铃数(T0 处理除外),单株总铃数和青铃数的增幅分别为14.4%~19.6%和21.6%~40.7%,但对棉花株高(T0 处理除外)、单株果枝数(T1 处理除外)、单株吐絮铃数、铃重和衣分的影响不显著(表6~7)。
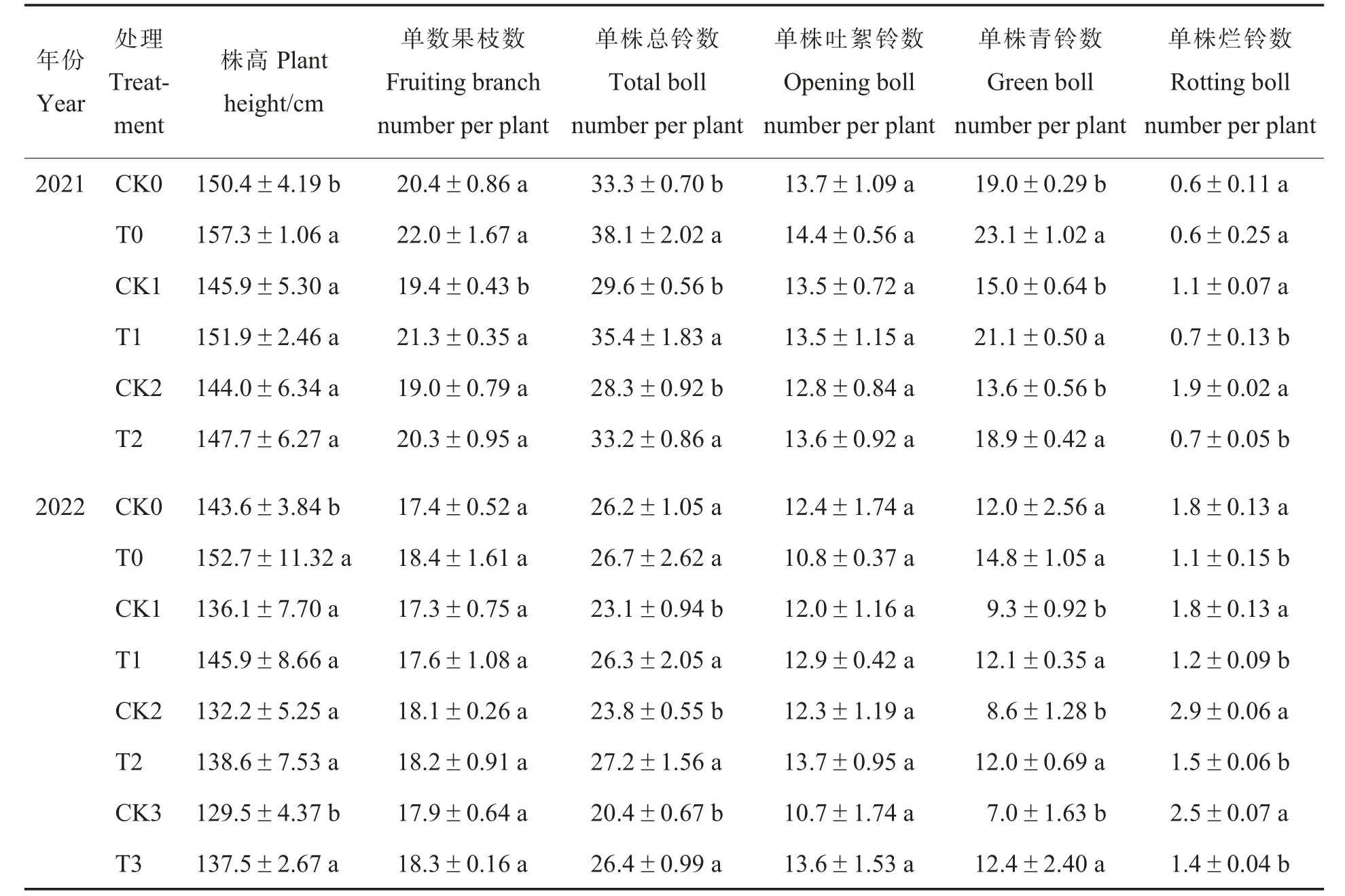
表6 N-life 对棉花农艺性状的影响Table 6 Effects of N-life on cotton agronomic traits
2022 年, 与对照相比,T0 和T3 处理的株高显著增加,减氮处理下施用N-life(T1、T2、T3 处理)可显著增加单株总铃数和单株青铃数,显著降低单株烂铃数,对单株果枝数、单株吐絮铃数、铃重和衣分均无显著影响(表6~7)。这可能是由于施用N-life 起到了肥料缓释的作用,提升了棉株对氮肥的利用率,延缓棉株衰老,进而使单株总铃数增加, 但在一定程度上也导致棉花贪青晚熟。
不同处理对棉花产量的影响见表7。 同一氮肥水平下施用N-life 可以提高籽棉产量和皮棉产量。 2021 年施用N-life 处理(T0、T1、T2)的籽棉产量和皮棉产量分别较其对照(CK0、CK1、CK2)增加12.80%~30.63%和11.33%~34.25%,差异均达显著水平。 2022 年施用N-life 处理(T0、T1、T2、T3)的籽棉产量和皮棉产量分别较其对照增加0.08%~5.96%和0.31%~6.57%。
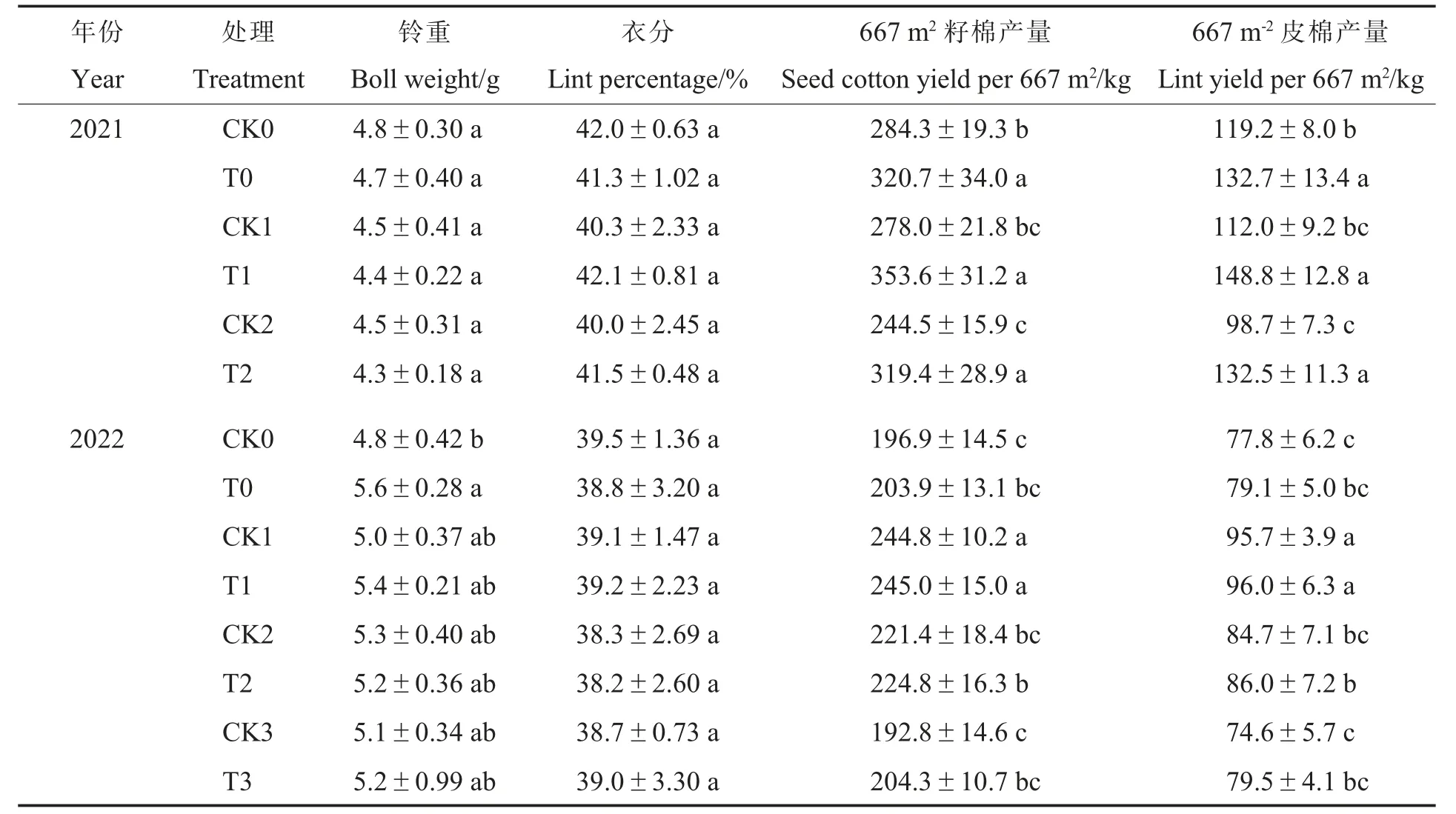
表7 N-life 对棉花产量性状的影响Table 7 Effects of N-life on cotton yield traits
随着氮肥施用量减少,2021 年不施用N-life处理的籽棉产量和皮棉产量逐渐降低,2021 年施用N-life 处理的籽棉产量和皮棉产量及2022年各类处理的籽棉产量和皮棉产量均呈现先升高后下降趋势。 2021 年施用N-life 的3 个处理(T0、T1 和T2)的籽棉产量和皮棉产量无显著差异;2022 年施用N-life 的4 个处理(T0、T1、T2和T3)中,T1 处理的籽棉产量和皮棉产量显著高于其余3 个处理,T2 的籽棉产量和皮棉产量均高于T0 处理,但差异不显著。 综上,施用N-life可以提高棉花产量,其中减氮10%处理的籽棉产量和皮棉产量最高,减氮20%也能获得较高的产量水平,但增产效果受年度之间环境因素的影响。
2.4 N-life 对棉花纤维品质的影响
与对照相比,施用N-life 会在一定程度上导致棉花纤维上半部平均长度(2021 年T2 处理除外)和断裂比强度增加(2022 年T1 处理除外),长度整齐度指数(2021 年T0 处理除外)和马克隆值(2022 年T2 处理除外)降低。 施用N-life 对棉纤维断裂伸长率无显著影响。 综上所述,施用N-life 能在一定程度上提高棉花的纤维上半部平均长度、断裂比强度,改善马克隆值分档,对断裂伸长率无显著影响, 长度整齐度指数有所降低,但总体影响不大(表8)。
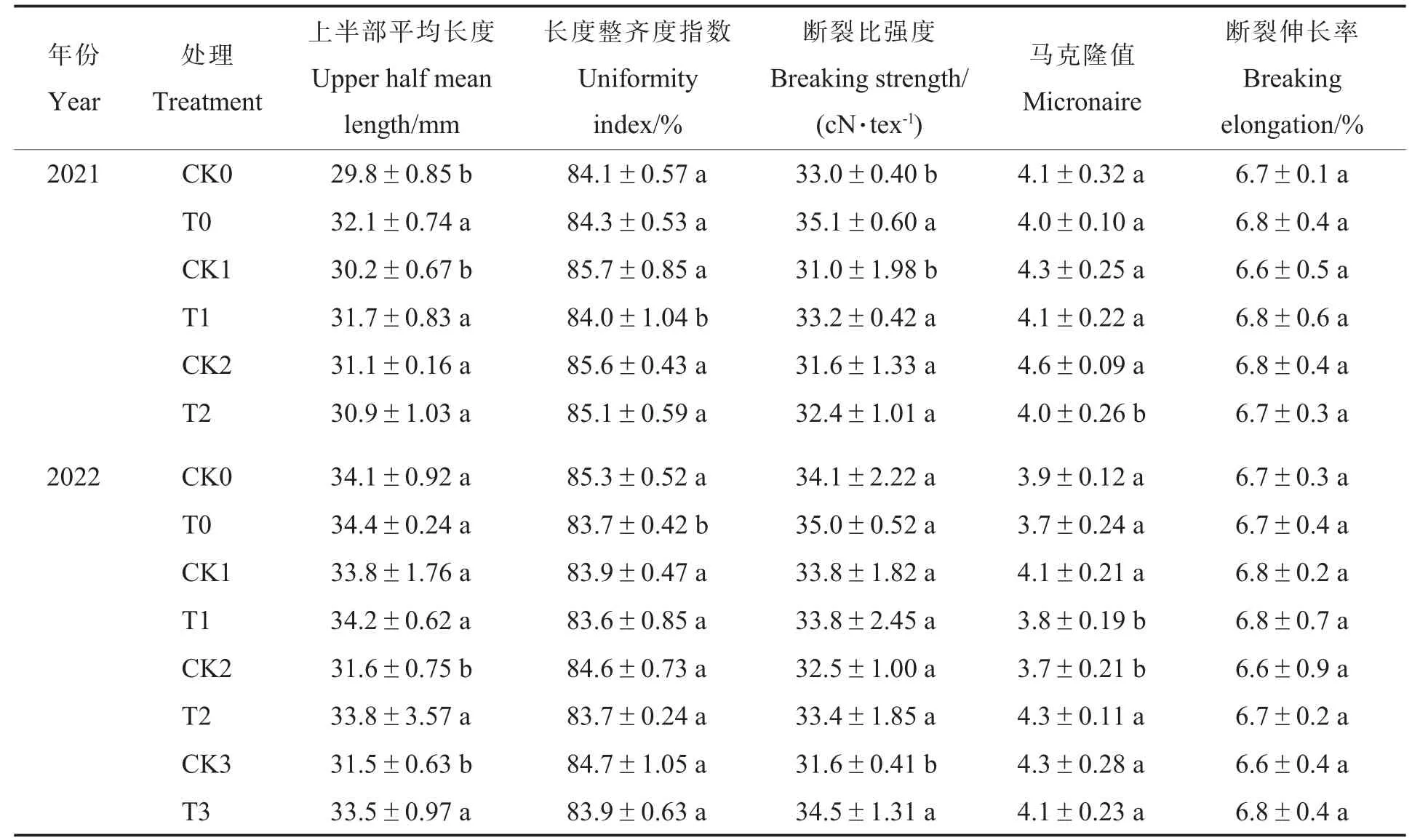
表8 N-life 对棉花纤维品质指标的影响Table 8 Effects of N-life on cotton fiber quality index
3 讨论
氮素供应与棉花生长发育关系密切。 众多研究表明,氮素影响叶面积指数(leaf area index,LAI)、叶片叶绿素含量、MDA 含量、谷氨酰胺合成酶(glutamine synthetase, GS)活性和叶片光合性能[22-24]。李鹏程等[25]在黄河流域棉区对棉花进行3 年的施氮试验发现,随着施氮量的增加,不同生育时期棉花叶片LAI、叶绿素含量、GS 活性均呈现上升趋势,而MDA 含量呈下降趋势,这说明适当增施氮肥能够维持棉花氮代谢水平,减少叶片过氧化物产生,延缓功能叶片衰老。 适宜的氮肥用量有利于游离氨基酸、可溶性蛋白等氮代谢产物的积累[26],提高POD 活性[27],也有利于形成理想的群体冠层结构[28]。本试验中,花铃期和吐絮期氮肥施用量越少,棉花叶片抗氧化酶(SOD、POD、CAT)活性下降越明显,施用N-life 可以显著提高花铃期和吐絮期棉花叶片的抗氧化酶活性,显著降低MDA 含量,对光合性能也有所提升。这表明施用N-life 后土壤供氮平衡,棉花植株生长稳健,抗逆境胁迫的能力可能得到提高。
植物体内NR 是氮代谢的关键限速酶,其活性与植物对氮素的吸收利用密切相关[29],并被认为是预测作物产量的指标之一[30]。在本试验中,与对照相比,施用N-life 对苗期棉花叶片NR 活性无显著影响,花铃期和吐絮期增施N-life 的棉花叶片NR 活性高于对照。 说明增施N-life 的棉株在生长发育中后期仍能保持较高的氮代谢效率。刘涛等[31]探究了氯啶对滴灌棉花生物量和氮素吸收量的影响,发现氯啶处理的棉花地上部分总生物量较单施尿素处理提高4.1%~5.1%,总含氮量提高4.3%~4.4%,与本试验中的盆栽结果基本一致。 在盆栽试验中,与对照相比,施用N-life使试验结束时土壤总氮含量维持在较高水平,氮素损失显著减少且植株含氮量和氮肥利用率显著增加。 这可能是由于N-life 缓慢释放氯啶,土壤硝化作用被抑制[32],硝化作用导致的氮素损失也因此降低。 上述结果表明,施用N-life 后植物氮代谢能力和土壤氮素供应能力均有所提升。
减少氮肥施用对棉花的生育期影响不大,但会对叶片和果实的数量产生不利影响。 随着生育进程的推进,养分分配从营养器官向生殖器官转移[33],若氮素施用不当会造成作物减产。 Dawar等[34]发现氯啶和尿素配施可以使玉米的生物量、籽粒产量和总氮吸收量分别提升23%、17%和15%,有较好的增产效果。 本研究中,连续2 年的田间试验结果表明,增施N-life 能在不同减氮水平下(减氮10%、20%和30%)增加棉花的单株青铃数和总铃数,减少烂铃数;与同一施氮水平下的对照处理相比,施用N-life 可以提升籽棉产量和皮棉产量。 这表明施用N-life 后氮素分配情况得到改善,棉花生殖生长增强,进而产量增加。 同时,施用N-life 可以提高棉花的纤维上半部平均长度和断裂比强度,改善马克隆值分级,但长度整齐度指数有所下降,这可能与N-life 改善棉花营养状况而导致成熟期延长有关。 但N-life 对纤维品质总体无明显不利影响。
4 结论
施用N-life 可以有效抑制土壤硝化作用,减少土壤氮素损失,提高棉株含氮量及其对氮素的利用率,为棉花生长发育中后期提供更加充足的氮素供给。 施用N-life 显著提升花铃期和吐絮期棉花叶片的抗氧化酶(SOD、POD 和CAT)活性和NR 活性,降低MDA 含量,提高净光合速率,促进棉花生长发育, 提高籽棉产量和皮棉产量,对纤维品质无明显不利影响。 施用N-life 可以减少棉田氮肥使用量(10%~20%),实现减氮增产。
