硫氢化钠增加高糖高脂条件下小鼠心房肌细胞系HL-1谷胱甘肽合成
2024-01-13张伟才刘肆仁王尚农
张伟才,刘肆仁,王尚农
北京市第六医院 1.心内科;2.内分泌科,北京 100007
糖尿病心肌病(Diabetic cardiomyopathy,DCM)是糖尿病主要的并发症之一,由于高糖高脂持续刺激,心肌细胞发生糖脂代谢紊乱,氧化应激、炎性反应、凋亡等病理改变,导致心功能障碍,最终发展为心力衰竭[1-2]。活性氧自由基(reactive oxygen species,ROS)产生过多是DCM发生的主要机制,ROS导致脂质过氧化引起心肌细胞损伤[3]。谷胱甘肽是细胞合成的最重要的非酶抗氧化剂,直接清除ROS。然而,DCM中谷胱甘肽含量减少,机制不清[4]。
硫化氢 (hydrogen sulfide, H2S)是内源性气体分子,心血管系统中主要由胱硫醚γ裂解酶(cystathionine-γ-lyase, CSE)产生[5-6]。在糖尿病心肌病中,H2S可以显著降低心肌细胞内ROS水平,保护心肌功能,其具制尚不清楚[7]。硫化氢是脂溶性气体穿透细胞膜进入胞浆,溶于水产生硫氢根离子在体内发挥生理学作用。硫氢化钠(NaHS)进入体内也解离成硫氢根离子,因此,人们常选择NaHS作为硫化氢供体。本研究探讨硫氢化钠能否促进谷胱甘肽合成相关蛋白,改善心肌细胞氧化应激状态。
1 材料与方法
1.1 材料
1.1.1 胎牛血清(Gibco公司),棕榈酸(palmitic acid, Pal) 、N-乙酰-L-半胱氨酸(N-acetyl-l-cysteine,NAC)、硫氢化钠(sodium hydrosulfide, NaHS) 和DL-炔丙基甘氨酸(DL-propargylglycin,PPG)(Sigma-Aldrich公司)Anti-CSE、Anti-CBS(胱硫醚-β合成酶,cystathionine-β-synthase)、anti-SLC7A11(溶质载体家族7成员11,solute carrier family 7 members 11),anti-GCLC(谷氨酸半胱氨酸连接酶C 亚基,glutamate cysteine ligase C),anti-GCLM(谷氨酸半胱氨酸连接酶M亚基),anti-GSS(谷胱甘肽合成酶,glutathione synthetase)(Proteintech公司,武汉,中国)。CCK-8细胞活力 (上海尚宝生物科技公司,上海,中国)和谷胱甘肽(glutathione,GSH)含量试剂盒(武汉博士德公司)。
1.1.2 小鼠心房肌细胞系HL-1[中国科学院(上海)细胞库]。
1.2 方法
1.2.1 细胞的分组与处理: 将HL-1细胞接种于含有DMEM培养液(加入10%胎牛血清和1%青霉素-链霉素混合双抗)的细胞培养瓶中,将细胞培养瓶放入37 ℃、5% CO2的细胞培养箱中孵育,待细胞增殖至90%汇合时进行给药处理。
将HL-1细胞随机分组:1)正常对照组(control):10%胎牛血清DMEM:含25 mmol/L葡萄糖;2)高糖高脂组(HG+Pal):高浓度葡萄糖(HG):40 mmol/L;棕榈酸(Pal):500 μmol/L;3)NaHS干预:NaHS,100 μmol/L;4)GYY4137干预:GYY4137是H2S缓释释放剂,10 μmol/L;5)PPG干预:PPG是CSE抑制剂,1 mmol/L;6)NAC (N-acetyl-l-cysteine)干预:NAC是ROS抑制剂,5 mmol/L。HL-1细胞经加药培养72 h后进行相关实验。
1.2.2 CCK-8法检测细胞活力:将HL-1细胞置于96孔板培养24 h后,用含血清的DMEM配制Pal浓度(μmol/L)为0、200、500、1 000和2 000的培养液培养HL-1细胞,并检测24、48和72 h后细胞的存活率变化。按试剂盒说明书操作,使用酶标仪在490 nm处检测吸光度。
1.2.3 Western blot检测蛋白质: 取1×106HL-1细胞,加入含1%PMSF(蛋白酶抑制剂)的RIPA组织高效裂解液,低温离心15 min,吸取上清液加入loading buffer,将蛋白样放入金属浴进行蛋白质变性,随后将蛋白质冻存。制备凝胶,上样,90~130 V电泳,低温转膜1.5 h,用脱脂奶粉封闭2 h,加入抗体冷藏孵育过夜,洗膜3次,室温孵育二抗1 h,采用多功能成像系统Fusion Fx5 spectra采集图像进行蛋白质吸光度分析,将目的蛋白条带吸光度值与内参蛋白质条带吸光度值的比值作为蛋白质表达相对水平。
1.2.4 H2S探针检测H2S的含量: 使用7-氨基-4-甲基香豆素(7-azido-4-methylcoumarin,C-7Az)荧光探针检测HL1细胞中H2S含量。不同药物处理后的HL1细胞,使用PBS清洗2次,加入C-7Az探针(50 μmol/L,PBS稀释),37 ℃避光30 min,PBS清洗2次,在荧光显微镜下观察H2S含量。
1.2.5 ROS 水平的检测:将HL-1细胞接种于24孔板中,加药处理48 h后用 PBS 清洗3次。ROS 检测试剂(μmol/L):DHE 和DCFH 用不含血清的 DMEM 配制。室温下避光孵育30 min后使用 PBS 清洗3次,每次5 min。使用 Hoechst 对细胞核染色5~10 min。PBS 冲洗孔板中残余染料3次,每次5 min。荧光显微镜进行检测分析。
1.2.6 谷胱甘肽含量的检测:将HL-1细胞种于细胞培养皿培养24 h后,加药处理72 h。按试剂盒说明书操作,使用酶标仪在412 nm处检测吸光度。
1.2.7 免疫共沉淀检测:提取HL-1细胞蛋白质后,使用 BCA 试剂盒进行蛋白质定量,根据定量结果将样品稀释至2 μg/μL,根据80 μg上样量决定实验所需样品体积。按照每1 mL样品加入20 μL IgG琼脂糖磁珠的比例加入磁珠,4 ℃摇床振荡混匀30 min,使用磁力架去掉磁珠,将上清液转移到新的 EP 管中,按照每1 mL样品加入50 μL磁珠的比例再次加入磁珠,同时按照每1 mL样品加入5 μL一抗的比例加入抗体,4 ℃ 摇床振荡混匀过夜。隔天使用磁力架将上清液弃掉,加入含有PMSF的裂解液重悬磁珠,清洗3次。最后按照3∶1的比例加入裂解液和蛋白质上样缓冲液,100 ℃煮样10 min。得到的蛋白样品用 Western blot 检测蛋白质之间的相互作用。
1.3 统计学分析
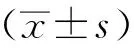
2 结果
2.1 棕榈酸对HL-1细胞活力的影响
500 μmol/L Pal培养72 h的HL-1小鼠心房肌细胞细胞生存率在50%,确定此浓度为最终浓度,作为2型糖尿病心肌细胞模型(图1)。
Pal.palmitic acid; *P<0.05,**P<0.01,***P<0.001 compared with control group.图1 棕榈酸影响HL-1细胞的增殖Fig 1 Palmitic acid effected on HL-1 proliferation at 24,48 and 72
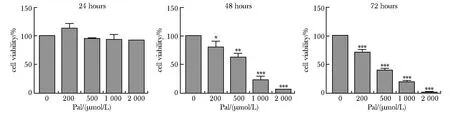
2.2 高糖高脂下HL-1心房肌细胞CSE表达水平
高糖高脂下CSE的表达和H2S含量明显减少,NaHS干预后能够恢复CSE的表达和H2S含量(图2A和B)。
A.expression of CSE was detected by Western blot; B.content of H2S was test by fluorescence probe,C-7Az; *P<0.05 compared with control group;#P<0.05 compared with HG+Pal group.图2 CSE蛋白表达及H2S含量测定Fig 2 Expression of CSE and H2S content were analyzed(n=3)
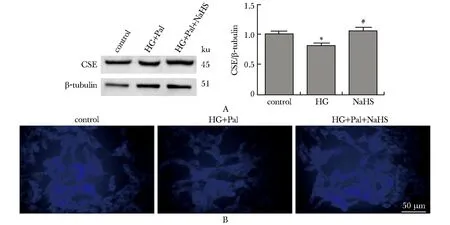
2.3 外源性H2S减少高糖高脂下HL-1心肌细胞ROS生成
与对照组相比,高糖高脂及PPG(CSE抑制剂)干预组ROS生成明显增加,而NaHS和GYY4137(H2S缓释释放剂)干预后能减少ROS生成(图3A和B)。
A,B.representative images of the fluorescence assay of ROS in HL-1cells using the fluorescent probe DCFH (green)and DHE (red);scale bar=50 μm.图3 高糖高脂条件下细胞内ROS水平的变化Fig 3 Contents of ROS in HL-1 cells with the treatment of HG and Pal
2.4 外源性H2S对HL-1谷胱甘肽生成的影响
与对照组比高糖高脂处理72 h,HL-1细胞谷氨酸半胱氨酸连接酶催化亚基C(glutamate-cysteine ligase catalytic subunit,GCLC)、谷氨酸半胱氨酸连接酶修饰亚基M(glutamate-cysteine ligase modifier subunit,GCLM)、谷胱甘肽合成酶(glutathione syn-thetase,GSS)蛋白的表达均明显下降,NaHS和GYY4137干预后以上蛋白水平增加,加入PPG后明显抑制相关蛋白表达的增加(P<0.01)(图4)。
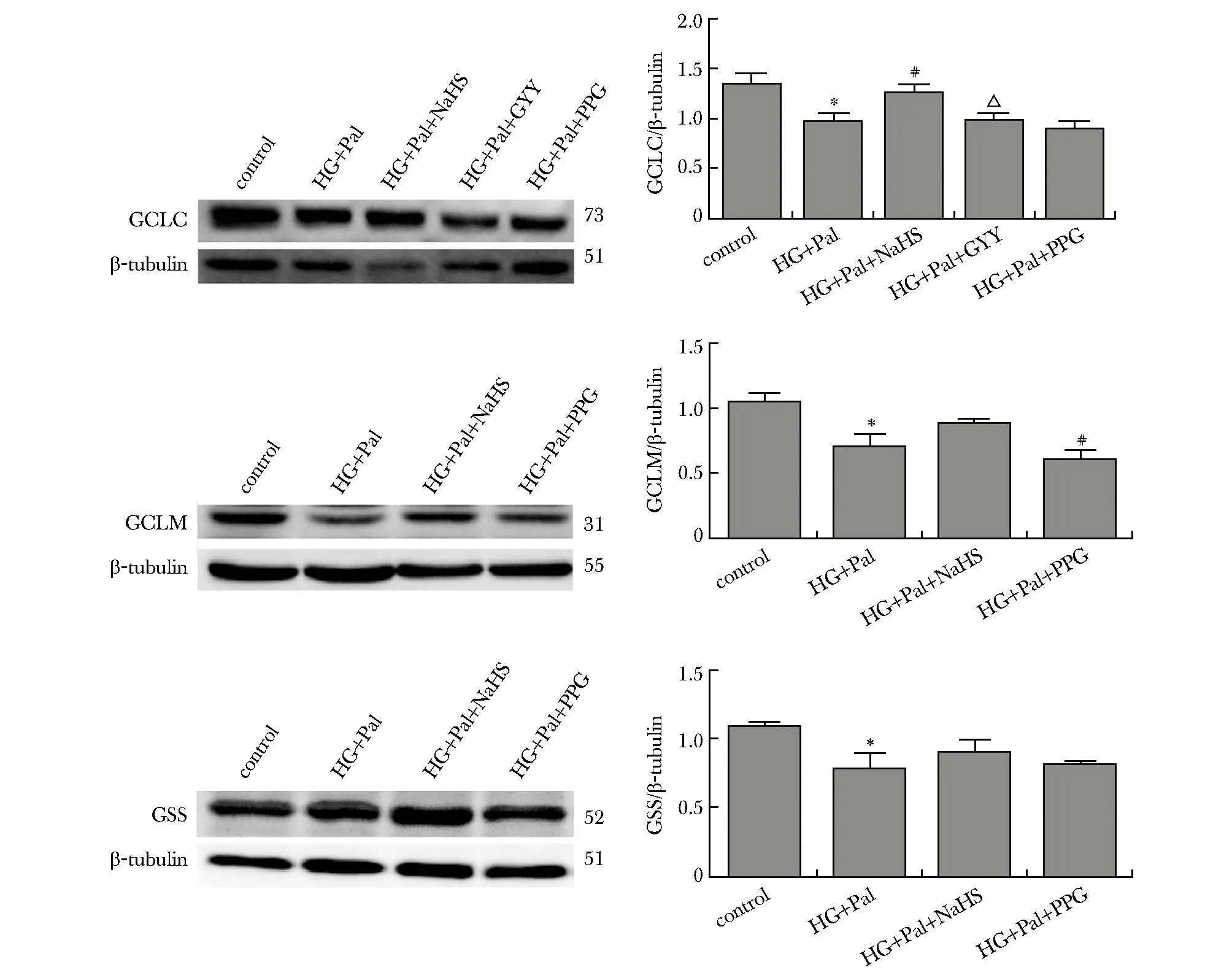
Pal.palmitic acid; PPG:DL-propargylglycin; HG:high glucose;*P<0.05 compared with control group;#P<0.05 compared with HG+Pal group; △P<0.05 compared with HG+Pal+NaHS group.图4 Western blot检测GCLC、GCLM和GSS的表达变化Fig 4 The expression of GCLC,GCLM and GSS was analyzed by Western
2.5 外源性H2S对高糖高脂下HL-1细胞谷胱甘肽含量的影响
与对照组比高糖高脂处理组心肌细胞中总谷胱甘肽和还原型谷胱甘肽含量减少,而氧化型谷胱甘肽含量增加;NaHS和NAC干预后,总谷胱甘肽和还原型谷胱甘肽含量增加;PPG处理后,总谷胱甘肽和还原型谷胱甘肽含量减少(P<0.01)(图5)。
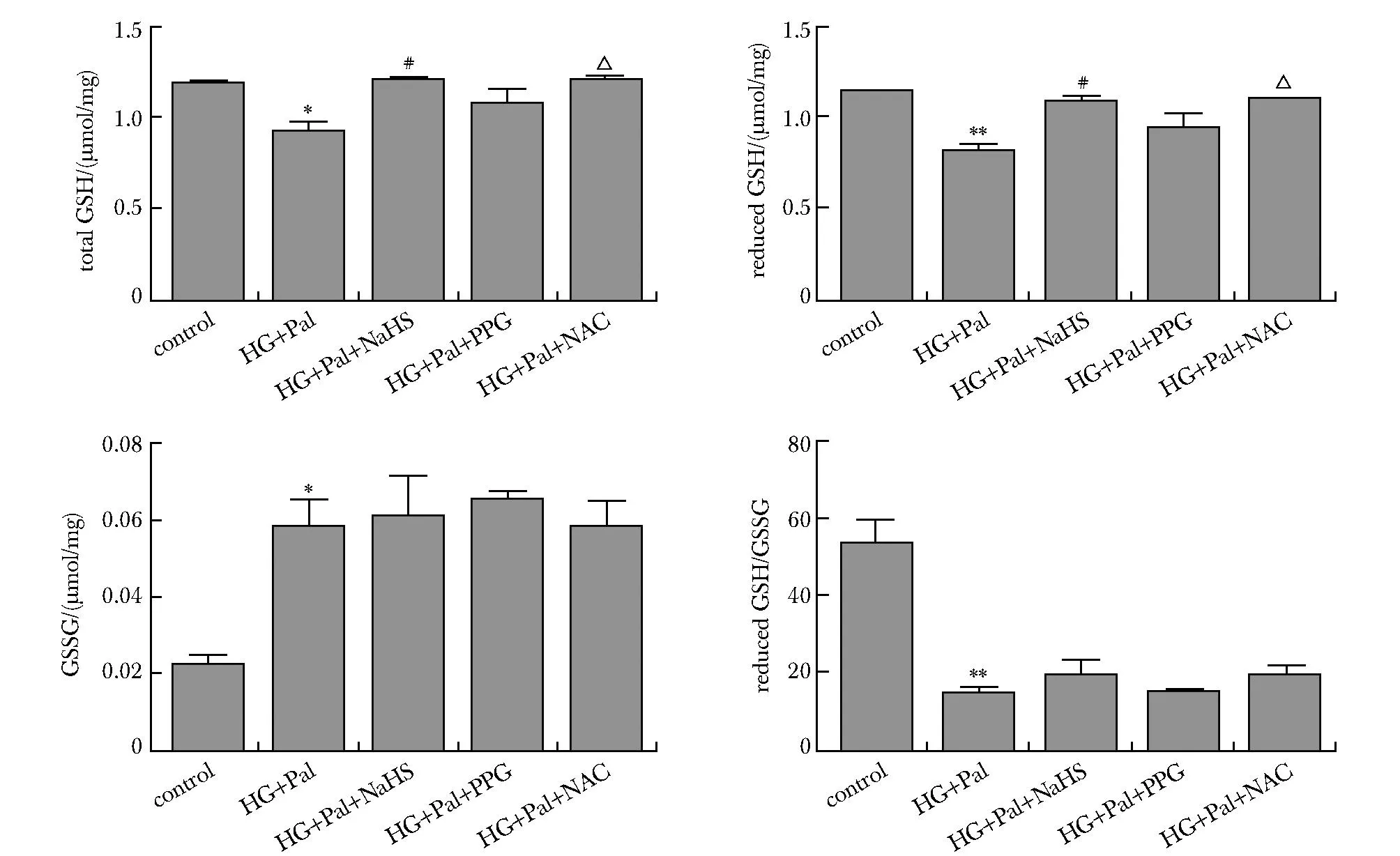
*P<0.01, **P<0.001 compared with control group;#P<0.05 compared with HG+Pal group; △P<0.01 compared with HG+Pal+NaHS group.图5 外源性H2S影响高糖高脂条件下GSH的含量变化Fig 5 Exogenous H2S modulating GSH contents in HL-1
2.6 外源性H2S调控心肌细胞Nrf2与Murf1的相互作用
Nrf 2在高糖高脂组的表达明显降低,给予NaHS,其蛋白水平增加。与对照组和NaHS干预组比,高糖高脂条件下Murf1表达增加。高糖高脂和蛋白酶体抑制剂MG132处理心肌细胞后,Nrf2的泛素水平明显增加,给予NaHS后,Nrf2的泛素水平明显降低;高糖高脂条件下Nrf2 蛋白水平下降,与Murf1 增加Nrf2泛素水平,促进其降解密切相关(P<0.01)(图6)。
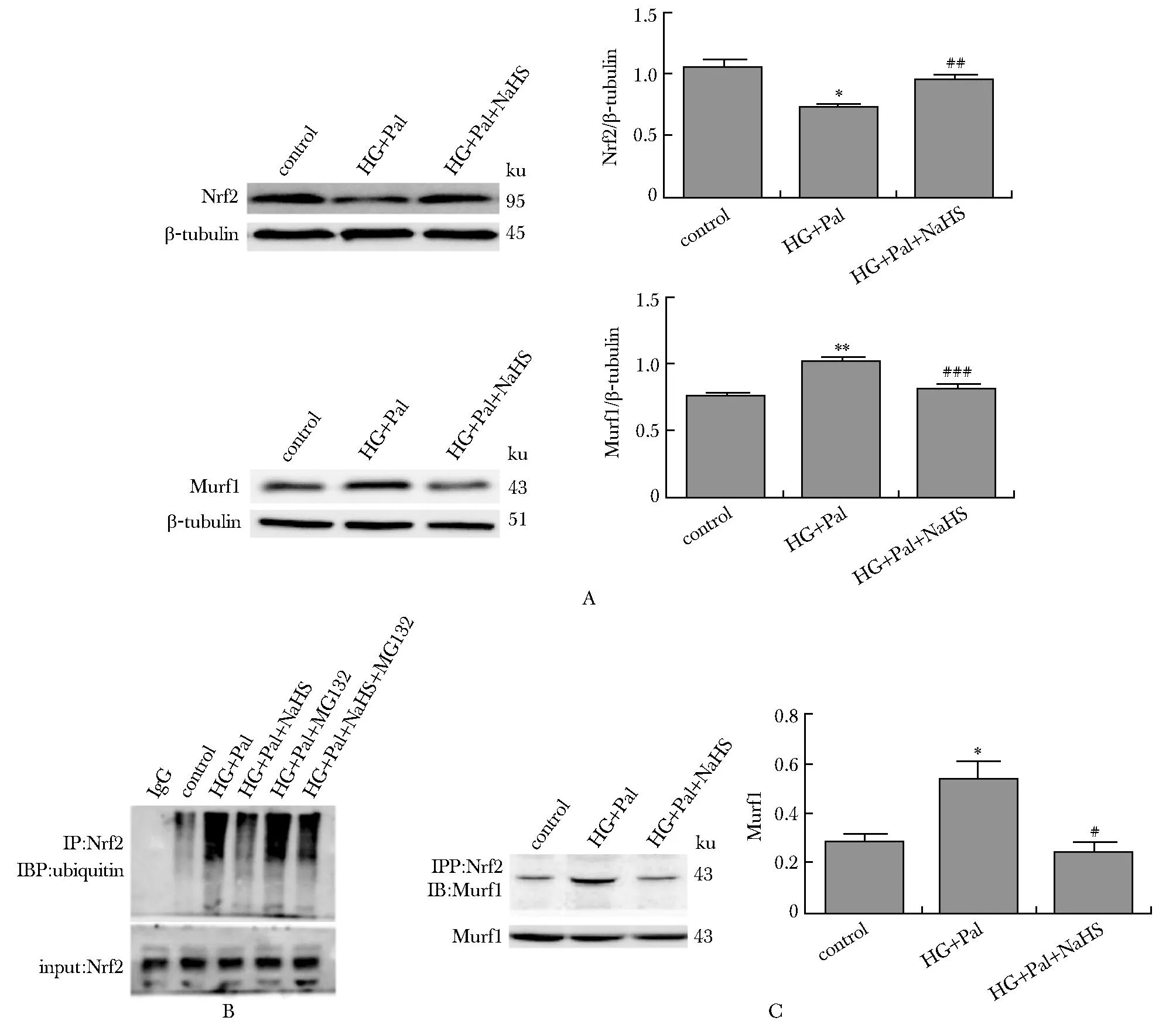
A.Western blot analysis of the expression of Nrf2 and Murf1; B.the ubiquitylation of Nrf2 was determined by CO-IP;C.CO-IP analyzing interaction between Nrf2and Murf1; *P<0.05,**P<0.01 compared with control group;#P<0.05, ##P<0.01, ###P<0.001 compared with HG+Pal group.图6 外源性H2S影响Murf1与Nrf2的相互作用及Nrf2的泛素化水平Fig 6 Exogenous H2S effects on the ubiquitylation of
3 讨论
1972年,Rubler在糖尿病患者中发现在没有冠状动脉疾病、高血压和心瓣膜病等危险因素下发生的心脏功能下降,将这种心肌病命名为糖尿病心肌病。超过三分之一的糖尿病患者伴有心肌功能障碍,糖尿病心肌病显著增加了患者心衰的发病率[8]。糖尿病心肌病是由高血糖、高血脂诱导心肌细胞代谢紊乱,其发生与胰岛素代谢信号通路受损、氧化应激、炎性反应的改变,促进结缔组织交联、心肌纤维化增加和心脏重构[11]。糖尿病患者体内H2S的水平下降加重细胞损伤和ROS积累, 激活炎性反应、促进凋亡,最终加重糖尿病心肌病。外源性补充H2S能降低氧化应激水平,减少心肌细胞凋亡[12],本实验也验证了外源性H2S减少高糖高脂条件下心肌细胞内氧化应激水平。
谷胱甘肽是细胞合成的最重要的低分子量非酶抗氧化剂,含量丰富,是抗氧化防御系统中的重要组成部分。其功能是维持细胞内的氧化还原稳态,以含硫醇的还原形式(GSH)存在,直接清除体内过量产生的活性氧,并转变为氧化形式谷胱甘肽二硫醚(glutathione disulfide,GSSG),后者在谷胱甘肽还原酶的催化下以NADPH作为底物还原成谷胱甘肽[13]。本研究发现,硫氢化钠明显提高以上蛋白水平,从而提高还原性谷胱甘肽的含量。
核因子红细胞系2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是碱性亮氨酸拉链蛋白家族的成员,有7个功能域(Neh1~7)参与其稳定性或转录活性的调控。kelch样ECH相关蛋白1(kelch-like ECH-associated protein 1,Keap1)是Nrf2在细胞质中的结合蛋白。正常条件下,Keap1二聚体与Nrf2-Neh2结构域结合,通过Cul3-Rbx1依赖性E3泛素连接酶活性使Nrf2泛素化而被迅速降解[14]。E3 连接酶肌肉特异性环指蛋白-1(muscle-specific RING finger protein 1, Murf1),是环指结构域E3连接酶家族的一员,包含一个环指结构域 (RING finger domain),其在骨骼肌萎缩中发挥重要作用,此外也参与多种蛋白降解[15]。本研究证实在高糖高脂条件下Murf1与Nrf2存在相互作用,增加Nrf2泛素化;给予外源性H2S后,减少Nrf2泛素化。
本研究揭示NaHS减少糖尿病心肌细胞中Murf1的蛋白水平,降低 Nrf2的泛素化,促进GSH合成,减轻高糖高脂条件下ROS的堆积。
