六偏磷酸钠对氧化铈悬浮性能的影响及其机理
2024-01-12杨明君李艳平吴文远
杨明君, 边 雪, 李艳平, 吴文远
(1.东北大学 冶金学院, 沈阳 110819; 2.锦州钒业有限责任公司, 辽宁 锦州 121005)
化学机械抛光(CMP)是目前公认最佳的全局平坦化工艺技术,该技术在机械研磨抛光过程中加进化学反应,有效提高了抛光的精度和速度[1-2].而CMP 技术中抛光液极其关键,不仅能决定抛光的效率和质量,其成本还占CMP 工艺成本的40%.目前,全球抛光液消费量超过20 万t,常见的抛光液有氧化硅抛光液、氧化铝抛光液和稀土化合物抛光液等[3-4],其中稀土抛光液约占据50%的份额[5].而纳米CeO2抛光液因具有硬度软、效率高、光洁度好等特点,被广泛用于CMP 工艺中[6].Wakamatsu 等[7]研究发现,采用纳米CeO2对玻璃表面抛光时,研磨效率可以提高1 倍以上.陈广林等[8]将制备出的CeO2纳米粒子抛光液用于石英玻璃抛光中,发现其可以使石英玻璃表面无划痕,且表面粗糙度达到10 nm 左右.陈爱莲等[9]利用SiO2和CeO2制备出具有核/壳结构的复合纳米颗粒,并将其应用于CMP 领域中.但是纳米CeO2比表面积大且比表面能高,故容易出现团聚现象.Guo,Chen,Ruan 和Zeng 等[10-13]研究发现:当悬浮液pH 值、分散剂的选择及添加量控制不当时,颗粒团聚会导致实际参与抛光的粒子数减少,抛光效率和质量降低,抛光液使用寿命变短,还可能引起颗粒粒度分布不均匀,进而造成划痕等问题.因此,进一步探究纳米CeO2抛光液悬浮性能的影响因素及机理,改善其悬浮性能是目前亟待解决的问题[14-15].
影响抛光液中颗粒分散稳定性的主要因素有分散剂的种类、添加量和悬浮液pH 值[16-18].六偏磷酸钠(SHMP)作为CeO2抛光液中最常用的分散剂,关于它在抛光液中与CeO2颗粒的作用机理和分散规律的研究较少,这使得SHMP 的用量多为经验性添加.抛光液中CeO2颗粒悬浮性能的随机性很强,极易造成抛光性能的不稳定,这会严重影响到被抛光产品的质量.因此,本文中以悬浮液中CeO2沉降速率、粒度分布、粗端粒度大小等参数作为考察指标,研究分散剂SHMP 添加量(质量分数,下同)和悬浮液pH 值对纳米CeO2颗粒悬浮性能的影响规律,采用DLVO 理论分析和Zeta 电位、电导率、黏度、XPS、FT-IR 等测试,探究SHMP 与纳米CeO2抛光液的作用机理,以期为SHMP 在CeO2抛光液中的应用提供实验依据.
1 实 验
1.1 实验原料
实验所用CeO2为络合沉淀法制备的纳米晶粒CeO2粉体[19];分析纯SHMP(山东优索化工科技有限公司)为分散剂;NaOH(国药集团化学试剂有限公司)用于调节悬浮液的pH 值;溴化钾(国药集团化学试剂有限公司)用于傅里叶变换红外光谱(FTIR)测试.
1.2 悬浮液的制备
质量分数23%的CeO2悬浮液的制备过程如下:先称取15 g CeO2粉体,分别加入质量分数为0.5%,1%,3%,5%,8%的SHMP,再与50 mL 去离子水混合,然后放置于球磨罐中,使用NaOH 将溶液的pH 值分别调节至3,5,7,9,11 和13.5,在球磨机中球磨10 h 后,制得所需CeO2悬浮液.该悬浮液用于粒度、黏度、Zeta 电位、电导率测试.质量分数10%的CeO2悬浮液制备过程与上述制备过程基本相同,只是称取的CeO2粉体为5.6 g.该悬浮液用于沉降速率测试.
对质量分数23%的CeO2悬浮液依次进行过滤、烘干、研磨,即可制得CeO2复合粉体,该粉体用于FT-IR 和XPS 分析.
1.3 材料的表征
实验所用球磨机为行星式球磨机(KE-0.4 L,启东市宏宏仪器设备厂),使用pH 计测定(PHS-3E,上海仪电科学仪器股份有限公司)pH 值;使用激光粒度仪(BT-9300ST,丹东百特仪器有限公司)测定悬浮液中CeO2粒度分布;使用电泳仪(JS94H,上海中晨数字技术设备有限公司)测定悬浮液中CeO2的Zeta 电位;使用电导率仪(DDS-11A,上海仪电科学仪器股份有限公司)测定悬浮液的电导率;使用黏度计(NDJ-8S,闽测仪器设备厦门有限公司)测定悬浮液黏度(在常温常压下,使用2 号转子,转速60 rad/min);使用红外光谱仪(IRAffinity-1,日本岛津)测定悬浮液中CeO2与分散剂作用的基团特征峰变化;使用X 射线光子能谱仪(thermo escalab 250Xi,美国赛默飞)测定悬浮液中CeO2与分散剂作用后各元素的含量.将质量分数为10%的CeO2悬浮液在试管中静置6 h,测量并计算清液层高度占总溶液总高度的百分比.该百分比定义为沉降率,沉降率与分散稳定性能成反比[20].
2 结果与讨论
2.1 SHMP 添加量和悬浮液pH 值对CeO2沉降率的影响
图1 示出了在质量分数为10%CeO2悬浮液中,分散剂SHMP 的添加量和悬浮液pH 值对CeO2颗粒沉降速率的影响.由图可知,当SHMP 添加量增至5%、悬浮液pH 值提高至11 时,沉降率达到最小(20%),此时分散稳定性较好.而当继续添加分散剂或提高悬浮液pH 值时,分散稳定性变差,这是因为悬浮液中的CeO2颗粒发生了二次团聚.
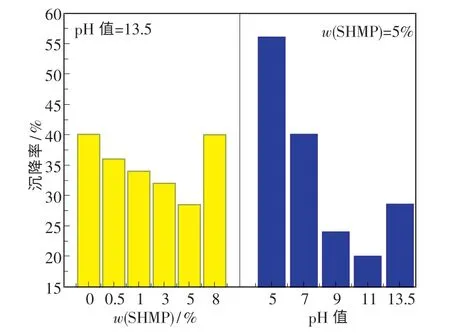
图1 SHMP 添加量和悬浮液pH 值对CeO2沉降率的影响Fig.1 Effect of addition and SHMP and pH value of suspersion on sedimentation rate of CeO2
2.2 SHMP 添加量和悬浮液pH 值对CeO2粒度分布的影响
图2 示出了不同SHMP 添加量的悬浮液中CeO2颗粒粒度分布图.由图可知:在SHMP 添加量为0.5%~5%时,小粒度颗粒积累量会随着SHMP 添加量的增大而增多,颗粒团聚现象减弱;当SHMP 添加量达到5%时,粒度小于0.2 μm 的颗粒积累量达到最高值(86.28%).此后,继续增大SHMP 的添加量,小粒度颗粒的积累量逐渐减少,这说明颗粒再次发生了团聚现象.
图3 示出了不同pH 值悬浮液中CeO2颗粒粒度的分布.由图可知:当悬浮液pH 值小于12时,随着pH 值的升高,小粒度颗粒的积累量增多;当pH 值为11 时,粒度小于0.2 μm 的颗粒积累量达到94.66%.而后继续提高pH 值,小粒度颗粒的积累量减少,这说明在高pH 值下颗粒再次发生了团聚现象.
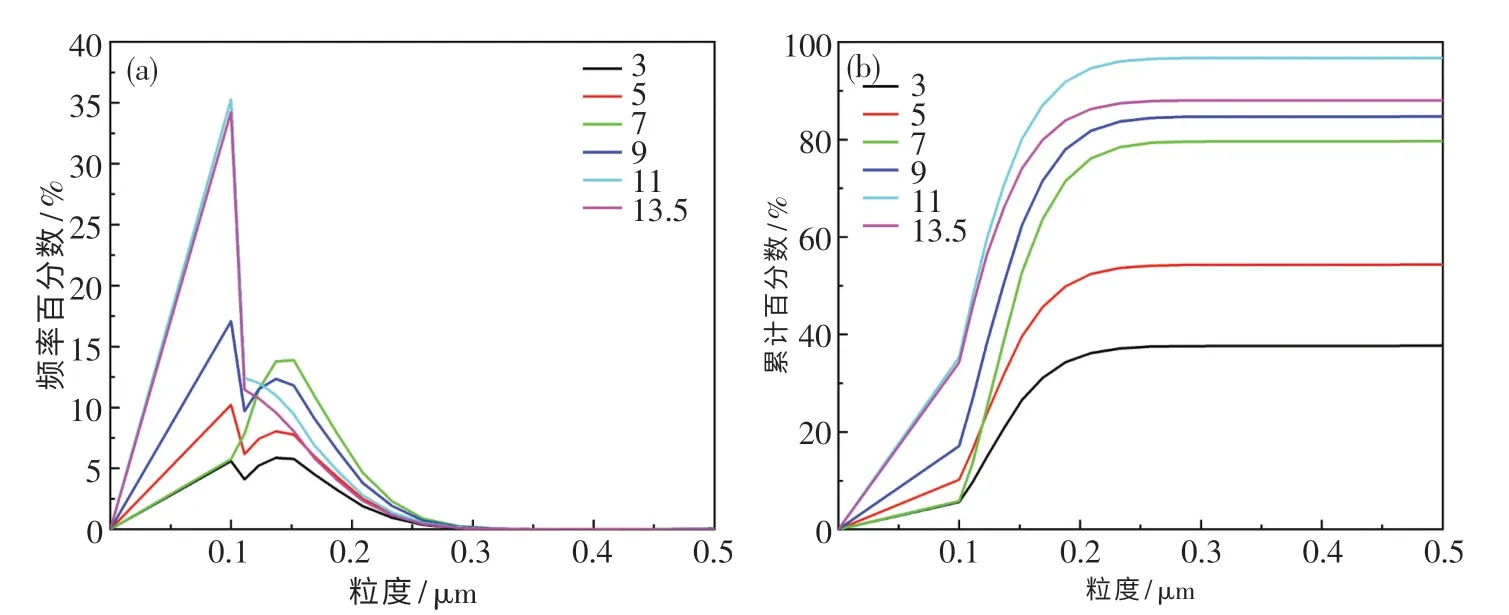
图3 不同pH 值悬浮液中CeO2 粒度分布图Fig.3 CeO2 particle size distribution images at different pH values of suspension
2.3 机理研究
2.3.1 SHMP 添加量和悬浮液pH 值对Zeta电位和电导率的影响
图4 分别示出了分散剂SHMP 的添加量和悬浮液pH 值对Zeta 电位绝对值和电导率的影响.Zeta 电位是表征分散系稳定性的重要指标,Zeta电位的绝对值越高,颗粒表现出的静电排斥力越大,体系的分散稳定性就越好[21].随着SHMP 添加量和悬浮液pH 值的增大,CeO2颗粒的Zeta 电位绝对值呈先升高后降低趋势.当SHMP 添加量达到5%、悬浮液pH 值为11 时,Zeta 电位绝对值最高为10.94 mV.这是由于SHMP 会与CeO2发生配合,且碱性条件下配合反应得到促进.而当悬浮液pH 值为11 时,大量的OH-在CeO2表面形成Ce—O基团,这不仅能增大CeO2的双电层厚度,还能使CeO2表面的Zeta 电位绝对值升高而远离等电点,对悬浮液的分散稳定性起到促进作用.但继续增大分散剂添加量和悬浮液pH 值,就会存在过多的分散剂及OH-,这将导致离子强度过大,扩散双电层中的基团被斥力挤压到吸附层中.此时,双电层变薄,体系中存在的多余颗粒又发生二次团聚现象,静电排斥力开始减弱.
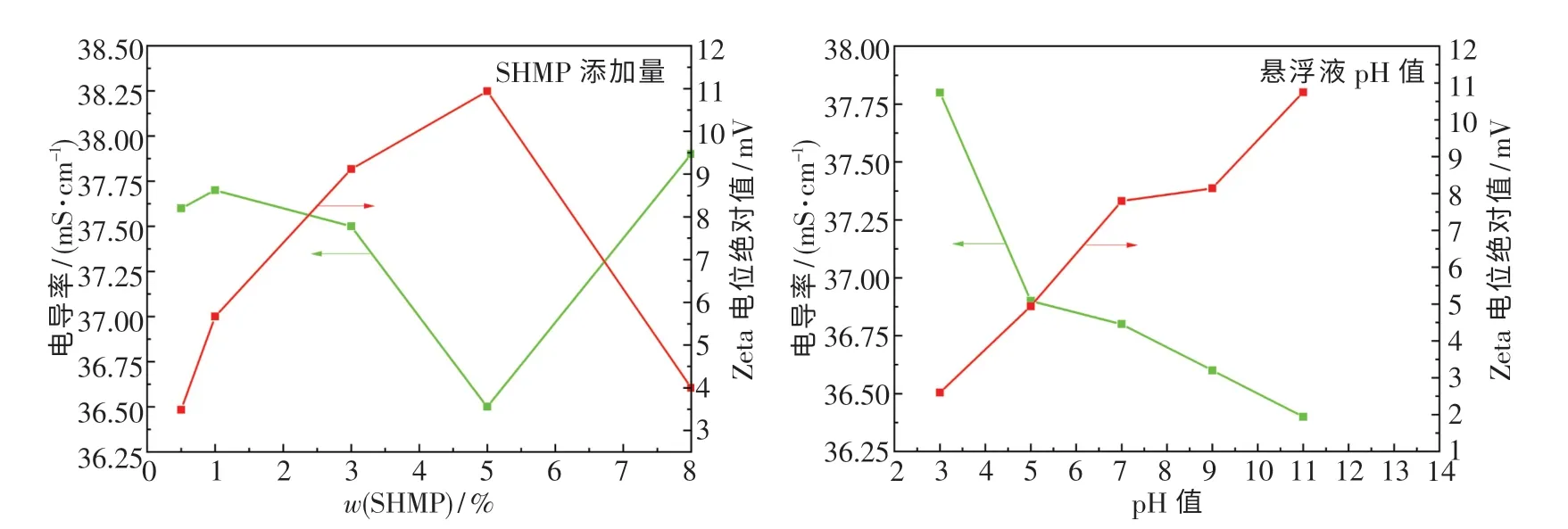
图4 SHMP 添加量和悬浮液pH 值对Zeta 电位绝对值和电导率的影响Fig.4 Effect of additions of SHMP and pH value of suspension on the absolute value of zeta potential and the conductivity of suspension
由图4 可知,当SHMP 添加量增至5%、悬浮液pH 值增至11 时,电导率的值下降至最低(36.5 mS/cm).当量电导公式如下:
式中:Λ为当量电导,S 或Ω-1;α为电离度;U+和U-为正、负离子的离子浓度,mol/L;F为法拉第常数,取94 685 C/mol.
从电离度与溶液水化离子浓度的关系可知[22-23],经SHMP 包裹的CeO2颗粒Zeta 电位绝对值会升高,分散稳定性也得到提高,故溶液中水化离子浓度增大,这对自由水合离子转变为弱电解质起促进作用,使得电离度减小和电导率下降.但SHMP 添加量大于5%、悬浮液pH 值超过11后,电导率开始升高.这是由于悬浮液中CeO2颗粒的Zeta 电位绝对值降低,发生了二次团聚现象,使水合离子浓度降低,电离度增大.
2.3.2 SHMP 添加量和悬浮液pH 值对黏度与粗端粒度大小的影响
悬浮液的流变性影响着它的稳定性,流变性可通过黏度来表征.图5 分别示出了SHMP 添加量和悬浮液pH 值对悬浮液黏度和CeO2粗端粒度大小(D90)的影响.由图可知,随着SHMP 添加量和悬浮液pH 值的增大,悬浮液黏度和D90 均先降低后升高.当SHMP 添加量达到5%、悬浮液pH 值为11 时,悬浮液黏度最低(132 mPa·s),D90 最小,为0.18 μm.可以发现,黏度越低,流变性越好,颗粒间就越不易团聚.加入一定量的分散剂或适当调节悬浮液pH 值,有利于降低悬浮液的黏度.但若分散剂加入量过多或体系pH 值过高,会导致富余的分散剂分子及基团存在于介质中,粒子之间相互交链而产生聚沉,进而使悬浮液的黏度增大[24],分散稳定性降低.

图5 SHMP 添加量和悬浮液pH 值对悬浮液黏度和D90 的影响Fig.5 Effect of additions of SHMP and pH value of suspension on suspension viscosity and D90
2.3.3 悬浮液中颗粒间作用能分析
利用DLVO 理论[25]计算颗粒间的作用能:
式中:VT为颗粒间总作用能,J;VW为颗粒间相互作用的范德华作用能,J;VE为颗粒间静电作用能,J.
范德华作用能可表示为
式中:R1,R2分别为2 种CeO2颗粒的粒径,nm;H为颗粒间分散距离,nm.
当粒子为同种颗粒时:
式中:CeO2的哈梅克常数A11取8.8×10-20J;水的哈梅克常数A33取4.15×10-20J.
颗粒间静电作用力可表示为
式中:κ为德拜常数,取0.104 nm-1;εa为相对介电常数,取6.95×10-20C-2J-1m-1;φ0为颗粒的表面电位,mV.
根据传统的DLVO 理论,粒子间同时存在着范德华引力和因双电层重叠而产生的静电斥力,且两者均与粒子间距离有关.当粒子相互靠近时,排斥力会超过吸引力,这将在总作用能-距离关系曲线上形成势垒,从而阻止粒子相互靠近与凝结,使体系趋于稳定[26].
当颗粒间作用能为负时,表明颗粒间相互吸引.当作用能由负变正时,表明颗粒间相互排斥.图6 为不同的SHMP 添加量和悬浮液pH 值下颗粒间作用能关系图.由图可知:当SHMP 添加量为3%和5%时,颗粒间作用能为正,随着粒子间距的增大,静电排斥力逐渐减弱;以悬浮液pH 值为变量,随着粒子间距的增大,颗粒间由吸引力变为排斥力再变为吸引力.当SHMP 添加量为5%、悬浮液pH 值为11 时,颗粒间作用能最大且为正值,排斥力大于吸引力,体系具有良好的分散稳定性.此外,颗粒间作用能也是颗粒表面电位的函数,表面电位越大(即Zeta 电位越大),颗粒间排斥力越大,体系就会越稳定.
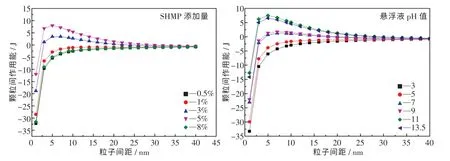
图6 不同的SHMP 添加量和悬浮液pH 值的粒子间作用能Fig.6 Interparticle interaction energy for additions of SHMP and pH value of suspension
2.3.4 SHMP 添加量和悬浮液pH 值对CeO2表面元素含量的影响
为了研究SHMP 与CeO2的作用机理,测试了不同SHMP 添加量的CeO2粉体Ce 3d XPS 谱图,结果如图7 所示.从图中可以发现,Ce 均以Ce3+和Ce4+的形式存在,其中u,u″,u‴及v,v″,v‴归属于Ce4+峰,Ce3+峰则由u′和v′组成.SHMP 加入后,Ce4+和Ce3+峰位置均发生偏移,这说明SHMP 改变了CeO2表面的化学环境.当SHMP 添加量为5%时,偏移量最大,即电子结合能也最大,最接近Ce3+与Ce4+的标准电子结合能,这说明此时CeO2具有最高的活性[27].
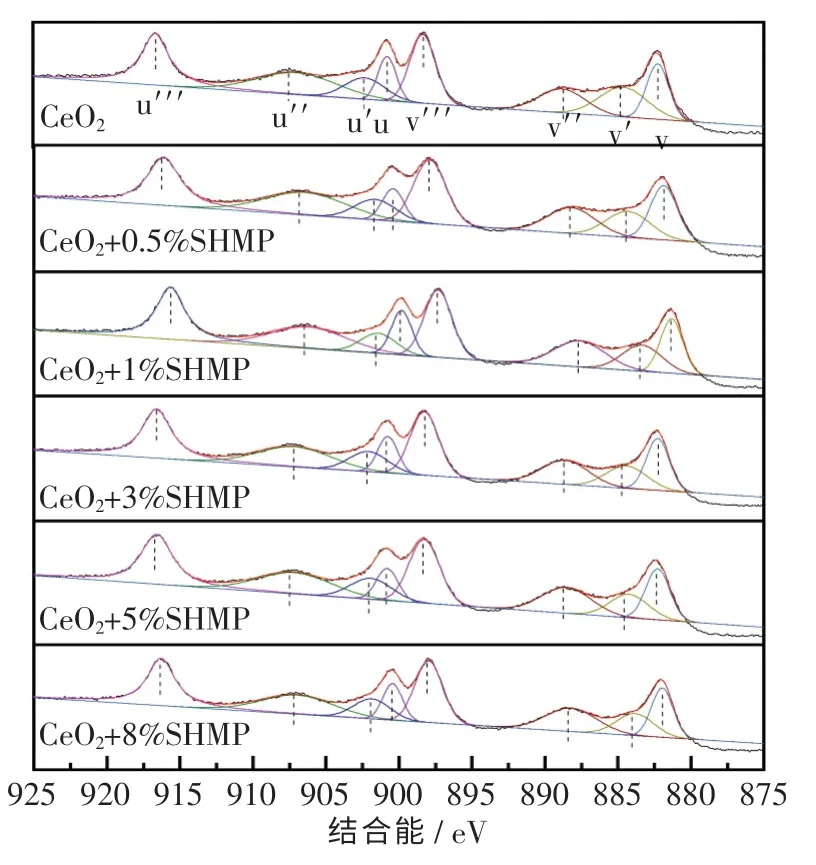
图7 不同SHMP 添加量的CeO2 粉体Ce 3d XPS 扫描图Fig.7 Ce 3d XPS scans of CeO2 powder with different SHMP additions
图8 示出了SHMP 添加量为5%,悬浮液pH值分别为3,5,7,9,11,13.5 时CeO2复合粉体Ce 3d的XPS 扫描图谱.由图可知:通过调节pH值,Ce3+和Ce4+峰位置未发生明显偏移;但随着pH 值的增大,Ce3+含量降低,Ce4+含量升高.这说明增大pH 值可以促进配合反应的进行,从而推动SHMP 与Ce3+配合.
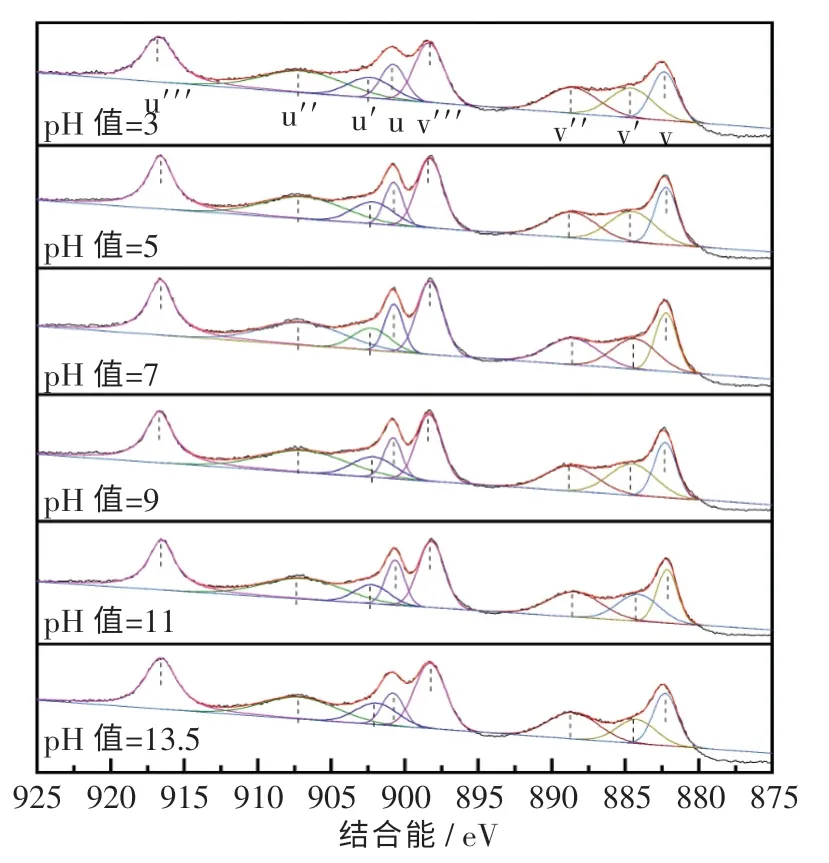
图8 不同悬浮液pH 值的CeO2 粉体Ce 3d 的XPS 扫描图Fig.8 Ce 3d XPS scans of ceria powder at different pH values of suspension
2.3.5 SHMP 与CeO2作用的FT-IR 分析
为了进一步研究SHMP 在CeO2表面的吸附状态,对SHMP 添加量分别为1%,5%,8%的CeO2复合粉体进行红外光谱测试,结果如图9 所示.从图中可看出,1 277.39 cm-1处为SHMP 分子中的P ==O 特征峰,1 097.22 cm-1处为P—O 特征峰,878.35 cm-1处为P—O—P 特征峰[28].当CeO2悬浮液中加入SHMP 后,CeO2颗粒的红外光谱中出现了发生红移的SHMP 特征峰.这是由于CeO2分子表面存在多个Ce3+和Ce4+,同时P—O—Na与Ce3+发生离子交换,此外P ==O 与Ce3+之间还存在范德华力作用,使得多个SHMP 的PO-3被吸附到CeO2表面.而发生红移现象的原因是取代基具有不同的电负性,可通过静电诱导作用引起分子中电子分布的变化,进而导致键力常数的改变[29-30].

图9 不同SHMP 添加量的CeO2 红外光谱图Fig.9 Infrared spectra of ceria with different SHMP additions
还可以从图9 中看出,随着SHMP 添加量的增大,CeO2颗粒表面SHMP 的特征峰强度在增加.这是因为CeO2颗粒表面电性被屏蔽,使得Zeta电位降低,颗粒再次发生团聚现象.
图10 为SHMP 添加量为5%时,不同悬浮液pH 值下CeO2复合粉体的红外光谱图.由图可知,随着pH 值的增大,CeO2颗粒上SHMP 的特征峰强度在增加,且出现红移现象,说明高pH 值对CeO2吸附SHMP 有促进作用.同时,这也是pH 值为11 时CeO2颗粒Zeta 电位绝对值最高、分散稳定性最优的原因,而SHMP 特征峰红移现象的产生同样是诱导效应作用的结果.
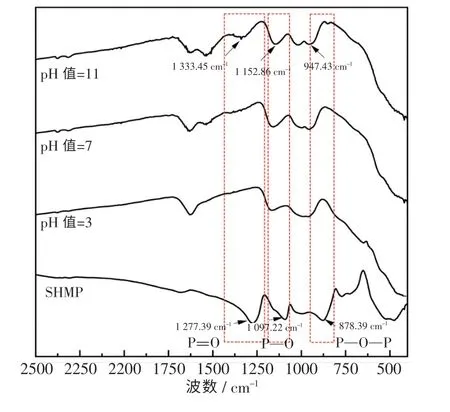
图10 不同pH 值悬浮液中CeO2 红外光谱图Fig.10 Infrared spectra of ceria at different pH values of suspension
3 结 论
(1)当SHMP 添加量为5%、悬浮液pH 值为11 时,CeO2悬浮液分散稳定性最好.此时,CeO2沉降率最小(20%),粒度分布小于0.2 μm 的颗粒积累量达到最高(94.66%).
(2)由于CeO2分子表面同时存在Ce3+和Ce4+,在诱导效应作用下,SHMP 中的P—O—Na基团与Ce3+发生离子交换反应,同时P ==O 与Ce3+之间存在范德华力作用,从而使多个SHMP中的PO-3被吸附到CeO2表面与Ce3+发生配合,此时悬浮液pH 值的增大能够促进配合效应.
(3)SHMP 与CeO2的配合作用不仅增大了CeO2颗粒表面双电层的厚度,还提高了静电排斥力,使Zeta 电位绝对值升高至10.94 mV,悬浮液的黏度和电导率则分别降低至132 mPa·s 和36.5 mS/cm.CeO2颗粒在溶液中的分散稳定性得到提高,为SHMP 应用于CeO2抛光液提供了实验依据.
