不同质量浓度赤霉素对金佛山方竹种子萌发及幼苗生长的影响1)
2024-01-12杨露吕卓赵婉琪伍虹雨黄菲艺林树燕
杨露 吕卓 赵婉琪 伍虹雨 黄菲艺 林树燕
(南京林业大学,南京,210037)
竹子作为绿色、低碳、速生、可再生、可降解的生物质材料,可在替代塑料、应对气候变化、缓解贫困等一系列全球性挑战中发挥独到作用[1]。金佛山方竹(Chimonobambusautilis(Keng) P. C. Keng)属于禾本科(Poaceae)竹亚科(Bambusoideae)寒竹属(Chimonobambusa)植物[2]。金佛山方竹具有重要的经济、生态、社会价值。近些年贵州省桐梓县大力发展方竹产业,新营造了面积为3.72万hm2的方竹林[3],方竹笋发笋期为每年的9—10月份,竹笋略呈方形,味道鲜美,口感丰富,蛋白质及膳食纤维含量高,含有丰富的钙、铁、锌、硒等多种微量元素,被誉为“竹类之冠”,是西南地区特有高山竹种[4];同时金佛山方竹笋箨膳食纤维含量为61.27%,含有钙、磷、镁、钾等矿质元素,必需氨基酸与非必需氨基酸的比值为21.84%,含有丰富的膳食纤维,矿质营养全面且氨基酸组成成分齐全,具有一定的饲用价值[5]。
植物生长调节剂是一种具有与天然植物激素相似生理和生物学效应的物质,是人们根据天然植物激素的作用机制、结构,通过人工合成的化合物,能够有效调控植物的生长发育过程,包括从细胞的增殖分裂,到生根、发芽、开花、结实、成熟、脱落等一系列生命全过程[6-8]。植物生长调节剂在种子的休眠萌发、种胚发育过程中作用显著,赤霉素是发挥关键作用的调控激素之一[9-10]。骆思霜[11]等人研究发现奈乙酸是是影响种子发芽性状的主导因子,吲哚丁酸、赤霉素、奈乙酸的质量浓度分别为0.30、0.40、0.05 g·L-1时,混合溶液浸种1 h可极显著提高种子发芽率和发芽势,缩短种子发芽时间,实现种子整齐发芽;张玉等人研究发现,贵州种源金佛山方竹在低温条件时能更好的萌发,在24~26 ℃萌发率最高、胚根长度最长、展叶时间最短、出苗质量达到最好。刘乐承等[12]研究发现质量浓度为200 mg·L-1的赤霉素不仅能提高菜瓜种子的发芽势、发芽率,而且能使菜瓜苗根长增加,效果达到最好;田美华等[13]发现质量浓度为500 mg·L-1的赤霉素处理可以加速苏铁种子的胚发育,缩短解除休眠的时间。
传统的母竹造林虽然成林快,但母竹年龄背景不清楚,竹林存在大面积开花的风险,因此亟须在竹林中间种一定数量的实生苗。目前对金佛山方竹的研究更多倾向于笋品质[14]、笋箨成色差异[15-16]、笋箨和竹叶的利用[17-19]、种子营养物质[20-22]等方面,缺乏对种子萌发及幼苗生长的系统探索。近几年大娄山山脉分布的金佛山方竹竹林零星开花,每年均能收获部分种子,为本研究提供了一些契机。本研究通过开展不同质量浓度赤霉素对金佛山方竹种子萌发及幼苗生长的影响研究,统计不同质量浓度赤霉素处理时,金佛山方竹种子的发芽势、发芽率等指标差异,并对不同萌发阶段种子及幼苗的生理生化指标进行测定,以期全面了解金佛山方竹种子的萌发特性以及幼苗生长发育规律,同时为金佛山方竹实生苗造林提供理论基础和实践依据。
1 材料与方法
试验材料为成熟的金佛山方竹种子,2023年4月下旬采集于贵州省遵义市桐梓县黄莲乡。种子采后放于透气布袋中,邮寄至南京后带回实验室处理,去稃后清洗干净。
试验方法:试验组使用质量浓度分别为3、5、10 mg·L-1的赤霉素对金佛山方竹种子进行浸种处理,对照组用超纯水浸种处理。挑选颗粒饱满光泽无瑕疵的种子,去除杂质,用纯水冲洗2~3遍,75%体积分数的酒精消毒45 s,次氯酸钠浸泡6 min,再用纯水冲洗干净,试验组放入不同质量浓度的赤霉素浸泡12 h,对照组放入纯水中浸泡12 h,采用湿润的脱脂棉、滤纸作为金佛山方竹种子的发芽床,将其放入光照培养箱内培养,光照培养箱温度为24 ℃,每天的光照时间为12 h,光照强度为2 500 lx[23]。
种子萌发和幼苗生长的6个时期分别为处理当天(S1)、处理4 d(S2)、露白当天(S3)、胚根1 cm时期(S4)、第2片叶展开时期(S5)、第3片叶展开时期(S6)。
种子形态指标和质量的测定方法:随机选取带稃和去稃种子,用数显游标卡尺(精度为0.01 mm)分别测量种子的长度、宽度,进行3次重复,每次重复测量50粒种子。
随机选取带稃种子,用分析天平称取每粒种子质量,进行3次重复,每次重复测量50粒种子;去掉稃片,重复上述操作,分别取平均值,测得带稃种子和去稃种子的质量。
萌发指标的测定方法:种子萌发的高峰期是在7 d,萌发实验持续24 d,期间每隔一天拍照记录种子生长发育情况。发芽率(Rg,%)、发芽势(Rf,%)计算公式如下:
Rf=(N7/Nt)×100%;
Rg=(N24/Nt)×100%。
式中:N7为7 d内正常发芽的种子数(粒);Nt为供试种子数(粒);N24为24 d内正常发芽的种子数(粒)。
根长、苗高、鲜质量测量方法:第2片叶展开当天,将金佛山方竹幼苗用纯水冲洗干净,用滤纸吸干表面水分,每个处理随机取20株测量根长、苗高、鲜质量。
生理指标测定方法:测定不同生长阶段的种子以及幼苗中可溶性糖、淀粉质量分数,同时对种子中淀粉水解相关酶、淀粉合成相关酶、蔗糖水解相关酶的活性进行测定。其中,蔗糖水解相关酶、淀粉水解相关酶、淀粉合成相关酶参考吕卓[24]的测定方法,糖、淀粉测定方法参考高俊凤[25]的检测方法。
数据处理:使用IBM SPSS statistics 22.0软件进行显著性方差分析,并进行差异显著性检验;主成分分析和相关性分析采用Origin 2021软件。
2 结果与分析
2.1 种子的形态和质量测定结果
由图1可知,金佛山方竹为浆果状颖果,果实呈坚果状,椭圆形,新鲜时绿色,干燥后呈褐色。带稃的种子长(11.72±0.36)mm,宽(6.22±0.13)mm,质量(0.232 3±0.001 4)g;去稃的种子长(11.58±1.09)mm,宽(6.20±0.87)mm,质量(0.230 3±0.001 4)g(表1)。
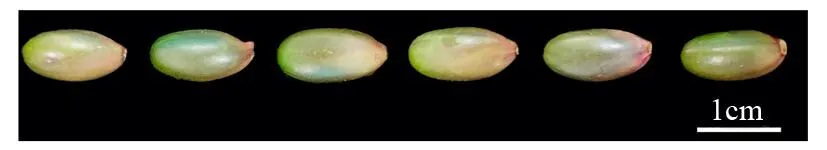
图1 金佛山方竹种子外部形态

表1 金佛山方竹种子形态指标
2.2 不同质量浓度赤霉素对金佛山方竹种子萌发的影响
由表2可知,赤霉素处理显著提高了金佛山方竹种子的发芽率、发芽势。质量浓度为3 mg·L-1的赤霉素处理表现出最佳的促进效果,其发芽率、发芽势达到最高值(分别为77.78%、26.67%),显著高于对照组。然而,随着赤霉素质量浓度的增加,金佛山方竹种子的发芽率、发芽势呈逐渐下降的趋势,质量浓度为5、10 mg·L-1的赤霉素处理时,发芽率、发芽势显著低于对照组,尤其是质量浓度为10 mg·L-1的赤霉素处理时,金佛山方竹种子的发芽率、发芽势达到最低值(分别为44.41%、13.33%)。
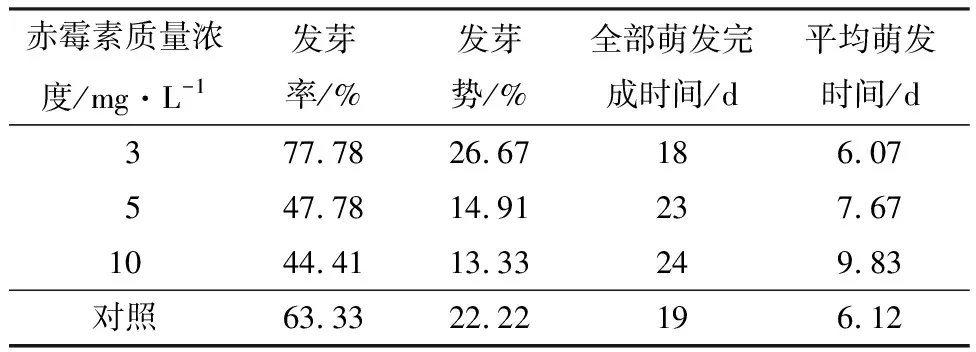
表2 不同质量浓度赤霉素处理对金佛山方竹种子萌发影响的测定结果
2.3 不同质量浓度赤霉素对金佛山方竹幼苗的影响
由图2、表3可知,随着赤霉素质量浓度的增加,金佛山方竹幼苗的高度、根长呈逐渐减小的趋势,展叶时间也随之延长。适宜质量浓度的赤霉素处理能显著促进金佛山方竹幼苗的根长、苗高,当赤霉素质量浓度为3 mg·L-1时,根长、苗高达到最大值(分别为(19.02±2.59)、(4.40±1.10)cm),显著高于对照组,此时为赤霉素的最佳质量浓度;当赤霉素质量浓度为10 mg·L-1时,显著抑制了幼苗的根长、苗高,降至最低值(分别为(4.88±2.18)、(3.20±1.18)cm);当赤霉素质量浓度为5 mg·L-1时,其处理的根长与对照组间无显著差异(P<0.05)。赤霉素不同质量浓度处理的金佛山种子幼苗高度与鲜质量均无显著差异(P<0.05)。

图2 不同质量浓度的赤霉素处理金佛山方竹种子生长
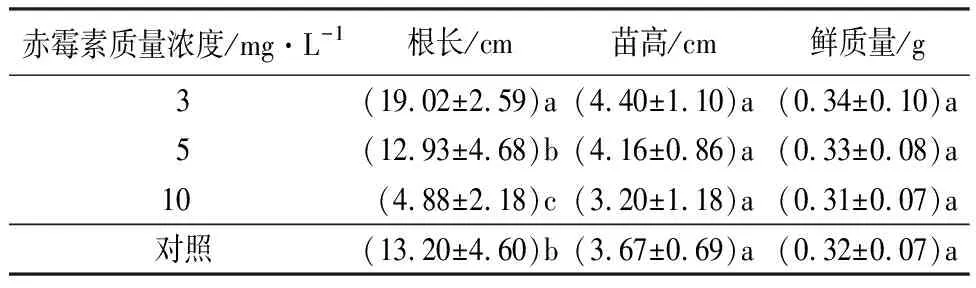
表3 不同质量浓度赤霉素对金佛山方竹幼苗根长、苗高影响的测定结果
2.4 不同质量浓度赤霉素对金佛山方竹种子生理指标的影响
由表4可知,种子中可溶性糖质量分数呈现“下降-上升”的趋势。在S3时期,可溶性糖质量分数达到最低。在S3、S4、S5这3个时期,经过赤霉素处理的种子与对照间均无显著差异。
由表5可知,种子中淀粉质量分数呈现“上升-下降”的趋势,在S3时期淀粉质量分数达到最大值。只有在S3时期,经过赤霉素处理的种子淀粉质量分数与对照间存在显著差异(P<0.05)。
2.5 不同质量浓度赤霉素处理对金佛山方竹种子酶活性的影响
不同质量浓度的赤霉素处理对金佛山方竹种子酶活性影响不同,随着赤霉素质量浓度的升高,酶活性开始下降,当质量浓度为10 mg·L-1时,酶活性均降到最低。
在淀粉合成方向,随着种子萌发和幼苗生长,腺苷二磷酸葡萄糖焦磷酸化酶活性呈先降低后升高的趋势(表6),在S4时期不同质量浓度处理的酶活均有所下降,此时质量浓度为10 mg·L-1的赤霉素处理的种子酶活性最低((2.83±0.07)μmol·g-1·h-1),酶活性在S6时期达到最大值,此时3 mg·L-1质量浓度赤霉素处理的种子酶活性最高((10.58±0.52)μmol·g-1·h-1);可溶性淀粉合成酶在S2、S4时期下降,在随后的阶段又持续上升;而颗粒性淀粉合成酶活性则不断升高,在S6时期达到最大值,此时质量浓度为3 mg·L-1的赤霉素处理的种子酶活性最高((21.69±0.37)μmol·g-1·h-1)。

表4 不同质量浓度赤霉素对金佛山方竹不同时期可溶性糖质量分数影响的测定结果
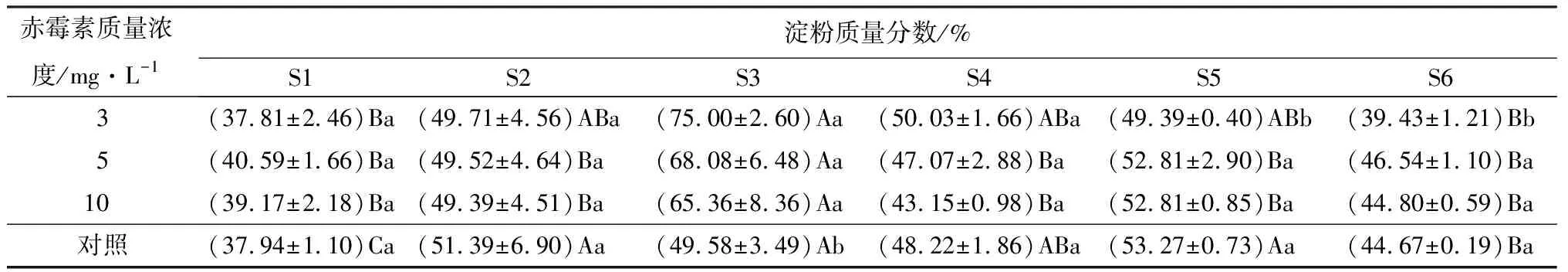
表5 不同质量浓度赤霉素对金佛山方竹不同时期淀粉质量分数影响的测定结果
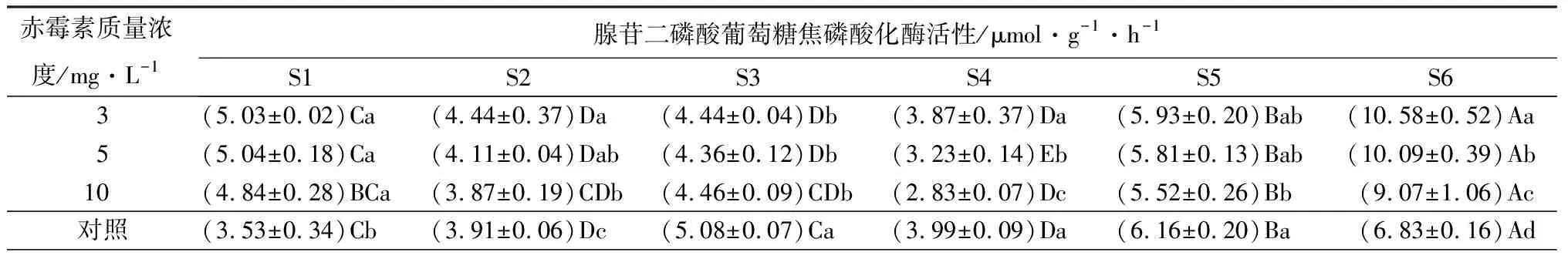
表6 不同质量浓度赤霉素对金佛山方竹不同时期酶活性影响的测定结果
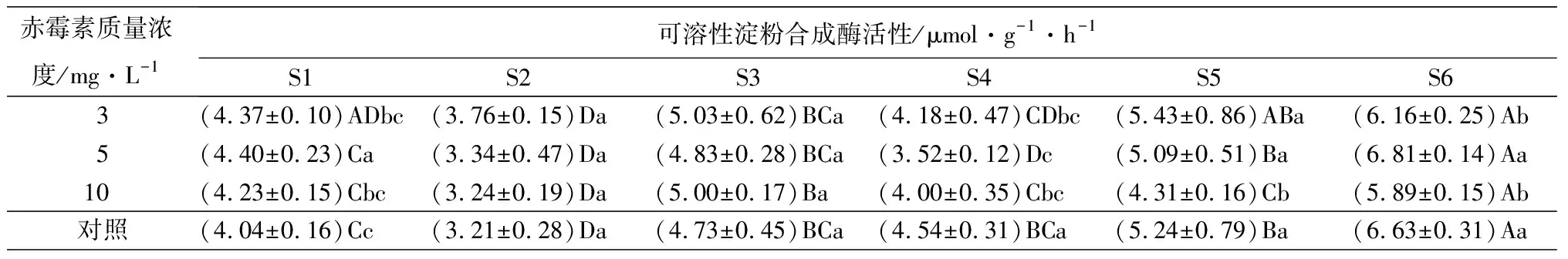
赤霉素质量浓度/mg·L-1可溶性淀粉合成酶活性/μmol·g-1·h-1S1S2S3S4S5S63(4.37±0.10)ADbc(3.76±0.15)Da(5.03±0.62)BCa(4.18±0.47)CDbc(5.43±0.86)ABa(6.16±0.25)Ab5(4.40±0.23)Ca(3.34±0.47)Da(4.83±0.28)BCa(3.52±0.12)Dc(5.09±0.51)Ba(6.81±0.14)Aa10(4.23±0.15)Cbc(3.24±0.19)Da(5.00±0.17)Ba(4.00±0.35)Cbc(4.31±0.16)Cb(5.89±0.15)Ab对照(4.04±0.16)Cc(3.21±0.28)Da(4.73±0.45)BCa(4.54±0.31)BCa(5.24±0.79)Ba(6.63±0.31)Aa
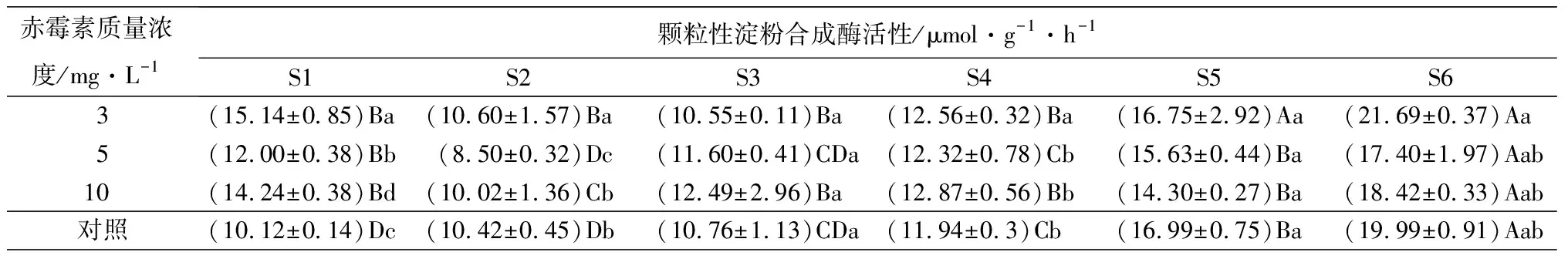
赤霉素质量浓度/mg·L-1颗粒性淀粉合成酶活性/μmol·g-1·h-1S1S2S3S4S5S63(15.14±0.85)Ba(10.60±1.57)Ba(10.55±0.11)Ba(12.56±0.32)Ba(16.75±2.92)Aa(21.69±0.37)Aa5(12.00±0.38)Bb(8.50±0.32)Dc(11.60±0.41)CDa(12.32±0.78)Cb(15.63±0.44)Ba(17.40±1.97)Aab10(14.24±0.38)Bd(10.02±1.36)Cb(12.49±2.96)Ba(12.87±0.56)Bb(14.30±0.27)Ba(18.42±0.33)Aab对照(10.12±0.14)Dc(10.42±0.45)Db(10.76±1.13)CDa(11.94±0.3)Cb(16.99±0.75)Ba(19.99±0.91)Aab

赤霉素质量浓度/mg·L-1α-淀粉酶活性/mg·g-1·min-1S1S2S3S4S5S63(2.92±0.56)Ba(3.06±0.59)Ba(4.35±0.78)Ba(5.85±0.80)Aa(6.36±0.54)Aa(6.25±0.34)Aa5(3.23±0.50)Ca(3.73±0.45)BCa(4.09±0.21)Ba(6.46±0.27)Aa(6.32±0.41)Aa(6.23±0.59)Aa10(0.62±0.17)Cc(3.36±0.09)Ba(3.47±0.11)Ba(6.41±0.59)Aa(6.31±0.32)Aa(6.03±0.30)Aa对照(1.93±0.28)Db(3.10±0.31)Cb(3.27±0.54)Cb(4.58±0.40)Cb(5.29±0.44)Bb(6.34±0.56)Aa
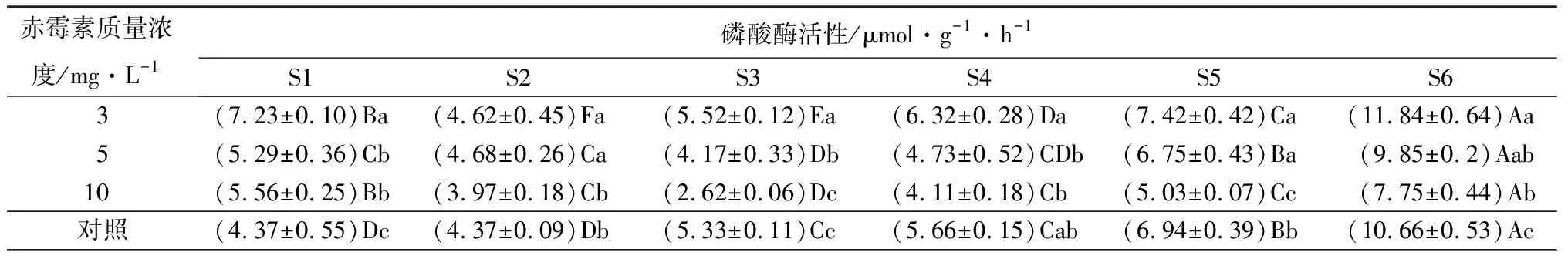
续(表6)
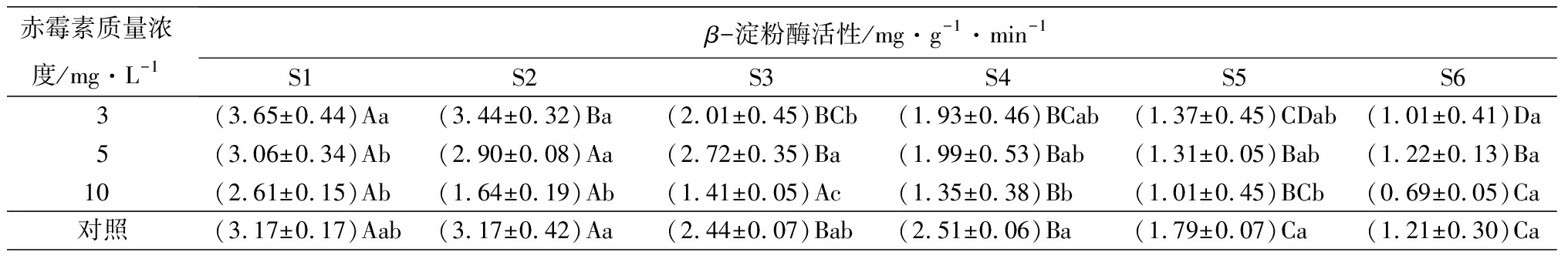
赤霉素质量浓度/mg·L-1β-淀粉酶活性/mg·g-1·min-1S1S2S3S4S5S63(3.65±0.44)Aa(3.44±0.32)Ba(2.01±0.45)BCb(1.93±0.46)BCab(1.37±0.45)CDab(1.01±0.41)Da5(3.06±0.34)Ab(2.90±0.08)Aa(2.72±0.35)Ba(1.99±0.53)Bab(1.31±0.05)Bab(1.22±0.13)Ba10(2.61±0.15)Ab(1.64±0.19)Ab(1.41±0.05)Ac(1.35±0.38)Bb(1.01±0.45)BCb(0.69±0.05)Ca对照(3.17±0.17)Aab(3.17±0.42)Aa(2.44±0.07)Bab(2.51±0.06)Ba(1.79±0.07)Ca(1.21±0.30)Ca

赤霉素质量浓度/mg·L-1可溶性酸性蔗糖转化酶活性/μmol·g-1·h-1S1S2S3S4S5S63(15.33±0.46)Aa(14.64±0.15)Aa(13.58±0.24)Ba(9.31±0.26)Ca(9.66±0.67)Ca(14.19±0.38)Ba5(15.86±0)Aa(13.32±0.62)Cc(13.04±0.32)Cb(10.46±0.42)Dab(10.76±0.67)Da(12.55±0.21)Bb10(13.33±0.46)Ab(12.62±0.36)Bc(12.02±0.02)Bc(10.74±0.10)Cc(10.64±0.60)Ca(13.18±0.53)Bb对照(13.34±0.54)Bb(14.00±0.30)Aab(13.80±0.25)ABa(10.01±0.16)Db(10.00±0.18)Da(12.55±0.24)Cb

赤霉素质量浓度/mg·L-1细胞壁转化酶活性/μmol·g-1·h-1S1S2S3S4S5S63(20.71±0.81)Aa (8.98±1.96)Ba (10.62±0.36)BCa (12.05±0.59)BCa(11.31±2.52)BCa(13.06±2.71)Ca5(19.33±3.86)Aab(8.75±0.18)Cb(8.53±0.04)Cb(13.27±0.79)Bb(14.33±0.69)Ba(13.46±0.16)Ba10(16.54±1.07)Ac(15.35±0.84)ABb(13.32±2.24)ABCab(12.91±0.43)BCab(12.07±1.98)BCa(11.72±3.36)Ca对照(12.59±1.08)Ad(6.09±0.50)Cc(11.79±3.03)Bab(11.99±0.23)Bb(13.19±2.09)ABa(15.20±0.21)Aa

赤霉素质量浓度/mg·L-1蔗糖合成酶活性/μmol·g-1·h-1S1S2S3S4S5S63(218.39±18.53)BCa(184.43±12.01)Ca(171.34±30.14)Ca(236.25±29.38)Ba(394.28±37.10)Aa(408.09±8.22)Aa5(191.61±26.69)Bab(170.54±18.86)Cab(159.39±2.89)Ca(215.24±1.61)Ba(237.13±11.58)Bb(371.12±13.22)Ab10(152.34±7.88)Dc(149.32±5.44)Db(147.24±7.62)Da(174.70±21.69)Cb(272.03±3.44)Bb(374.47±10.23)Ab对照(168.05±4.65)Dbc(182.35±18.35)Da(164.83±31.46)CDa(236.39±12.29)BCa(267.47±9.67)Bb(367.96±12.00)Ab
在淀粉水解方向,α-淀粉酶、磷酸酶活性不断升高,三种不同处理在S6时期达到最大值,且3 mg·L-1质量浓度赤霉素处理的种子酶活性最高(其值分别为(6.25±0.34)mg·g-1·min-1、(11.84±0.64)μmol·g-1·h-1);与之相反的是β-淀粉酶在整个种子发芽和幼苗生长过程中不断下降,在S6时期降到最低,其中,质量浓度为10 mg·L-1的赤霉素处理的种子酶活性低((0.69±0.05)mg·g-1·min-1)。
在蔗糖水解方向,可溶性酸性蔗糖转化酶活性呈现出“下降-上升”的变化趋势,在S4时期有所下降,之后阶段持续升高,在S4时期,3 mg·L-1质量浓度赤霉素处理的种子酶活性最低((9.31±0.26)μmol·g-1·h-1);而细胞壁转化酶活性则会随着种子萌发和幼苗生长逐渐下降,在S6时期降到最低值,且10 mg·L-1质量浓度赤霉素处理的种子酶活性最低((11.72±3.36)μmol·g-1·h-1);与可溶性酸性蔗糖转化酶、细胞壁转化酶活性相比,蔗糖合成酶活性随着种子萌发和幼苗生长呈逐渐增加的趋势,在S6时期各处理酶活最大值,而3 mg·L-1质量浓度赤霉素处理的种子酶活性最高((408.09±8.22)μmol·g-1·h-1),且蔗糖合成酶活性显著高于可溶性酸性蔗糖转化酶、细胞壁转化酶活性,这意味着蔗糖合成酶在蔗糖水解中发挥着更重要的作用。
2.6 不同质量浓度赤霉素处理的金佛山方竹种子在S6时期各指标综合分析
由图5可知,各指标主要集中在一、二、四象限,也就是分布在对照和质量浓度为3、5 mg·L-1处理之间。其中,磷酸酶、蔗糖合成酶、颗粒性淀粉合成酶、可溶性糖、可溶性酸性蔗糖转化酶、腺苷二磷酸葡萄糖焦磷酸化酶主要分布在质量浓度为3 mg·L-1赤霉素处理,说明其相关性较强,而质量浓度为5 mg·L-1赤霉素处理和对照附近主要分布的是可溶性淀粉合成酶、细胞壁转化酶、说明这两个指标间距离较近,相关性也较强;在对照和质量浓度为3、5 mg·L-1赤霉素处理时根长、苗高、发芽率、发芽势、鲜质量距离较近,说明其相关性较强。
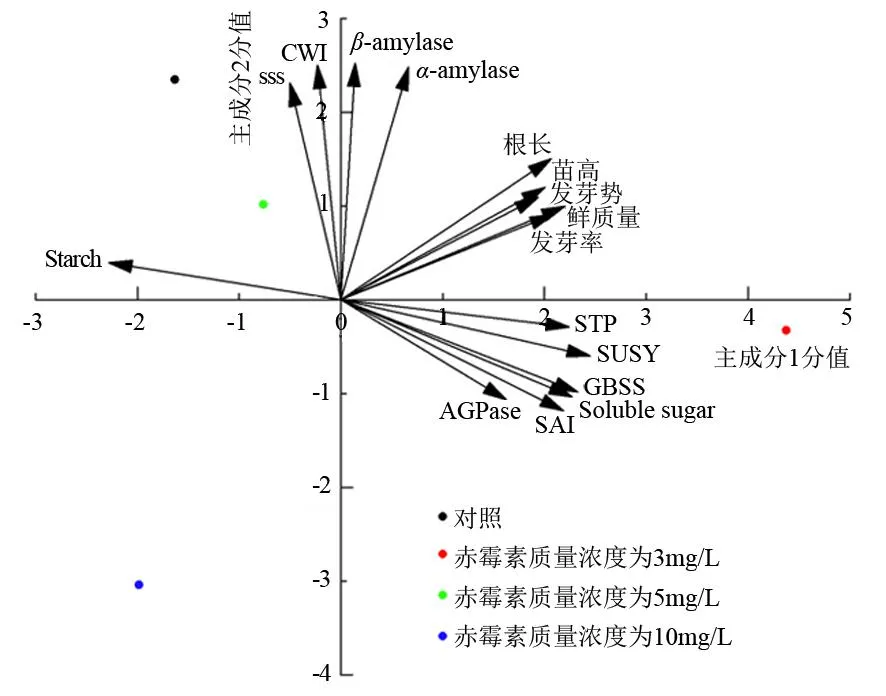
主成分1的贡献率为56.6%;主成分2的贡献率为28.8%;Starch为淀粉;SSS为可溶性淀粉合成酶;CWI为细胞壁转化酶;α-amylase为α-淀粉酶;β-amylase为β-淀粉酶;STP为磷酸酶;SUSY为蔗糖合成酶;GBSS为颗粒性淀粉合成酶;Soluble sugar为可溶性糖;SAI为可溶性酸性蔗糖转化酶;AGPase为腺苷二磷酸葡萄糖焦磷酸化酶。
3 讨论
赤霉素能够促进种子对胚乳的吸收、利用[26],并在种子萌发的初期和胚根突出阶段发挥作用,此外,赤霉素还可以解除种子休眠,促进α-淀粉酶的表达和活性提高、促进细胞分裂分化,促进种子胚的发育和种子的萌发[27]。有研究表明,经过赤霉素浸种处理,会激活部分基因来调控酶的合成和分泌,影响代谢反应,进而打破种子的休眠并且提高种子活力[28]。低质量浓度范围内无法很好地打破种子休眠,而过高质量浓度范围内会使种子发霉[29]。前人的研究表明,适当质量浓度的赤霉素可以促进羊草、金佛山方竹种子的萌发,本研究表明,不同质量浓度赤霉素处理可以影响金佛山方竹种子的发芽率、发芽势、根长、苗高等。其中3 mg·L-1质量浓度赤霉素处理的种子发芽率、发芽势最高,根长、苗高等指标均优于其他处理。
酶是生物催化剂,对植物体内物质代谢、形态建成、能量转化等过程具有重要作用[28,30-31]。在种子萌发过程中,酶能够催化和调节体内物质的转化,并将其转化为可运输的形式,以供给生长和合成反应所需的能量[32]。淀粉的生物合成途径中,腺苷二磷酸葡萄糖(ADPG)焦磷酸化酶的作用是将葡萄糖-1-磷酸中的葡萄糖残基转移到三磷酸腺苷(ATP)上生成腺苷二磷酸葡萄糖,进而合成淀粉,这是淀粉生物合成的重要调节位点,是淀粉合成过程中的关键酶[32]。可溶性淀粉合成酶以游离的状态存在于淀粉中,催化腺苷二磷酸葡萄糖与淀粉引起反应,将葡萄糖分子转移到淀粉引物上,使淀粉链延长[33-34]。种子中的可溶性淀粉合成酶越强,种子利用腺苷二磷酸葡萄糖合成长链淀粉的能力就越强。颗粒结合型淀粉合成酶促进淀粉颗粒的合成和聚集,这些储存的淀粉颗粒提供了萌发过程所需的能量基质[35]。淀粉合成酶活性的增强,进一步促进淀粉合成,意味着淀粉颗粒的合成和聚集过程的加强,而淀粉磷酸酶活性的增加是使种子休眠觉醒的标志之一,在种子露白时会显著提高;蔗糖合成酶活性变化与种子的代谢调控密切相关,活性随着种子萌发和幼苗生长逐渐变高,蔗糖合酶通过水解蔗糖,提供了合成纤维素所需的底物高质量浓度的植物生长调节剂,除了抑制种子的萌发率,还通过抑制种子中的淀粉水解酶、蔗糖水解酶活性来抑制幼苗高度的生长。
本研究中,磷酸酶与蔗糖合成酶、腺苷二磷酸葡萄糖焦磷酸化酶、α-淀粉酶、可溶性糖、苗高、鲜质量呈显著正相关;颗粒性淀粉合成酶与可溶性酸性蔗糖转化酶、蔗糖合成酶、可溶性糖质量分数呈显著正相关,但与淀粉质量分数呈负相关;可溶性淀粉合成酶与β-淀粉酶呈极显著正相关;可溶性酸性蔗糖转化酶、蔗糖合成酶与可溶性糖质量分数呈极显著正相关,但与淀粉质量分数呈极显著负相关;细胞壁转化酶与β-淀粉酶呈极显著负相关;此外,淀粉质量分数与发芽率、发芽势呈极显著负相关,而与发芽特性、生长呈极显著正相关。这些代谢过程和淀粉质量分数在植物生长发育中相互关联,调节着植物的能量代谢和发育过程。
4 结论
综合种子发芽情况与形态指标的分析结果表明,质量浓度为3 mg·L-1赤霉素是促进金佛山方竹种子发芽、幼苗生长的最佳质量浓度,3 mg·L-1质量浓度处理后的金佛山方竹种子发芽率为77.78%、发芽势为26.67%、根长为19.02 cm、苗高为4.40 cm,对照组的发芽率为63.33%、发芽势为22.22%、根长为13.20 cm、苗高为3.67 cm。可溶性糖、淀粉、淀粉磷酸化酶、蔗糖合酶的变化与金佛山方竹种子萌发和幼苗生长密切相关,共同参与调控其生长发育。
但本实验尚有一些不足之处,还需进一步设计低于3 mg·L-1质量浓度的赤霉素处理,以便确定最优赤霉素质量浓度。
