立体定向颅内病变活检术病理诊断率及术后出血的影响因素分析
2024-01-12钱民伟任思颖王丽琨伍国锋
钱民伟,任思颖,王丽琨,伍国锋
颅内占位性疾病复杂多样,病理组织学诊断仍是定性诊断的金标准。立体定向颅内病变活检术是创伤最小的获取颅内病变病理组织的最佳方法[1]。本研究通过回顾性分析立体定向颅内病变活检术共110 例患者的临床资料、术后病理结果及术后不良事件,分析立体定向颅内病变活检术病理诊断及术后出血的影响因素。
1 资料与方法
1.1 一般资料
回顾性分析贵州医科大学附属医院急诊神经科2016 年1 月1 日至2022 年12 月31 日行立体定向颅内病变活检术的110例患者的临床资料。本研究经贵州医科大学附属医院医学伦理委员会审批同意(批件号:2023论审第335号)。
纳入标准:①入组患者活检前接受过颅脑CT/MRI检查,确定颅内有占位性病变;②不能确定占位性质,需行活检明确诊断;③患者及家属知情同意;④临床资料完整。排除标准:①不能耐受手术的患者;②术中未取活检组织行病理组织学检查的患者;③临床资料不完整。
110 例行立体定向颅内病变活检术的患者中男性67 例,女性43 例;平均年龄(48.64±16.66)岁。根据术后病理是否明确诊断分为病理诊断组92例,未诊断组18例;将术后复查头颅影像学检查的98例患者根据是否有出血征象分为术后出血组40 例及术后未出血组58例。
1.2 方法
1.2.1 手术设备器械 手术器械使用VS-6006S 高精度脑立体定向仪(陕西威盛医疗器械有限公司),配件包括定位扫描框架、弓形定位系统以及Sedan 侧方开口活检针;YL-1 型钻头(北京万特福科技有限责任公司)、微型电钻等设备。
1.2.2 病理诊断的定义 病理诊断的定义是指特定病变的脑活检病理结果足以作出诊断并指导治疗或修改治疗方案[2]。脑组织活检的病理结果可分为3类:①特异性病变;②非特异性病变;③正常脑组织[2]。其中特异性病变可以明确诊断;部分非特异性病变结合病史、查体及辅助检查对疾病最终诊断有帮助,这一类非特异性病变被归入诊断组;对疾病诊断没有帮助的非特异性病变及正常脑组织则被归入未诊断组。
1.2.3 术后并发症的定义 脑活检相关的并发症被定义为术后30天内的不良事件[3]。本研究选用的是法国PSL脑组织活检研究中心发布的颅内手术不良事件严重程度分级量表[3],具体评分标准见表1。

表1 颅内手术不良事件严重程度分级量表
1.2.4 手术方法 立体定向颅内病变活检术是一种通过影像学定位和定向仪引导,将活检穿刺针置入颅内特定病灶靶点并留取组织标本,结合病理组织学来诊断各种中枢神经系统疾病的方法[4]。具体手术过程如下:①头皮螺钉安装处局麻后安装Leksell-G立体定向框架(图1A);②陪同患者行CT或MRI定位扫描;③根据术前定位影像资料确定活检靶点,根据定位靶点计算X、Y 和Z 轴数值(图1B);④常规消毒铺巾,安装立体定向仪弓形架载持器(图1C),根据靶点X、Y和Z轴的数值确定入颅点及穿刺轨迹,并计算出穿刺角度和入颅深度;⑤局麻后颅骨钻孔,钻开颅骨及硬脑膜后将活检针置于弓形架载持器上,根据靶点坐标将Sedan侧方开口活检针(图1D)缓慢置入靶点,注射器负压抽吸,从靶点抽吸出脑组织块后送检(图1E、F),必要时可多部位多靶点取脑组织送检;⑥术后送返病房,密观意识及生命体征变化。
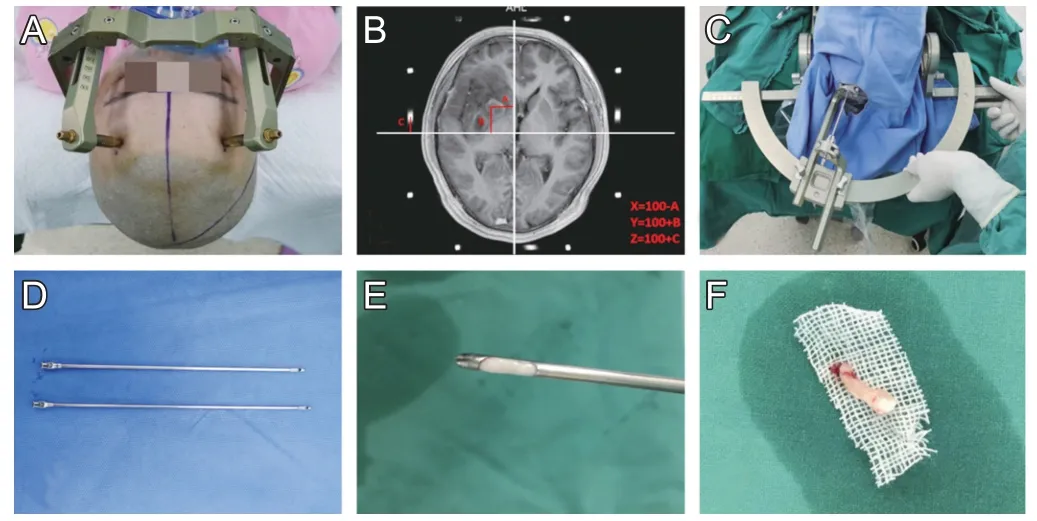
图1 立体定向颅内病变活检术手术过程
1.2.5 资料收集 收集患者的年龄、性别、主要临床表现、生命体征、既往病史、个人史、部分血液生化指标、病灶部位、病灶数目、靶点的数目、取材部位、取材的路径、手术记录、术前及术后影像学资料、术后病理组织学结果和术后不良事件等。
1.3 统计学处理
本研究采用回顾性分析,采用SPSS 26.0软件处理数据。分类变量以百分比表示,组间比较采用χ2检验;符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验;不符合正态分布的计量资料,用中位数[M(QR)]表示,组间比较采用Mann-Whitney U检验;多因素分析用Logistic回归分析,将独立危险因素纳入ROC曲线评估该因素对立体定向颅内病变活检术后出血的预测价值,P<0.05为差异有统计学意义。
2 结果
110例患者中,术后病理结果能明确诊断92例,病理诊断率为83.6%,其中脑病3例、脱髓鞘病变2例、囊肿1例、炎症及结核8例、梗死灶4例、脑出血5例、脑脓肿3 例、生殖细胞瘤4 例、转移瘤9 例、淋巴瘤10 例、交界性肿瘤1 例、低级别胶质瘤21 例、高级别胶质瘤21例;术后病理结果不能明确诊断18 例,其中正常脑组织6例、胶质细胞增生12例。术后复查影像学检查98例,影像学提示有出血征象40例,无出血征象58例。
2.1 病理诊断组与未诊断组
根据术后病理结果是否明确诊断分为病理诊断组92例,病理未诊断组18例。将2组资料进行单因素分析发现术前定位方式是立体定向颅内病变活检术病理诊断的影响因素,病理诊断组中术前采用MRI定位方式的患者占比明显高于病理未诊断组(P=0.015),见表2。
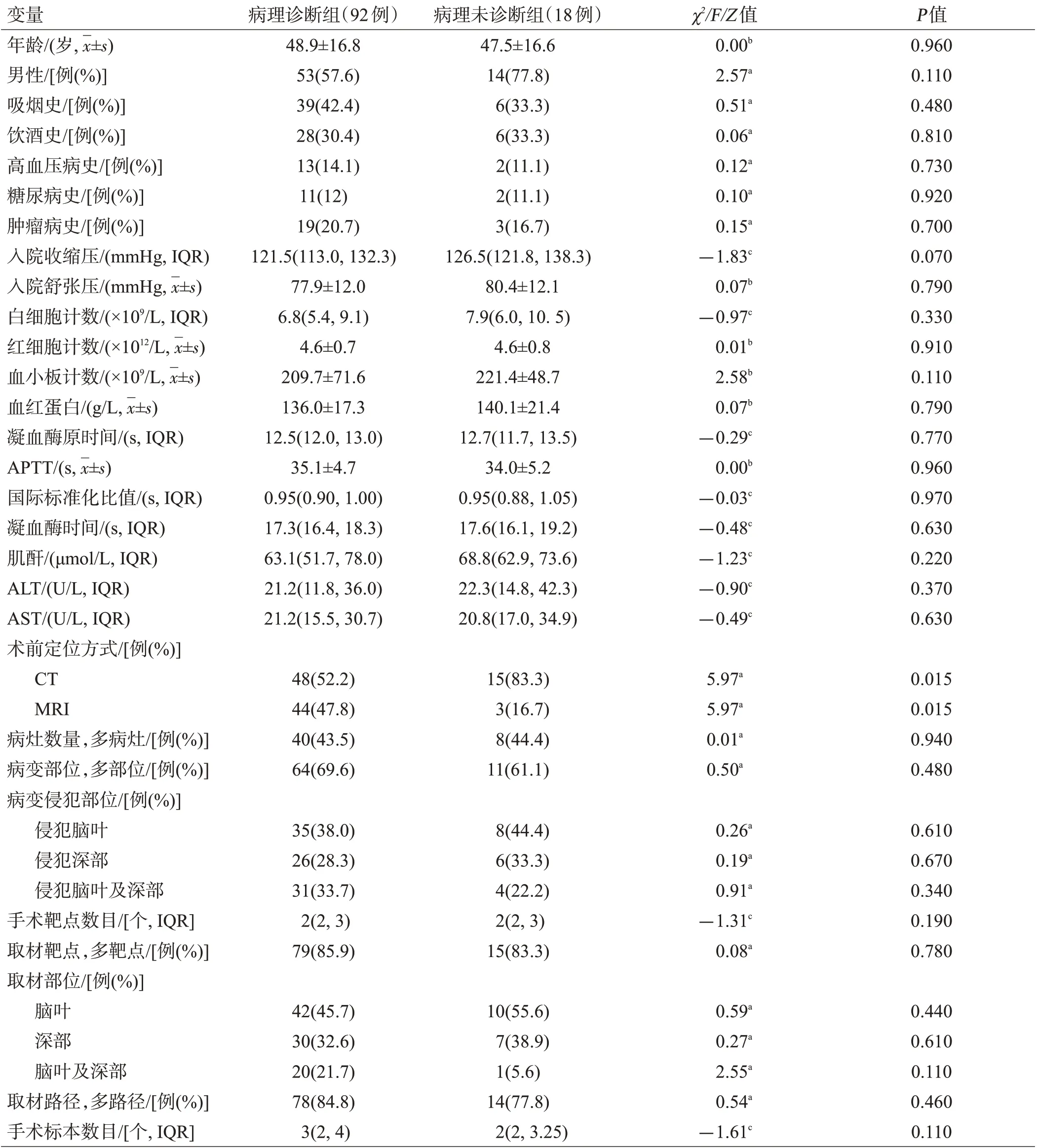
表2 病理诊断组与病理未诊断组比较
2.2 术后出血组与术后未出血组
术后98 例患者复查头颅CT,根据术后有无出血征象分为术后出血组40例,术后未出血组58例。将2组资料进行单因素分析提示凝血酶原时间(P=0.009)、国际标准化比值(P=0.002)、高级别胶质瘤病理类型(P=0.001)是术后出血的影响因素,见表3。
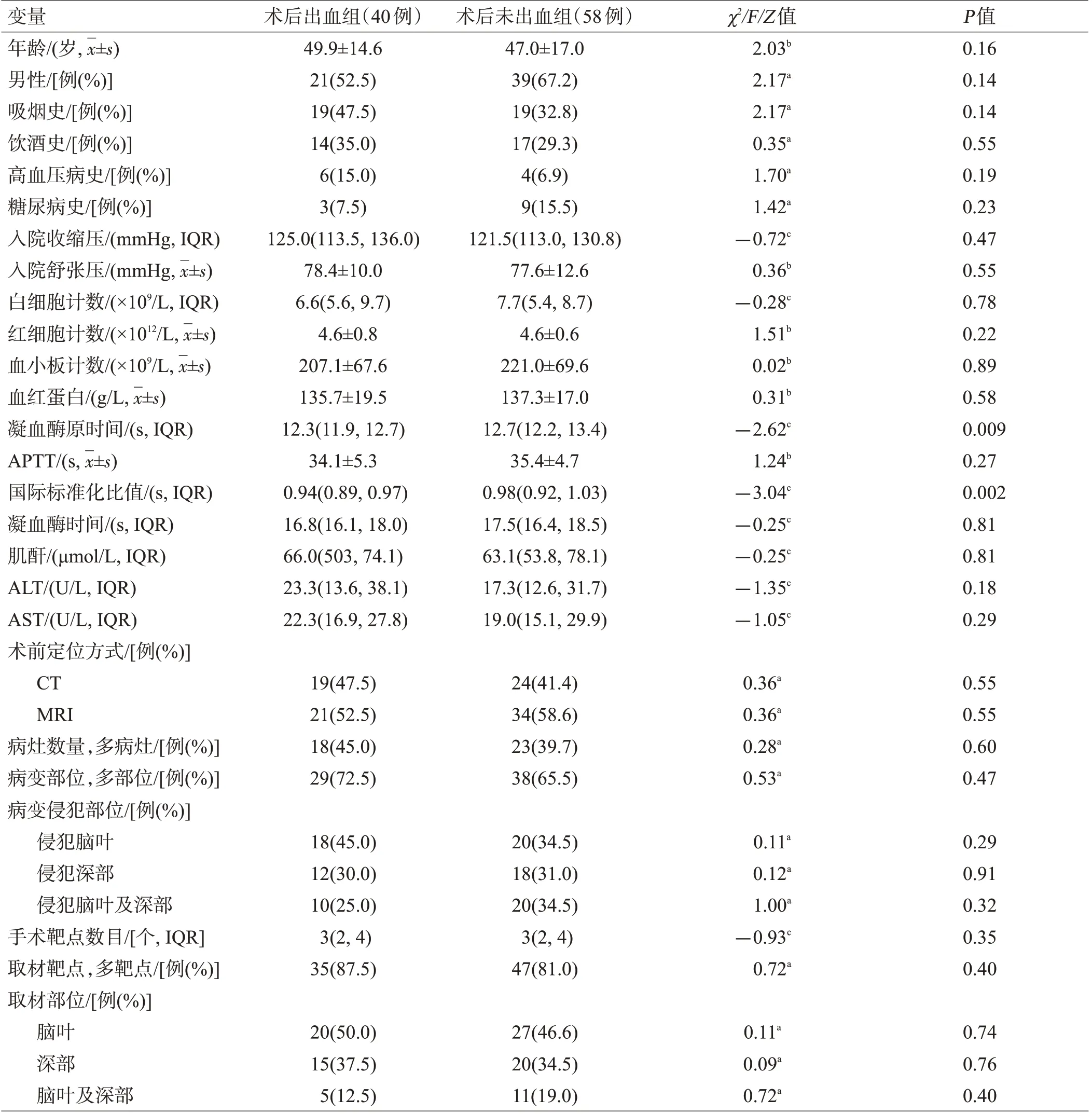
表3 术后出血组与术后未出血组比较
2.3 术后出血影响因素的多因素Logistic回归分析
以凝血酶原时间、国际标准化比值、高级别胶质瘤为自变量,术后出血为因变量,多因素Logistic回归分析显示,高级别胶质瘤是立体定向颅内病变活检术后出血的独立危险因素(OR=5.502,P=0.005),见表4。

表4 立体定向颅内病变活检术后出血影响因素的多因素Logistic回归分析
2.4 高级别胶质瘤对术后出血的预测价值分析
绘制ROC 曲线评估高级别胶质瘤对术后出血的预测价值,敏感度为0.35,特异性为0.914,阳性预测值为0.737,阴性预测值0.671,约登指数为0.264,对应的曲线下面积为0.632(P=0.027),见图2。
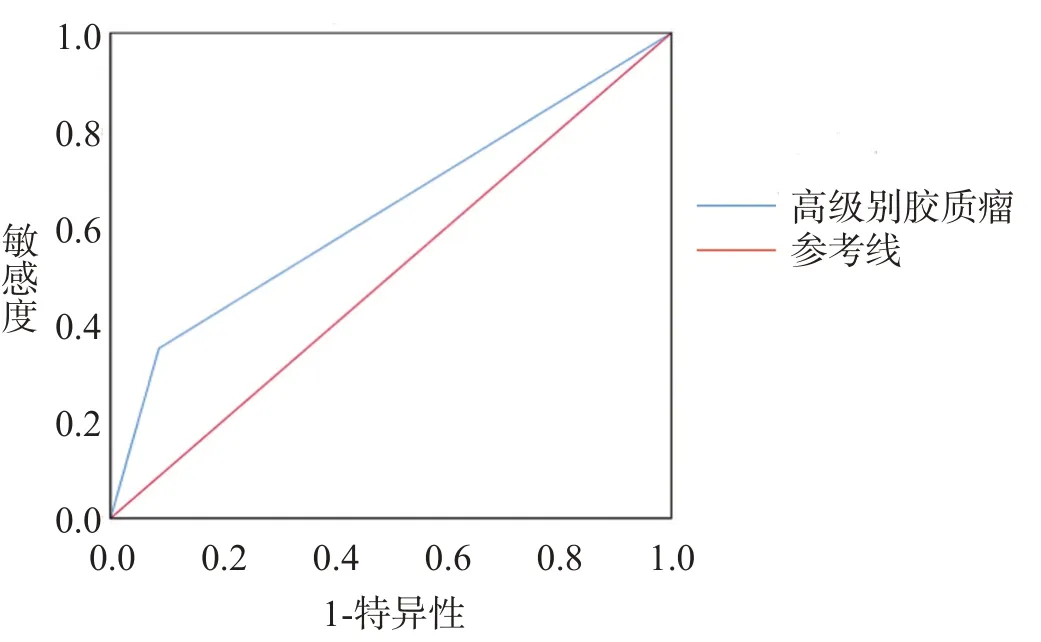
图2 高级别胶质瘤预测立体定向颅内病变活检术后出血的ROC曲线
3 讨论
许多颅内占位病变仅通过影像学检查不能定性诊断,尤其是颅内肿瘤,精准治疗需要通过免疫组化和分子生物学的结果来选择,这使得脑活检成为颅内肿瘤定性诊断的金标准[5]。本研究中,110例患者中有92例病理诊断明确,诊断率为83.6%,这与Dammers 等[6]的荟萃分析结果相符。考虑到肿瘤、脑外伤、炎症、缺氧等多种疾病均可出现胶质细胞增生的病理表现,因此本研究未将胶质细胞增生纳入病理诊断组。本研究发现术前定位方式是病理诊断的影响因素,术前MRI定位比CT 更有优势,原因可能是CT 在定位中更容易受到立体定向框架伪影的干扰,影像学成像不清晰,导致手术靶点定位不准确;其次是因为CT对病灶及其周围水肿区域的分界不清,靶点选择可能出现在病灶周围水肿区域,从而得到阴性结果。
既往研究表明,术中冰冻切片活检及涂片有助于提高病理诊断率[6,7],但在本研究中所有患者均未行上述术中检查,这也可能是导致本研究病理诊断率相对较低的原因之一。除了术中病理组织学检查,5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)和荧光素钠引导的术中荧光也被应用于立体定向颅内病变活检术。Widhalm 等[8]在研究中发现有39 例颅内肿瘤病灶患者呈现出强5-ALA 荧光,这些患者的术后病理诊断率可达100%。Xu 等[9]的研究发现术中荧光素钠引导可以显著增加立体定向活检病理诊断率,并且可以减少术中取样数量,这些新兴技术的应用被证实可以提高诊断率。
立体定向颅内病变活检术的术后不良事件有出血、癫痫发作、颅内感染、脑水肿、神经功能障碍及死亡等,其中出血是最常见的术后并发症。既往文献报道术后出血发生率为7.0%~59.8%[10],其中大部分研究未将术后无症状出血纳入不良事件的统计。在一些将无症状出血纳入统计的研究中,术后出血的发生率可达27.0%~59.8%[10-12],这与本研究相符合。对比术后出血组与未出血组,凝血酶原时间、国际标准化比值、高级别胶质瘤是术后出血的危险因素,其中高级别胶质瘤是术后出血的独立危险因素并具有预测价值。术后出血组的凝血酶原时间和国际标准化比值低,可能与术后出血组高级别胶质瘤占比高的原因有关。一项关于神经胶质瘤与外周凝血功能指标的研究发现,神经胶质瘤的级别越高,凝血酶原时间越短,国际标准化比值也低[13]。高级别胶质瘤的患者凝血纤溶功能异常,血液处于高凝状态,这就使得出血组患者的凝血酶原时间降低。此外,高级别胶质瘤恶性程度高、分化程度低、血运丰富,脑活检破坏了肿瘤的完整性可以导致更多的出血率。
综上所述,与头颅CT定位相比,术前采用MRI定位有助于提高立体定向颅内病变活检术病理诊断率。凝血酶原时间、国际标准化比值和高级别胶质瘤与术后出血相关,其中高级别胶质瘤是影响术后出血的独立危险因素且具有预测价值。本研究为回顾性研究,存在一定的局限性。首先,这是一项单中心研究,临床样本量相对较小。其次,部分患者术后未行影像学检查被排除在术后不良事件的统计中,但均为无症状患者,排除的这部分患者对最终的统计结果也有影响。将来还需要进行改进及不断创新,术前采用MRI定位,增加术中活检,提高立体定向颅内病变活检术的诊断率。
