产肠毒素大肠杆菌和沙门氏菌的多重PCR 检测方法构建
2024-01-12牛灵玥王慧杨俊杜丽飞刘俊琦周望平
牛灵玥,王慧,杨俊,杜丽飞,刘俊琦,2※,周望平※
(1.湖南省畜牧兽医研究所,湖南 长沙 430131;2.湖南农业大学动物医学院,湖南 长沙 410128)
鸡腹泻性疾病是细菌、病毒、环境等多种因素均可引发的常见群发性疾病,临床上主要表现为患病鸡食欲下降,生长减缓,产蛋量降低[1]。大肠杆菌和沙门氏菌是导致鸡腹泻病的两种重要且常见的食源性病原微生物。沙门氏菌每年引起全世界超过13 亿人口感染,超过20 万例死亡[2]。沙门氏菌在成年鸡体内一般呈隐性感染,垂直传染给下一代或通过肉、蛋等制品进入人体,引起食物中毒,严重危害养殖业发展和公共健康[3]。大肠杆菌通常存在于哺乳动物和禽类的胃肠道及其他黏膜表面,分为共生菌株和致病菌株[4,5]。共生菌株与宿主共同生存,互惠互利;致病菌株则会导致严重的感染性疾病,且饲养环境不当、应激、其他疾病后的继发感染都可导致其病发生,对宿主机体造成严重破坏[4-7]。其中产肠毒素大肠杆菌是致病菌株中的一种,主要引起禽类腹泻甚至死亡,给家禽养殖业造成严重的经济损失。
目前,对禽产肠毒素大肠杆菌和沙门氏菌的感染诊断主要通过细菌分离鉴定、生化试验、分子生物学技术和免疫学技术等,常规的检测方法耗时长,且对操作人员、技术、时间都有较高的要求[8,9]。单重PCR 技术弥补了这一不足,降低了对人员和耗时的要求,但单次只能检测一种基因的限制使得其仍然不适应集约化大量养殖的现状。多重PCR技术基于PCR 技术发展而来,可以实现两种以上的基因同步检测,进一步提升检测速度和通量,在检测效率和灵敏度方面都有较大提升[9-11]。
1 材料
1.1 菌株来源
产肠毒素大肠杆菌及沙门氏菌的菌种均由湖南农业大学动物医学院实验室进行分离、鉴定和保存。
1.2 主要试剂
DNA 聚合酶、dNTP Mix 和PCR 缓冲液均购自杭州博日科技股份有限公司;DNA marker、标准leader 均购自北京索莱宝科技有限公司;细菌基因组DNA 提取试剂盒购自Omega Bio-Tek 公司。
1.3 主要仪器与耗材
移液枪、移液枪头、PCR 管、核酸电泳仪、PCR仪、凝胶成像设备、恒温培养箱、高压蒸汽灭菌锅、超净工作台等。
2 方法
2.1 细菌培养与基因组DNA 模板提取
将菌种在普通培养基上培养过夜,再按照细菌基因组DNA 提取试剂盒步骤提取细菌基因组DNA作为模板,并于-20 ℃保存。
2.2 引物设计
根据GENBANK 和参考文献[2,3,12,13],选择产肠毒素大肠杆菌特征性毒力基因hlyE 基因和沙门氏菌特征基因invA 基因作靶标,用Primer Premier 5.0软件设计引物,使产物长度大小相差100 bp 行比对,引物由北京擎科生物有限公司合成。引物及产物长度如表1。
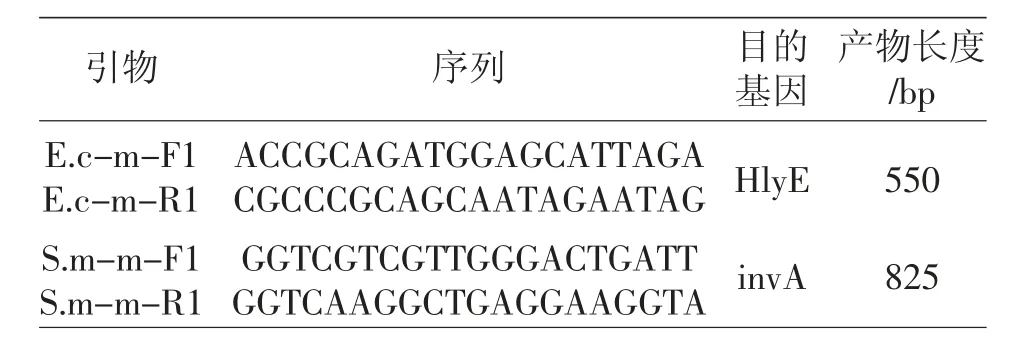
表1 设计使用的引物
2.3 多重PCR 方法的建立及优化
以沙门氏菌和产肠毒素大肠杆菌基因组DNA为模板,加入相应引物进行PCR 扩增,构建50 μL体系,DNA 聚合酶2 μL、5× Buffer 20 μL、TP Mix 2 μL、A 模板和上、下游引物分别各1 μL、ddH2O 补足到50 μL,进行初次双重PCR 实验,验证引物可信度。而后分别调整DNA 聚合酶、dNTP、Mg2+、引物浓度以及退火温度等条件,确立最佳反应体系及反应条件,建立多重PCR 方法。
2.3.1 酶的优化
保持dNTP、Mg2+、模板和引物浓度不变,改变加入酶的量为0.125、0.25、0.5、0.75 μL,加水配平至50 μL 体系,进行PCR 扩增,而后进行凝胶电泳实验验证结果。
2.3.2 dNTP 的优化
将酶优化的结果带入体系,Mg2+、模板和引物浓度及反应条件不变,每管分别加入dNTP 1、2、3、4、5、6、7 μL,并加水配平50 μL 体系,进行PCR 扩增,而后进行凝胶电泳实验验证结果。
2.3.3 Mg2+的优化
将酶和dNTP 优化的结果带入,保持模板和引物浓度及反应条件不变,每管分别加入Mg2+buffer 2、3、4、5、6、7、8 μL,进行PCR 扩增和凝胶电泳检测验证。
2.3.4 引物的优化
将前文体系优化结果带入,配平模板后取引物梯度0.5、1、1.5、2 μL,两种引物两两配对,共16 种进行PCR 扩增与凝胶电泳检验。
2.3.5 退火温度的优化
将体系优化结果带入,构建50 μL 体系,应用梯度PCR 仪设置55~62 ℃的温度梯度,间隔1 ℃,共8 个梯度,进行PCR 扩增和凝胶电泳检测。
2.4 灵敏性检测
分光光度计测得产肠毒素大肠杆菌浓度187.85 ng/μL、沙门氏菌浓度7.9 ng/μL,以1∶23比例混合均匀,10 倍倍比稀释得DNA 浓度为15.3、1.53、0.153、0.0153 ng 的梯度为模板,以优化后的多重PCR 方法扩增,并对结果进行凝胶电泳检测。
2.5 特异性检测
用优化后的多重PCR 方法,分别检测实验室已分离的产肠毒素大肠杆菌、沙门氏菌、巴氏杆菌、葡萄球菌、链球菌、绿脓杆菌等细菌的DNA 模板,以验证多重PCR 方法的特异性。
2.6 检测方法的应用
从某养禽场采集腹泻粪便样本59 份,用普通肉汤进行37 ℃增菌培养,取少量培养后的菌液于无菌EP 管内,沸水煮10 min 后转冰浴10 min,再放入离心机12 000 r/mim 离心5 min,取上清液进行PCR 检测。
3 结果与分析
3.1 多重PCR 方法的建立和优化
分别以产肠毒素大肠杆菌和沙门氏菌DNA 为模板进行单重PCR 和双重PCR 扩增试验,均可扩增到符合预期大小的特异性条带。在单重PCR 的基础上,优化酶、dNTP、Mg2+、引物浓度和退火温度建立多重PCR 方法(图1~5)。结果显示,在50 μL 体系中,BioReady Pfu(5 U/μL)0.5 μL,10× Reaction Buffer(含20 mmol MgSO4)5 μL,2.5 mmol dNTP Mixture 3 μL,两种引物分别各(10 μmol)1 μL,核酸模板各1 μL,水37.5 μL。反应条件为94 ℃预变性5 min,94 ℃变性30 s,57.5 ℃退火30 s,72 ℃延伸2 min,重复30 个循环,72 ℃终延伸10 min。此时可高效且特异性扩增出目的条带并无杂带出现。

图1 酶的优化
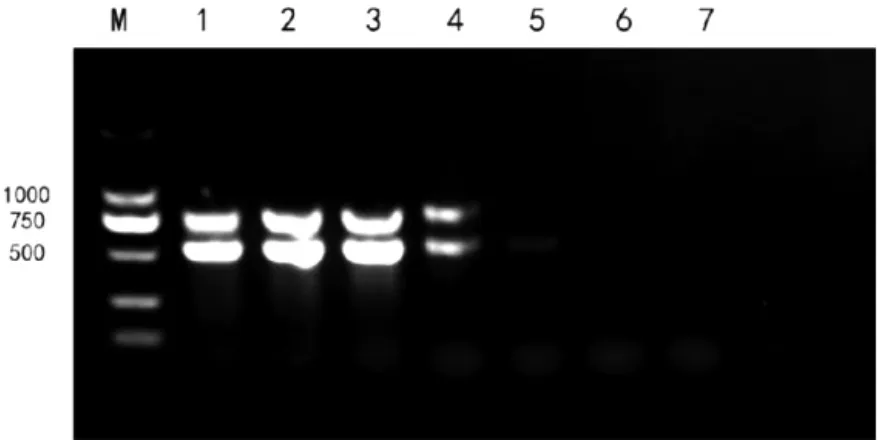
图2 dNTP 优化

图3 镁离子优化

图4 引物优化结果
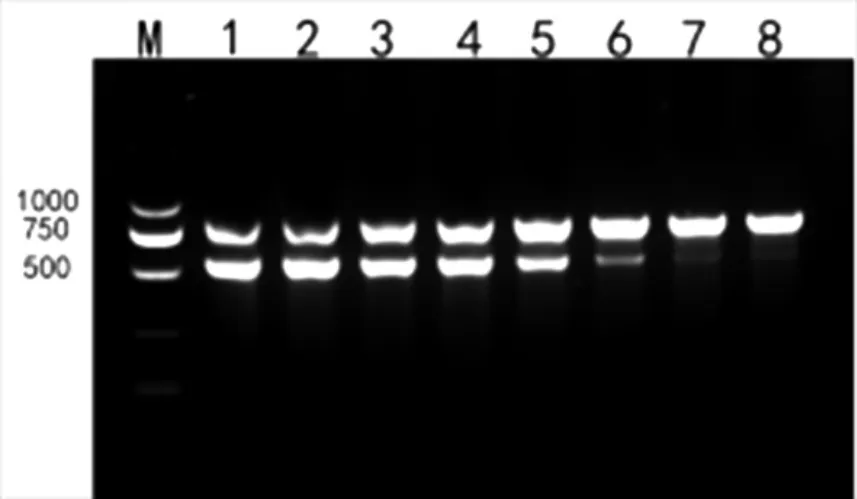
图5 退火温度优化
3.1.1 酶优化结果
凝胶电泳实验结果表明BioReady Pfu(5 U/μL)酶最优量为0.5 μL。
3.1.2 dNTP 优化结果
凝胶电泳实验结果表明2.5 mmol dNTP Mixture 最优量为3 μL。
3.1.3 Mg2+优化结果
凝胶电泳实验结果表示加入10× Reaction Buffer(含20 mmol MgSO4)的最优量为5 μL。
3.1.4 引物优化结果
凝胶电泳实验结果显示,分别为1 μL 引物时结果较好。
3.1.5 退火温度优化结果
凝胶电泳结果显示,退火温度取57 ℃与58 ℃间为最优结果。
3.2 灵敏性检测
灵敏性检测结果表明,多重PCR 方法对产肠毒素大肠杆菌和沙门氏菌的最低检测限度分别为1.53 ng 和0.153 ng(图6)。
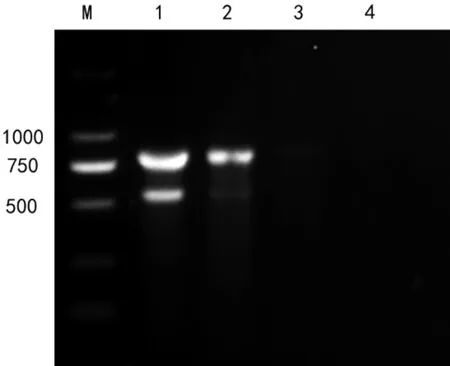
图6 灵敏性检测

图7 特异性检测
3.3 特异性检测
特异性检测结果显示,只有产肠毒素大肠杆菌和沙门氏菌DNA 模板有明显的扩增条带,其他细菌模板均无条带显示。
3.4 样品检测
在养殖场采集到的59 份粪便样品中,检测到13 份产肠毒素大肠杆菌阳性,阳性率为22.0%;7份沙门氏菌阳性,阳性率为11.8%,7 份同时表现沙门氏菌和产肠毒素大肠杆菌阳性。

表2 样品检测统计
4 讨论
禽大肠杆菌病和沙门菌病不仅是危害养禽业的重要细菌病,给养禽业造成了重大困扰和经济损失,还是重要的食源性病原,可感染人类致病甚至引起死亡。因此,建立快速准确的检测方法,对养殖业及公共卫生具有重要意义。
传统的细菌鉴定方法需要经过分离培养、生化试验和血清凝集试验或通用引物扩增测序等方式,操作繁杂、费用昂贵,不能满足养殖场生产实际的检测需求。常规PCR 检测方法具有灵敏度高,特异性好等特征,但一个体系只能扩增同一个靶片段,影响检测效率。采用多重PCR 进行检测,该方法具有高效快速、经济简便等优点,可以大大缩短常规PCR 的检测时间。
本研究选择沙门氏菌高度保守的特异性基因invA[14]和产肠毒素大肠杆菌致病性毒力基因hlyE基因[12,15]作为靶标进行引物设计。多重PCR 影响因素复杂,除引物和模板外,dNTP、Mg2+、酶浓度同样会产生复杂的影响[10],因此,对反应体系和反应条件进行优化,以优化后的方法对目的菌株和非目的菌株进行扩增,仅目的菌株存在目的片段,重复性实验结果相同,证明本反应体系稳定,引物特异性良好。
此方法对产肠毒素大肠杆菌和沙门氏菌的检测灵敏度可以达到1.53 ng 和0.153 ng,与相关研究中10 pg~1 ng 范围重叠[3,10,13,16],与魏娟文[13]等对大肠杆菌的检测最低1 ng 结果相符,与梁华[16]等建立的多重PCR 方法100 pg 检测结果相同,优于刘东海[3]等对沙门氏菌检测最低0.5 ng 灵敏度。
在部分完成种源净化的养殖场中,由于沙门氏菌的水平传播能力强,仍会出现沙门氏菌的感染,而因应激、环境不适、继发感染等因素导致的致病性大肠杆菌感染同样常见。因此,及时快速地对环境、食水、养殖人员、腹泻鸡粪便进行检测与隔离病鸡,可以有效地阻止两种病菌的水平传播,保护健康鸡不被传染从而减少养殖户的损失。□
