环状RNA FN1 在食管癌组织中的表达及预后预测价值
2024-01-12韩晓锐陈小芳
韩晓锐 陈小芳
食管癌是常见的恶性肿瘤,其特点是病死率较高,患者预后较差,5年生存率低于25%[1]。食管癌的常规治疗包括手术、化学治疗和放射治疗,尽管目前食管癌的诊断和治疗已取得较大进展,但患者的预后仍不理想[2]。因此,寻找食管癌的潜在生物靶点从而开发靶向治疗方案具有重要意义。
环状RNA(circRNA)为内源性非编码RNA,其可在真核细胞中表达;circRNA 的特点是具有闭环结构,不易被RNA 酶降解[3]。研究表明,circRNA 通过miRNA 或与RNA 结合蛋白相互作用参与调节蛋白质的表达[4]。在肿瘤组织和细胞系中,circRNA 异常表达可调控肿瘤细胞的恶性表型。circRNA 纤维连接蛋白1(FN1)是来源于FN1 基因的外显子,circRNA FN1(下文简称FN1)是一种高度保守且在恶性肿瘤中呈高表达的circRNA。Song 等[5]的研究发现,FN1 在人食管癌组织中呈高表达,表明其具有致癌作用。胃肠道平滑肌瘤多发生于食管、胃和结肠,Panagopoulos 等[6]采用RNA 测序技术进行检测,发现食管平滑肌瘤组织中FN1 表达水平显著升高,这提示FN1 是胃肠道平滑肌瘤的潜在生物靶点。本研究分析了食管癌组织及癌旁组织中FN1 的表达水平,并探究了食管癌组织中FN1 表达水平对患者预后的预测价值,以期为食管癌的诊断及治疗提供参考依据。
1 研究对象与方法
1.1 研究对象
选择2015年1月至2017年1月在西安国际医学中心医院和西安高新医院接受食管癌切除术的115 例食管癌患者作为研究对象,其中男性65 例,女性50 例,年龄52~78 岁,平均年龄为(65.39±10.22)岁。纳入标准:(1)患者的诊断符合《食管癌规范化诊治指南》[7]中的诊断标准,并经病理组织学确诊为食管癌;(2)临床资料完整;(3)患者为首次确诊食管癌且未接受放射治疗和化学治疗。排除标准:(1)合并其他恶性肿瘤;(2)术后曾接受治疗;(3)随访资料不完整。所有患者及家属均签署知情同意书,本研究经医院医学伦理委员会批准。
1.2 FN1 的表达水平检测
收集115 例患者手术切除的食管癌组织及癌旁组织(距肿瘤边缘≥2 cm)。使用TRIzol 试剂(购自美国Invitrogen 公司)提取总RNA,使用Nanodrop 2000 型分光光度计检测总RNA 的浓度和纯度。使用cDNA 反转录试剂盒(购自美国Roche公司)将总RNA 反转录为cDNA。采用实时荧光定量PCR 法检测FN1 的表达水平 (CFX96 型PCR 仪,购自美国Bio-Rad 公司)。PCR 反应条件:95 ℃预变性5 min;之后95 ℃变性20 s,60 ℃下退火1 min,72 ℃延伸30 s,共计45 个循环。以U6 为内参,采用2-ΔΔCt法计算FN1 的相对表达量。引物序列见表1。
表1 引物序列
1.3 随访
采用电话询问或门诊复查的方式对入组患者进行为期60 个月的随访,每3 个月随访1~2 次,随访截至2022年1月31 日,或以患者死亡为随访终点。
1.4 统计学分析
应用SPSS 23.0 软件进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较采用t检验。计数资料以例(%)表示,组间比较采用χ2检验。采用Kaplan-Meier 法分析FN1 的表达水平与食管癌患者总生存期的关系。采用Cox 回归模型分析影响食管癌患者预后的危险因素。P<0.05 表示差异有统计学意义。
2 结果
2.1 食管癌组织和癌旁组织中FN1 的表达水平比较
实时荧光定量PCR 法检测结果显示,食管癌组织中FN1 的相对表达量为2.88±0.63,显著高于癌旁组织(1.02±0.02),差异有统计学意义(t=11.293,P=0.001)。
2.2 食管癌组织中FN1 的表达水平与患者临床病理特征的关系
以食管癌组织中FN1 相对表达量的中位数将患者分为FN1 高表达组(≥1.78,63 例)和FN1 低表达组(<1.78,52 例)。分析结果显示,FN1 高表达组与FN1 低表达组的性别、年龄、肿瘤浸润深度差异均无统计学意义(P均>0.05),2 组的淋巴结转移、肿瘤直径、临床分期差异均有统计学意义(P均<0.05)。见表2。
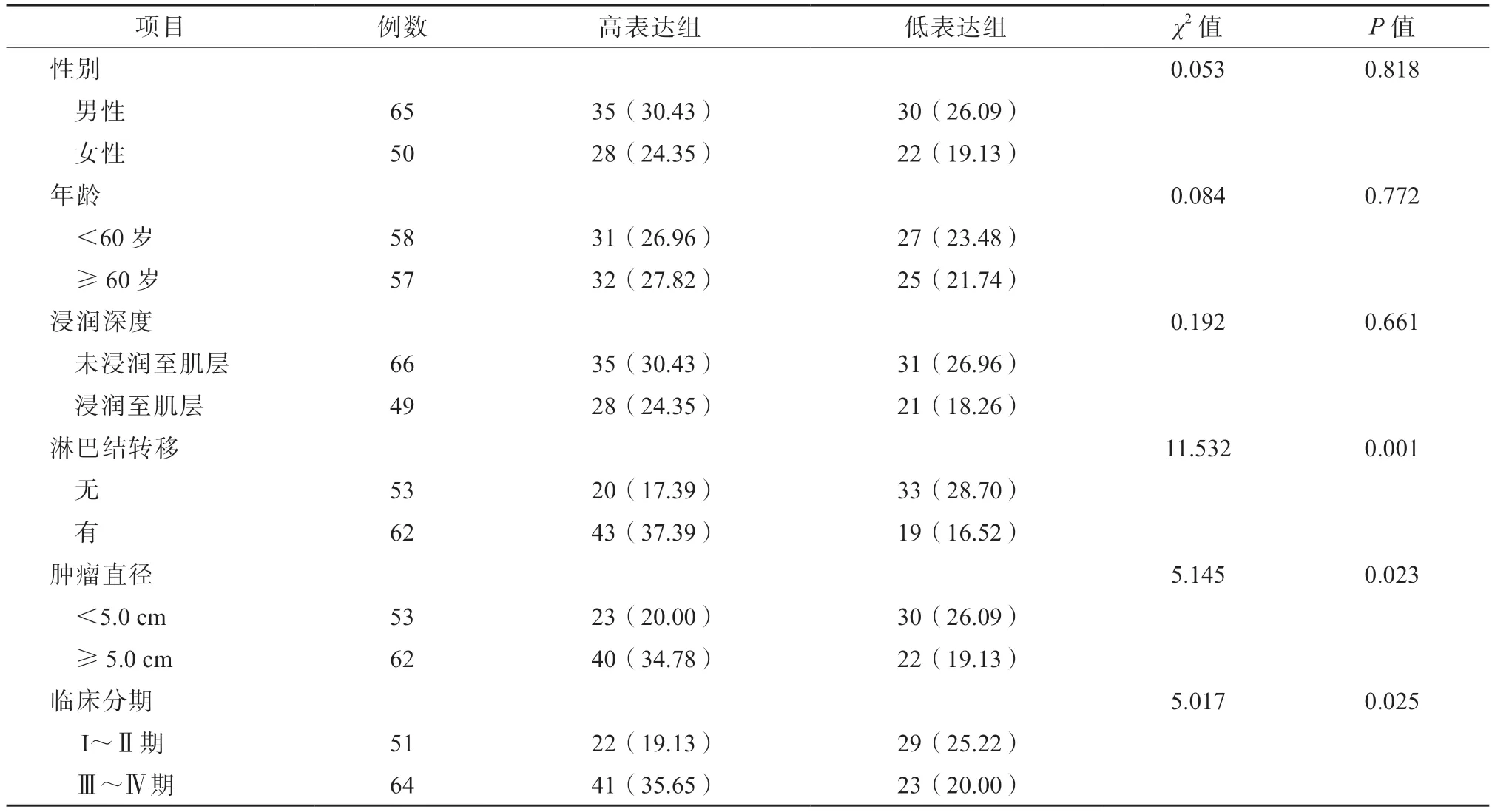
表2 食管癌组织中FN1 的表达水平与患者临床病理特征的关系/例(%)
2.3 食管癌组织中FN1 的表达水平与患者预后的关系
随访结果显示,FN1 高表达组死亡17 例,累积生存率为73.02%;FN1 低表达组死亡2 例,累积生存率为96.15%,FN1 高表达组的累积生存率显著低于FN1 低表达组,差异有统计学意义(P=0.047)。见图1。
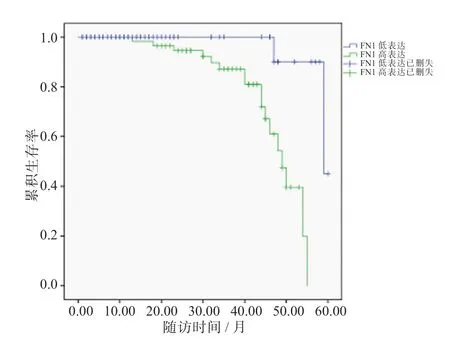
图1 食管癌组织中FN1 的表达水平与患者预后的关系
2.4 影响食管癌患者预后的单因素分析
单因素Cox 回归模型分析结果显示,食管癌患者的预后与淋巴结转移、肿瘤直径、临床分期及食管癌组织中FN1 的表达水平均有相关性(P均<0.05)。见表3。
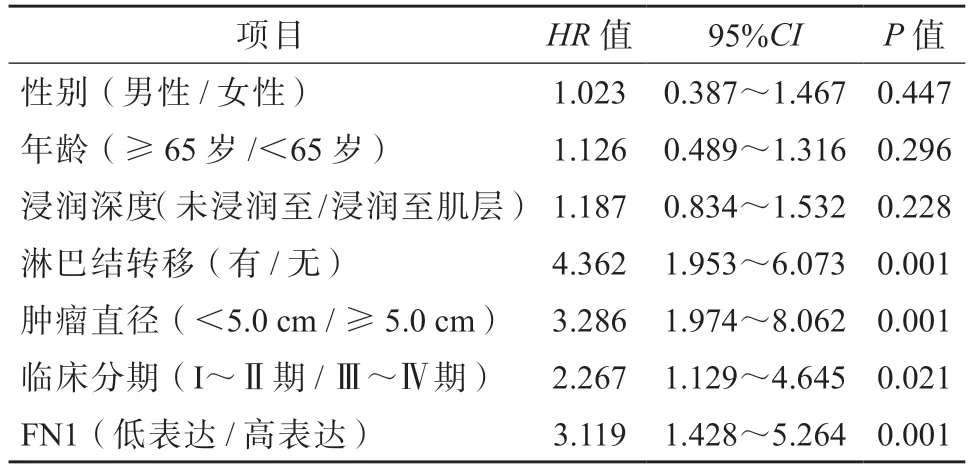
表3 影响食管癌患者预后的单因素分析
2.5 影响食管癌患者预后的多因素分析
多因素Cox 回归模型分析结果显示,淋巴结转移、临床分期及食管癌组织中FN1 的表达水平均为食管癌患者预后的独立危险因素(P均<0.05)。见表4。

表4 影响食管癌患者预后的多因素分析
3 讨论
食管癌的发病率和病死率均较高,其治疗虽已取得了一定的进展,但疗效仍不理想,因此寻找食管癌的生物标志物对其诊疗及预后预测具有重要意义。circRNA 是由mRNA 反向剪接而产生的共价闭合环,在肿瘤的发生和进展中起着重要的调节作用,可能可以作为恶性肿瘤诊断和预后预测的生物标志物[8]。研究表明,FN1 参与了食管鳞状细胞癌(以下简称为食管鳞癌)的发生和进展,食管鳞癌组织和细胞中FN1 的表达水平均显著升高[9],这与本研究结果一致。本研究结果显示,食管癌组织中FN1 的相对表达量为2.88±0.63,显著高于癌旁组织(1.02±0.02),差异有统计学意义(t=11.293,P=0.001)。FN1 高表达组与FN1 低表达组的性别、年龄、肿瘤浸润深度差异均无统计学意义(P均>0.05),2 组的淋巴结转移、肿瘤直径、临床分期差异均有统计学意义(P均<0.05)。
随着高通量测序技术的发展,circRNA 在生物学领域的应用逐渐受到关注。circRNA 在人体体液(包括血液、唾液、组织液)及组织中呈高表达,是食管癌潜在的生物标志物[10]。研究发现,裸鼠食管癌组织中circRNA B 细胞特异性莫洛尼鼠白血病病毒整合位点1(BMI1)的表达水平显著升高,提示其可促进移植瘤进展[11]。Niu 等[12]的研究表明,circRNA 可以调控食管癌的发生和进展,对该病的诊断具有重要意义。circRNA 溶血磷脂酸受体3(LPAR3)可以通过促进食管癌细胞的侵袭和迁移,从而促进食管癌进展[13]。研究表明,circRNA 转录因子样5(TCFL5)在食管癌中的表达水平显著升高,并且circRNA TCFL5 可通过miR-543/形成素同源蛋白2(FMNL2)信号通路调控M2 巨噬细胞的极化,促进食管癌进展,提示其可能是食管癌的治疗靶点[14]。
研究表明,FN1 参与了细胞增殖过程中的细胞黏附和迁移,与肿瘤细胞迁移和侵袭密切相关,其参与了甲状腺癌、肾癌、鼻咽癌及食管癌的进展[14]。Cai 等[15]的研究发现,FN1 过表达可促进食管鳞癌的进展,而潜在转化生长因子β 结合蛋白1 (LTBP1)表达下调则可抑制FN1 表达,从而抑制食管鳞癌发生淋巴结转移;此外,FN1 还可抑制肿瘤细胞的恶性生物学行为,调控上皮间充质转化进程,这提示FN1 可能是食管鳞癌患者的潜在治疗靶点。Li等[16]的研究结果显示,分泌性磷蛋白1(SPP1)和FN1 与食管癌患者的总生存率均呈正相关,并且可能可以预测食管癌复发,该研究表明SPP1 和FN1可能可以作为预测食管癌进展和预后的生物标志物。FN1 可促进食管鳞癌细胞的增殖、迁移和侵袭,其高表达与患者的预后不良有关[17]。研究表明,miR-1 可通过调控FN1 抑制食管鳞癌细胞的增殖和侵袭,并促进食管鳞癌细胞凋亡,miR-1/FN1 信号通路可能是食管鳞癌潜在的治疗靶点[18]。食管鳞癌组织中FN1 的高表达与患者的预后不良密切相关,FN1 高表达可促进食管鳞癌细胞发生形态学改变和迁移,从而促进肿瘤转移[19],这与本研究结果一致。本研究结果表明,FN1 高表达组的累积生存率显著低于FN1 低表达组。多因素Cox 回归模型分析结果显示,淋巴结转移、临床分期及食管癌组织中FN1 表达水平均为食管癌患者预后的独立危险因素。
综上所述,食管癌组织中FN1 表达上调,其为食管癌患者预后的独立危险因素,可作为预测患者预后的生物标志物和潜在治疗靶点。本研究存在一些不足之处:其一,本研究的样本量较小,今后应扩大样本量,进一步验证本文结论;其二,本研究未阐明FN1 在食管癌进展中的调控机制,今后应在本研究基础上进一步探究其作用机制。
