高效杀菌装置降低发热诊室感染概率研究
2024-01-11陈奕纯丁云飞文坤波
陈奕纯,丁云飞,文坤波
(1.广州大学土木工程学院,广东广州,510006;2.中建三局集团华南有限公司)
0 前言
自2019年末以来,新型冠状病毒大规模传播对全球的公共卫生体系提出了挑战。相关研究表明,病毒可以通过空气传播,具有传染性的飞沫核长时间悬浮在空气中,可以远距离传播[1]。一些研究人员认为,空调系统在空气传播中起着不可忽视的作用[2-4]。Nissen等人[3]在新冠肺炎疫情期间对某医院病房通风口和排风管道末端的高效过滤器表面进行采样分析,检测到了SARSCoV-2病毒的基因。传统的空调系统没有过滤和杀死病毒的能力,并且室内回风还可能导致病毒继续在室内扩散传播,从而增加感染风险。增加通风率可以有效降低密闭空间的感染概率[5,6]。但是已建成在用的空调系统难以提供额外的新风来稀释室内的污染物,而且新风量的增加也会导致更高的能源消耗[7]。
除了增加新风量,过滤也是降低室内污染物浓度常用的方法[8]。高效过滤器已被证明能够有效过滤微生物气溶胶[9,10],理论上能够拦截99.97 % 的颗粒物(直径≥0.3μm),ASHRAE也推荐使用高效过滤器来减少SARS-CoV-2的气溶胶传播[11]。Pease等人[12]研究了病毒在使用同一空气处理机组的多个房间内传播的风险,发现过滤器等级越高,室内感染概率越低。Li等人[13]在健身中心的中央空调系统中使用HEPA过滤器处理回风,发现感染概率可以从13.7 %(无过滤器)降低到1.81 %。但Price等[14]发现在医院通风空调系统中,过滤器并不能从根本上杀灭微生物,甚至可能为细菌的繁殖提供良好的生存环境,带来了较大的健康隐患。
一定波长的紫外线会破坏微生物的DNA或RNA的分子结构,使其失活或无法繁殖,达到消毒杀菌的目的[15]。一些研究也表明,紫外线杀菌照射能够有效降低麻疹病毒和SARS-CoV-2病毒的传播风险[16,17]。许多研究建议将紫外线与过滤器结合起来以减轻室内交叉感染[18]。
然而,现有研究大多是将过滤器和紫外线两者串联使用,测试其应用效果,少有针对过滤器截留微生物后,微生物可能在其表面继续繁殖问题。本研究利用紫外线和过滤器构建了高效杀菌装置,紫外线的作用主要在于杀灭高效过滤器表面截留的微生物,并通过实验来验证紫外线对过滤器表面微生物的杀灭效果。将高效杀菌装置应用于医院发热诊室空调系统回风口处,评估其控制室内病毒气溶胶浓度的效果。
1 研究方法
首先利用高效过滤器和紫外线灯构建了高效杀菌装置,通过全尺寸通风管道测试了高效杀菌装置的杀菌效率。将高效杀菌装置安装于风机盘管回风口处,通过CFD模拟,预测患者呼出污染物在发热诊室内的分布,并将模拟结果与改进的Wells-Riley方程结合起来,评估了高效杀菌装置对降低室内人员感染概率的影响。
1.1 高效杀菌装置性能
高效杀菌装置是由紫外线灯(波长253.7 nm)和高效过滤器(H12,额定风量300 m3/h)构成,紫外线灯位于高效过滤器迎风面前50 mm,主要用于杀灭过滤器表面的微生物。根据中国国家标准《通风系统用空气净化装置》(GB/T 34012-2017),建立了管道空气消毒测试系统,如图1所示,研究了高效杀菌装置的杀菌效率以及紫外线灯对过滤器迎风面上截留细菌的杀灭效果。采用金黄色葡萄球菌为实验菌种[19],制备了细菌悬液,利用气溶胶发生器往装置内连续喷射细菌悬液,空气微生物采样器分别在上、下游采样口采样,以获得高效杀菌装置上、下游的细菌浓度。

图1 实验装置示意图
本研究设置了3组实验工况,如表1所示。根据标准《通风系统用空气净化装置》,细菌在实验装置内的自然消亡率和微生物气溶胶的净化效率分别按式(1)和(2)计算。

表1 实验工况
实验时管道空气温度26±1 ℃,相对湿度60±5 %,图2为实验结果,可以看到,实验菌在装置内的自然消亡率为30.38 %;高效过滤器对实验菌的过滤效率为98.33 %,同时也发现过滤器迎风面上仍有细菌存活,经过紫外线灯照射对过滤器表面照射可以有效杀灭过滤器上的细菌。当高效过滤器与紫外线灯同时使用时,对细菌的杀灭率高达99.71 %,并且在迎风面上没有发现存活的细菌。

图2 不同实验工况下细菌的去除效率
1.2 发热诊室通风系统模型
如图3(a),发热诊室长4.6 m,宽3.9 m,高2.7 m,采用风机盘管空调系统,将高效杀菌装置安装于风机盘管回风口处,处理后的回风与室外新风混合后送入室内,如图3(b)。采用百叶风口侧送风,风口尺寸为450 mm×120 mm,回风口尺寸为450 mm×20 mm,另设排风口,位于天花板上,尺寸为150 mm×150 mm。医生佩戴N95口罩,患者未佩戴口罩。边界条件设置如表2所示。

表2 边界条件设置

图3 配备风机盘管系统的发热诊室布局
研究发现,粒径小于5 μm的飞沫核是病毒的主要载体,更容易造成空气传播[21],因此本研究重点关注粒径小于5 μm的飞沫核,采用欧拉法来预测室内污染物分布。许多研究已经证明了CO2是模拟细小液滴或飞沫核扩散的有效替代物[22,23],因此以CO2作为示踪气体模拟患者呼出的污染物。本研究考虑了患者两种呼吸活动——正常呼吸和咳嗽,呼出的CO2浓度均为40,000 ppm[23],并假设患者口部是CO2的唯一来源,患者口部大小为20 mm×20 mm[24],呼吸过程被简化成连续的呼气[23],肺通气率为8.4 L/min[25]。咳嗽过程简化为周期为15 s的脉冲函数,咳嗽时间为1 s,速度为10 m/s[26],在Fluent软件中借助UDF实现,如图4所示。

图4 患者咳嗽时的UDF函数
通过医院挂号系统调查了广州市17所医院发热门诊的挂号情况,图5为患者在17所医院发热诊室最短和最长的就诊时间,患者在发热诊室内的平均就诊时间为4~6 min。
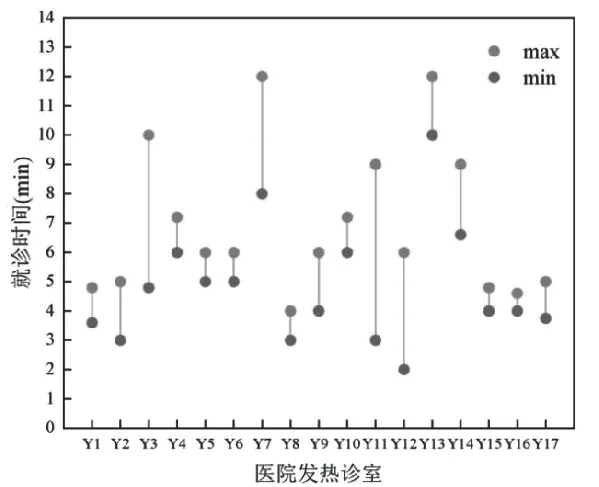
图5 广州市17所发热诊室最短和最长的就诊时间
假设有一名呼吸道传染病患者前来就诊,就诊时间为6 min,即释放污染物的持续时间为6 min,后续就诊人员不是呼吸道传染病患者。如表3所示,本研究模拟了6种不同工况,以探究高效杀菌装置对降低医生和后续就诊人员感染概率的效果。

表3 工况条件设置
采用Fluent进行仿真模拟,采用雷诺平均纳维斯托克斯(RANS)方程和湍流模型来获得诊室内的气流速度、温度以及污染物浓度[23]。近壁面采用标准壁面函数。
1.3 实验验证
为了验证本研究使用的仿真模型,搭建了一个全尺寸实验室,如图6所示。两个人体模型均匀缠绕着电发热丝以模拟人员发热量,以发热的电热膜代替夏季外窗得热。在室内设置了4条垂直测量线,当室内流场稳定时,测量了室内的温度及风速,并与模拟结果比较,如图7a和7b所示,速度、温度的平均偏差分别是0.02 m/s,0.55 ℃。随后患者以5 ml/s的速度从口部释放出二氧化碳,6分钟后停止,采用二氧化碳检测仪连续测量了医生口鼻处的二氧化碳浓度值。如图7c所示,二氧化碳浓度的平均偏差为4.68 ppm。

图6 实验室布局图

图7 实验值与模拟值对比
1.4 评价指标
采用摄入分数IF来评估患者呼出的污染物对暴露人员的影响[27],IF 越大,代表污染物的浓度越高,暴露人员的相对感染风险越高。
其中Ci是暴露人员吸入的污染物浓度;Ce是患者呼出的污染物浓度。
Wells-Riley模型常用于定量评估空气传播的感染风险[28],但其假设空气混合均匀且稳定,存在一定的局限性,Wells-Riley模型如公式(5)所示。Zhang等人[29]定义了稀释比,提出了一种适用于瞬态条件的Wells-Riley模型。稀释比可以通过CFD模拟预测的污染物浓度来计算。
式中:P为感染概率,I为感染者数量,p1,p2分别为易感者和感染者的呼吸频率(m3/min),可以认为两者相等。q为感染者的量子生成速率(quanta/min),t是易感者暴露时间(min),Q是房间通风量(m3/min)。D(t)为某处位置的稀释率,Csource为感染者呼出的污染物浓度,Ctarget(t)为室内某位置的污染物浓度。
根据Zhang的研究[29],q取值为142 quanta/h。Fluent软件模拟计算可获得不同时刻室内的污染物浓度分布,再通过公式计算出不同暴露时间下室内的感染概率。
2 结果与讨论
2.1 速度和温度分布
图8是医生办公桌中间位置截面的稳态流场及温度场。从图中可以看出,经风机盘管处理后的空气通过射流直接进入医生和患者呼吸区。室内工作区的风速为0.2~0.3 m/s,温度在25~26 ℃之间,满足人体舒适要求。

图8 诊室办公桌中间位置截面速度和温度分布云图
2.2 不同区域呼吸区的污染物浓度分布
由于污染物在诊室内分布不均匀,对室内人员的影响也不一样,因此根据诊室人的活动特性,将房间分成4个区域,如图9所示,分别为入口区(Ⅰ)、过渡区(Ⅱ)、医生区(Ⅲ)、患者区(Ⅳ),分析污染物的分布特点。

图9 发热诊室区域划分
综合考虑人体坐姿和站姿时的高度,将人体呼吸区高度定义为1.1~1.6m。图10(a)和10(b)分别是患者正常呼吸和咳嗽状态下最大暴露量(6 min)时呼吸区下部(1.1 m)及上部(1.6 m)高度的污染物浓度分布云图。可以发现,患者正常呼吸时,污染物主要集中在患者头部上方(1.6 m处),医生所在的Ⅲ区污染物浓度较低,这主要是因为呼吸释放的污染物受到自身热浮力和患者热羽流的影响,往房间上部扩散;患者咳嗽状态下产生的高速气流使得污染物在水平方向迅速扩散,1.6 m平面的污染物浓度较低。
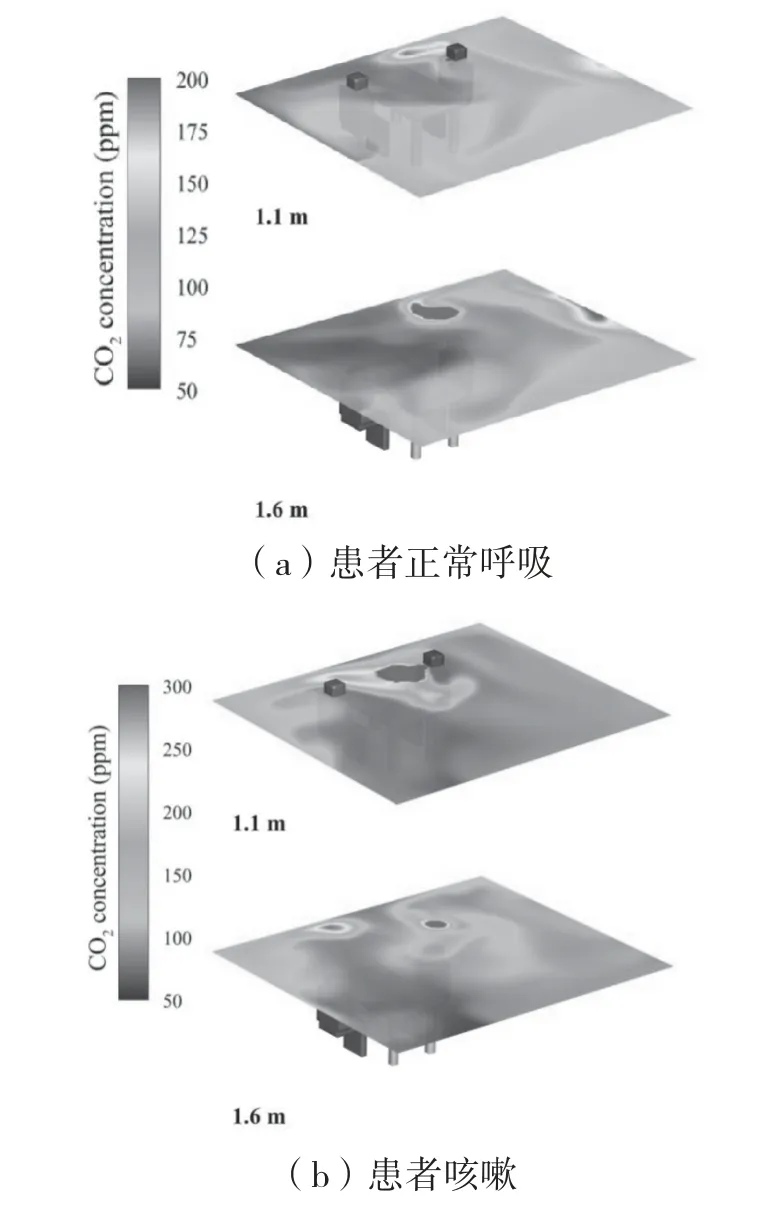
图10 诊室内呼吸区上部及下部污染物浓度分布
如图11,以呼吸区为研究对象,对比分析四个区域在最大暴露量(6 min)时的二氧化碳平均浓度,可以发现,在不同工况下,患者所在Ⅳ区的污染物浓度始终高于其他区域,患者正常呼吸产生的污染物较患者咳嗽时少。对于没有安装高效杀菌装置的情况,各区域的污染物浓度更高。患者呼吸时,回风经高效杀菌装置处理后,Ⅰ,Ⅱ,Ⅲ,Ⅳ区的污染物浓度分别降低了38 %,28.4 %,27.7 %,15.8 %;患者咳嗽时,Ⅰ,Ⅱ,Ⅲ,Ⅳ区的污染物浓度分别降低了11 %,15.2 %,3.8 %,6.5 %。

图11 各区域呼吸区CO2浓度对比
2.3 医生的摄入分数和感染风险
如图12(a)是医生的摄入分数随暴露时间变化的曲线。在患者进入诊室后的6 min内,医生的摄入分数快速增加,并在6 min后达到峰值;患者离开后,医生的摄入分数开始下降,对于回风口没有安装高效杀菌装置的情况,摄入分数下降的速度较慢,患者离开40 min后还没达到稳定;而安装高效杀菌装置的情况与全新风类似,在患者离开后,摄入分数快速下降,并在20 min后就达到较低水平,逐渐趋于稳定,稳定时的摄入分数比没有安装高效杀菌装置时小一个数量级。
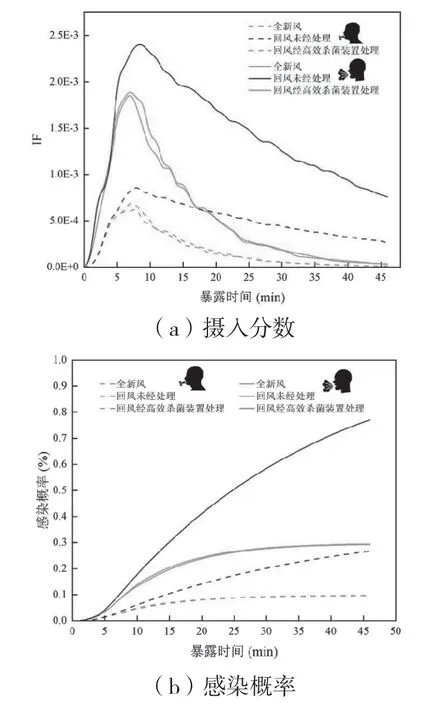
图12 医生的摄入分数和感染概率
图12(b)是医生在不同暴露时间下的感染概率,暴露时间越长,感染概率越大。对于没有安装杀菌装置的情况,在患者释放污染物的6 min里,医生的感染概率快速增加,40 min后还有明显的增长趋势,这说明没有经过高效杀菌装置处理的空调回风导致污染物在室内继续扩散,从而增加了医生的感染概率。全新风模式与安装高效杀菌装置时对医生感染概率的影响几乎相同,在患者释放污染物的6 min里,医生的感染概率快速增加,患者离开后,感染概率缓慢增加并逐渐稳定趋于定值。
从上述结果可以看出,安装高效杀菌装置对室内的净化效果与全新风送风模式接近一致,高效杀菌装置能够明显降低室内的污染物浓度,高效杀菌装置的运行时间越长,污染物浓度越低。高效杀菌装置运行40 min后,医生的感染概率分别从0.27 %,0.77 %降低至0.096 %,0.295 %。
2.4 下一位就诊人员的感染风险
患者周围的污染物浓度较高,将对后续就诊人员带来风险。因此假设下一位就诊人员不是呼吸道传染病患者,分析高效杀菌装置对下一位就诊人员感染风险的影响。
图13(a)表示患者离开后,下一位就诊人员的感染概率随暴露时间的变化。可以发现,患者正常呼吸对下一就诊人员感染概率的影响较小,感染概率随暴露时间线性增加,未安装高效杀菌装置的情况下感染概率增加更明显;患者咳嗽,下一位就诊人员在进入1分钟后感染概率快速增加,6分钟后,全新风系统、回风经高效杀菌装置处理以及回风未经处理的感染概率分别为4.6 %、4.7 %、5.8 %,这表明全新风与安装高效杀菌装置能够降低下一就诊人员的感染风险。

图13 下一位就诊人员的感染概率
图13(b)表示感染者离开后,下一就诊人员间隔一段时间后再进入室内,感染概率随等待时间的变化。从图可以发现,等待的时间越长,感染风险越低。对于安装高效杀菌装置的情况,下一就诊人员等待1分钟后,感染概率就低于2 %,因此我们建议就诊人员可在上一就诊人员离开后1-2分钟再进入室内,以降低感染风险。
4 结论
1.由高效过滤器和紫外线灯构成的高效杀菌装置对细菌的杀灭率高达99.71 %,并且能够有效防止细菌在过滤器上滋生繁殖。
2.通过CFD模拟发现,高效杀菌装置能够显著降低室内的污染物浓度,运行时间越长,污染物浓度越低。安装高效杀菌装置能够有效减少室内人员的感染概率,其效果与全新风空调系统接近。
3.高效杀菌装置能够有效降低下一就诊人员感染概率,下一就诊人员等待1分钟,感染概率就低于2 %,等待的时间越长,感染风险越低。
