Zn替代Ni对铸态Mg2 Ni0.75 Zn0.25合金腐蚀行为及放电性能的影响*
2024-01-10李嘉欣刘向东
海 山,李嘉欣,刘 畅,刘向东
(1.内蒙古工业大学材料科学与工程学院,呼和浩特 010051;2.内蒙古自治区高校材料加工与控制工程重点实验室,呼和浩特 010051)
随着空气污染和全球变暖的加剧,探索绿色环保的可再生能源变得尤为重要。近年来,研究者们围绕氢能的有效利用和储备方面做了大量的工作[1-5]。储氢合金电池作为储存氢能的载体,其通过电化学反应能够轻松地将氢能吸收和转变为电动汽车或便携式电子设备的能源。Mg2Ni储氢合金以原材料丰富、价格低廉、高能量密度等优点一直备受关注并作为镍氢电池负极研究[6-8]。然而Mg2Ni储氢合金的充放电动力学非常缓慢,其实际的放电容量与理论容量相差甚远。而且在电化学反应过程中Mg2Ni合金很容易被碱性电解质腐蚀和氧化,短时间内其表面会被Mg(OH)2钝化层所覆盖,阻碍与电解质的接触和氢原子进一步穿透。随着合金电极充放电循环进行,Mg2Ni合金表面的活性物质将变得越来越少,电荷转移和氢原子的扩散变得越来越困难[9-11]。
采用新的制备工艺[12-17]、表面修饰[18]或元素置换替代[19-20]等方式来改变合金的微观结构是改善Mg2Ni合金电极循环寿命和放电性能常用的方法,尤其是以其他金属元素替代Mg或Ni原子对电化学性能的提升有显著效果。在一些研究中,人们把重点放在降低合金表面的腐蚀程度或破坏钝化层的连续性的问题上。Mustafa[20]以Al原子部分替代Mg原子制备Mg1.5Al0.5Ni合金,他们认为在电化学反应过程中形成的Al2O3能够迅速溶解使得Mg(OH)2钝化层多孔化,表露出了更多有电催化活性的Ni,使合金电极的容量保持率有了明显的提升。Shao等[8]以Cu替代Ni制备Mg2Ni0.75Cu0.25合金,发现Mg周围的Cu可以保护Mg不被氧化而形成Mg(OH)2,Zhang等[19]人的研究也得到了类似的结论。Nilüfer等[21]的研究提出,Mg Ti Mn Ni合金中掺杂的Zr在电化学过程中溶解可降低Mg(OH)2层的稳定性,对合金电极放电容量的提升有积极贡献。综上所述,利用易溶解的金属元素对Mg2Ni合金表面的修饰可作为降低Mg(OH)2层稳定性和提高氢原子扩散动力学的方法。
我们之前的研究选择过渡金属Zn部分替代Ni原子熔炼制备了铸态Mg2Ni1-xZnx合金,其中Mg2Ni0.75Zn0.25合金电极具有最佳的放电容量[22]。本研究进一步分析Zn替代对Mg2Ni0.75Zn0.25合金表面腐蚀行为的影响,以X 射线衍射(XRD)、扫描电镜(SEM)、高分辨透射电子显微镜(HRTEM)观察分析电化学反应前后的合金物相和微观组织的变化,探讨Zn的溶解对合金电极放电性能的影响机制。
1 实验方法
1.1 铸态合金的制备及合金电极的电化学测量
铸态Mg2Ni和Mg2Ni0.75Zn0.25合金采用真空感应炉在0.04 MPa气压和1500℃以上炉温环境下熔炼制备[22]。随后,将获得的铸态合金机械粉碎成粉末与导电剂镍粉充分混合后用769YP-24B压片机压制成圆形电极片[22]。合金电极的电化学性能测试和合金的表面腐蚀通过武汉金诺生产的LAND CT2001A 电池测试仪进行。充放电制度为:首先以100 m A/g电流密度充电300 min,然后静置5 min,等电极电位稳定后再以60 m A/g 电流密度放电,放电截止电位为—0.6 V(vs.—Hg/Hg O),电极放电结束后再静置5 min,以此循环重复上述充放电过程[22]。
1.2 微观组织测试
使用PW1830型X 射线衍射仪(Philips,Netherlands)测定所制备材料的相组织,测试条件:Cu靶Kα射线(λ=0.15406 nm),扫描速率为1°/min,扫描范围为10°~60°。将测试数据使用High Score软件分析获取合金的相组成。使用日立冷场扫描电子显微镜(SEM,SU8010)系统观测电化学反应前和多次电化学循环后的铸态合金的表面形貌。采用Talos F200X 高分辨率透射电子显微镜(HRTEM)对10次充放电循环后的合金形态和产物进行分析。通过聚焦电子束(Focused ion beam,FIB)从合金表面采取合金薄片,用于HRTEM 观测。
2 结果与讨论
2.1 微观结构
图1是铸态Mg2Ni和Mg2Ni0.75Zn0.25合金的X 射线衍射图谱,Mg2Ni合金衍射图谱由尖锐的Mg2Ni相特征衍射峰(主相)和微弱的Mg Ni2相(第二相)特征衍射峰组成。以Zn元素部分替代Ni后,XRD 图谱中的Mg Ni2特征峰几乎全部消失,且在38.55°位置出现了MgZn衍射特征峰,40.25°、41.43°位置出现了MgZn2相的衍射特征峰,38.97°位置出现了Zn的衍射峰。Mg2Ni和Mg2Ni0.75Zn0.25合金经过10次充放电循环之后的XRD 图谱由红色线条标注。与充放电循环之前的衍射图不同的是经过10次充放电循环后主要衍射峰的强度明显降低,在18.50°、37.93°和50.86°位置出现了Mg(OH)2相的衍射特征峰,表明电化学反应后Mg2Ni合金中产生了腐蚀物。更值得注意的是,Mg2Ni0.75Zn0.25合金经电化学反应后38.99°位置的Zn的衍射峰削弱;40.25°位置的MgZn2相的衍射峰消失,这揭示了在电化学过程中Zn和其析出物已溶解。
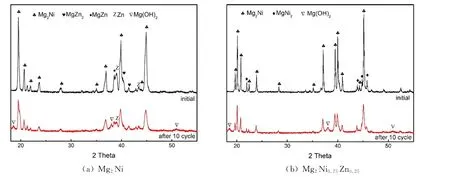
图1 合金样品经过10次充放电循环前后的XRD 图谱[22]Fig.1 XRD patterns of as-cast alloy samples before and after 10 charge/discharge cycles[22]
镁基合金作为负电极材料在电化学反应中失去电子形成难以溶解的Mg(OH)2并附着在合金表面阻碍合金与碱性溶液接触,成为了导致电化学反应很难进行的主要原因。为了验证Zn元素替代对电化学过程中合金表面特性的影响,观察了铸态Mg2Ni和Mg2Ni0.75Zn0.25合金经过不同充放电循环后的微观形貌。
铸态合金在电化学循环反应之前和经过5、10、20次充放电循环后的表面微观形貌图见图2。铸态Mg2Ni合金的晶界由浅灰色衬度的细小Mg2Ni晶粒和黑色衬度的自由态Mg组成。对比不同充放电循环后的合金表面的微观形貌发现,电化学循环过程对Mg2Ni合金微观形貌的影响微乎其微,经过多次充放电循环后合金晶界处的细小的主相晶粒和Mg(OH)2腐蚀物(由自由态Mg腐蚀而成)依然完好无损,未出现因电化学腐蚀而形成的孔洞或脱落现象。

图2 铸态Mg2 Ni合金的微观形貌图Fig.2 The microstructure of as-cast Mg2 Ni alloys
铸态Mg2Ni0.75Zn0.25合金在电化学反应前和经过5、10、20次充放电循环后的微观形貌图见图3。电化学反应前,合金晶界处的共晶区域由细小的Mg2Ni主相区(灰色区域)、Zn析出区域(亮色区域)和自由态Mg单相区混合而成。与铸态Mg2Ni合金不同的是,随着循环次数的增加,Mg2Ni0.75Zn0.25合金晶界处共晶区的微观形貌发生了很大的变化,在电化学充放电过程中共晶区域明显被腐蚀和破坏。尤其是Zn析出区域随着循环次数的增多,出现了溶解和脱落的现象,形成了许多腐蚀坑。这得益于,合金晶界处的锌析出物在强碱性溶液中失去电子产生吸氧反应形成了可溶解在电解质中的锌酸盐离子[Zn(OH)4]2+。随循环次数的增多合金晶界处逐渐被腐蚀,且腐蚀首先发生在Zn析出物的表面,如在循环次数为5的合金Zn析出区域表面形成了明显的腐蚀凹槽(黄色箭头指出)。当循环次数达到10次时,合金晶界处的大部分细小的Zn析出物溶解和脱落,其周围的细小的Mg2Ni晶粒和Mg(OH)2腐蚀物也随之脱落,晶界处出现了更多的孔洞和凹槽。在晶界处不易溶解的Mg(OH)2的脱落将大幅增多Mg2Ni合金的新鲜表面,有利于电化学反应的进行和氢原子穿透合金表面。当充放电循环达到20次时,较大晶粒的MgZn2晶界上也出现了更深的腐蚀凹槽。但是相对于在晶界处形成的细小的Zn析出物,较大晶粒的MgZn2在电化学过程中的溶解速率较为缓慢,而且其紧密地附着在Mg2Ni表面,因此一定程度上阻碍了Mg2Ni表面与电解液之间的充分接触。
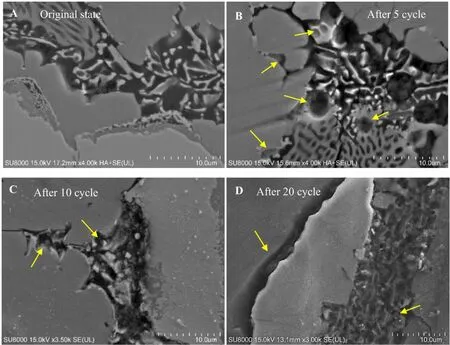
图3 铸态Mg2 Ni0.75 Zn0.25合金的微观形貌图Fig.3 The microstructure of as-cast Mg2 Ni0.75 Zn0.25 alloys
为了进一步观察Zn 的溶解对合金表面特性的影响,采用FIB 技术从10 次充放电循环后的Mg2Ni和Mg2Ni0.75Zn0.25合金晶界处裁取了一小块合金薄片,用于从横截面观测合金的腐蚀形貌,如图4。电化学循环后的铸态Mg2Ni合金晶界处细小的Mg2Ni晶粒和Mg(OH)2腐蚀物并没有出现裂痕和脱落的现象。与Mg2Ni合金不同的是,铸态Mg2Ni0.75Zn0.25合金电化学反应后其晶界处出现了很多腐蚀裂纹(与SEM 观测到的结果一致)。因此可以推断在电化学过程中Zn析出物的溶解和开裂对合金晶界处细小晶粒和Mg(OH)2腐蚀物的脱落发挥了主要作用。

图4 经过10次充放电循环后铸态合金表面上的FIB裁剪位置和其横截面的微观形貌图Fig.4 The FIB cutting position on the surface of the as-cast alloy after 10 charge/discharge cycles and the micrographs of its cross-section
图5是铸态Mg2Ni合金经过10次充放电循环后其横截面的微观形貌图、EDS mapping元素分布图和腐蚀界面的EDS线扫描结果图。Mg2Ni合金经电化学反应后表面形成了大于50 nm 的腐蚀层。由EDS mapping原子分布图可见,合金晶粒表面的腐蚀层和合金晶界处出现了大量的O 原子。为了进一步分析Mg2Ni合金表面的腐蚀程度,在其法线的方向测试了合金各个组元原子的含量变化,EDS线扫描结果如图5-F~G 所示。O 原子的含量的变化能够反映合金各区域在电化学反应过程中的腐蚀氧化的程度。在合金内部O 原子的含量很低,但是在合金表面处的含量明显增加,而且Mg和Ni原子的含量也有了不同程度的减少(Scanline 1)。可见,在电化学反应过程中合金表面被腐蚀、Mg2Ni被分解,并且形成了一层覆盖在合金晶粒表面的腐蚀氧化层。合金表面处由Mg和O 原子所主导,说明形成了Mg-O 腐蚀物。在合金晶界处的线扫结果表明(Scanline 2),晶界处的自由态的Mg也被氧化腐蚀,形成了较厚的腐蚀氧化物。
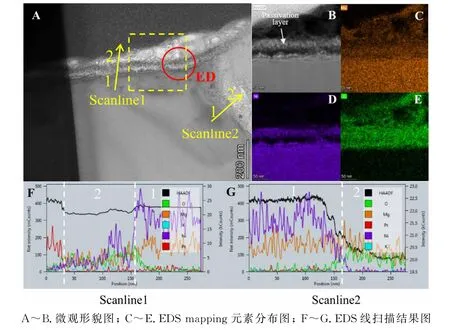
图5 铸态Mg2 Ni合金经过10次循环后晶界处横截面的TEM 微观形貌图Fig.5 The TEM micrographs of Mg2 Ni as-cast alloy after 10 cycles
图6是铸态Mg2Ni0.75Zn0.25合金经过10次充放电循环后其横截面的微观形貌图、EDS mapping元素分布图和腐蚀界面的EDS线扫描结果图。微观形貌图中包含了Mg2Ni和MgZn2相晶粒。对比Mg2Ni和MgZn2晶粒界面的腐蚀程度可见,MgZn2晶粒表面的腐蚀更为严重。此外,Mg2Ni相中Zn原子也一定程度上促进了合金晶粒的腐蚀,微观形貌观测中发现腐蚀向合金晶粒内部渗透的现象(红色箭头指出)。由Mg2Ni和MgZn2晶粒腐蚀界面的元素分布情况可见,经过10次充放电循环后Zn元素几乎完全溶解,然而Mg、Ni和O 原子大量存在其中。表明Zn元素的添加促进了合金表面的腐蚀,尤其是Zn析出物溶解在电解质中,使得合金表面形成的钝化层变得多孔和松散,有利于电解质与合金新鲜表面的接触;另一方面,Zn的溶解使得合金中出现许多腐蚀裂纹,增加了合金的活性表面。此外,随着合金表面处Zn原子的溶解,具有催化活性的Ni原子不断的被表露出来,这对电化学反应的进行发挥积极作用[20]。

图6 铸态Mg2 Ni0.75 Zn0.25合金经过10次循环后晶界处断面的TEM 微观形貌图Fig.6 The TEM micrographs of Mg2 Ni0.75 Zn0.25 as-cast alloy after 10 cycles
2.2 腐蚀产物分析
图7(a)是铸态Mg2Ni合金腐蚀界面处的电子衍射图(ED)。ED 衍射图由规则排列的Mg2Ni相和多晶花样衍射环组成。电子花样衍射环半径的倒数表征了对应晶面的晶面间距。采用Digital Micrograph软件ED tools插件得到了各个衍射环的强度分布曲线,并对比PDF标准卡片得到了相应衍射峰对应的相组织。分析结果再次证明了腐蚀界面处由合金主相Mg2Ni(及其氢化物Mg2Ni H0.3)和腐蚀产物Mg(OH)2组成。Mg2Ni合金经充放电循环后在其表面形成了Mg(OH)2钝化层,尤其是晶界处Mg析出量多,因此形成的氧化腐蚀产物也多。Mg被腐蚀后形成的Mg(OH)2为沉淀物,不易在电解液中溶解,而是附着在合金表面上形成紧密共格界面,对电化学反应的进行起着阻碍作用。图7(b)是铸态Mg2Ni0.75Zn0.25合金MgZn2晶粒腐蚀界面处的电子衍射图和衍射环的强度分布曲线。MgZn2晶粒腐蚀界面处也由合金MgZn2相、Mg2Ni H0.3氢化物相和腐蚀产物Mg(OH)2组成。虽然Zn替代合金的表面也形成了Mg(OH)2钝化层,但是Zn析出物的溶解促进了合金晶界处腐蚀裂纹的形成。在电化学过程中合金晶界处形成的Mg(OH)2钝化物随着MgZn2晶粒的溶解脱落而脱落,从而增多了合金的新鲜表面,有利于电化学反应的进行和放电容量的提升。
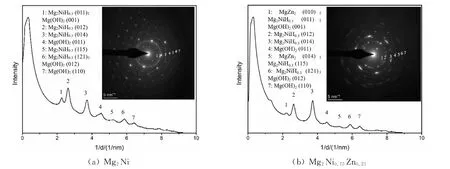
图7 合金样品晶粒和晶界处的电子衍射图Fig.7 Electron diffraction pattern at grain boundary of alloy samples
2.3 腐蚀及电化学性能提升机制
图8是铸态Mg2Ni和Mg2Ni0.75Zn0.25合金电极放电容量随循环次数的变化曲线[22]。可见,Zn替代Mg2Ni0.75Zn0.25合金电极的最大放电容量有了明显的提升,从Mg2Ni合金电极的16.96 m A·h/g增加到52.22 m A·h/g,增加了2倍之多。由微观结构分析可见,铸态合金的表面和晶界处首先被腐蚀形成钝化层。尤其是晶界处,铸态合金冷却凝固过程中析出的大量的自由态Mg在电化学反应过程中极易被腐蚀形成Mg(OH)2,并附着在Mg2Ni晶粒表面形成共格界面加大了电化学反应中氢原子穿透合金表面的难度。而在Mg2Ni0.75Zn0.25合金中一部分Zn 原子均匀地分布在Mg2Ni主相基体中,加剧了电化学反应中合金基体的腐蚀。相比Mg2Ni合金Mg2Ni0.75Zn0.25表面的腐蚀程度更为严重,腐蚀界面向合金基体内部的延伸和Zn的溶解进一步增多了合金的新鲜表面。而且Zn元素的溶解降低了合金表面形成的Mg(OH)2钝化层的连续性使其变得松散和多孔化,使得氢原子更容易穿透;另一方面,在Zn替代的Mg2Ni0.75Zn0.25合金晶界处形成了较多的细小MgZn2、Mg2Ni晶粒和自由态的Mg一同组成了共晶区域。尤其是自由态Mg被腐蚀氧化后合金晶界处形成了不利于电化学反应的Mg(OH)2腐蚀物。庆幸的是,在电化学反应中MgZn2晶粒不断溶解开裂以及脱落,合金晶界处形成的Mg(OH)2也随之脱落,出现了有利于吸放氢反应的新鲜表面,从而改善了合金电极的放电容量。由放电容量vs.循环次数的变化曲线可见,随着循环次数的增多Mg2Ni0.75Zn0.25合金电极的放电容量急剧下降,经7~8次循环后放电容量变得很低,这与合金表面腐蚀钝化层厚度的增加和新鲜活性表面的降低有关。虽然Mg2Ni0.75Zn0.25合金中的Zn元素易溶解,使得主相晶粒表面形成的钝化层变得多孔化和松散有助于氢原子的穿透,但是在合金表面形成共格界面的Mg(OH)2钝化层并不溶于碱性溶液中。随着循环次数的增多,合金表面的腐蚀层会变得越来越厚,合金活性表面与电解质之间的接触变得更为困难,导致放电容量变得很低。
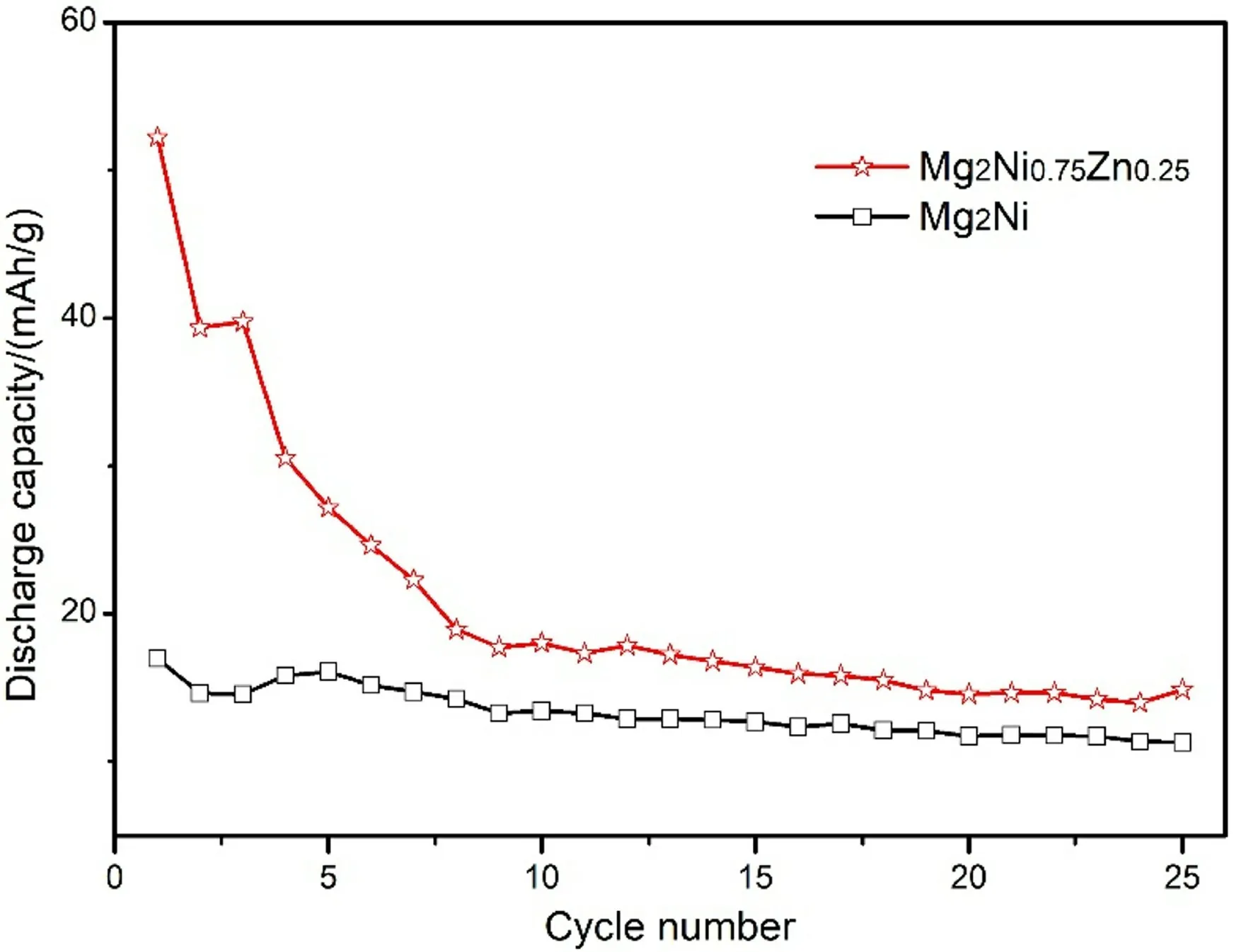
图8 铸态Mg2 Ni和Mg2 Ni0.75 Zn0.25合金电极放电容量随循环次数的变化[22]Fig.8 Discharge capacity with cycle number for the Mg2 Ni and Mg2 Ni0.75 Zn0.25 as-cast alloy electrodes[22]
3 结论
(1)XRD 分析结果表明,Zn 替代铸态Mg2Ni0.75Zn0.25合金中形成了第二相MgZn2、MgZn。Mg2Ni0.75Zn0.25合金经过10次充放电循环反应后,其XRD 图谱中38.99°位置的Zn的衍射峰削弱,40.25°位置的MgZn2相的衍射峰消失,这表明电化学过程中Zn和其析出物被分解。
(2)Mg2Ni0.75Zn0.25合金中的Zn元素和形成的MgZn2晶粒在电化学反应中容易溶解,因此合金晶界处会出现很多的腐蚀裂纹和凹槽。在电化学过程中,合金晶界处细小晶粒的MgZn2、Mg2Ni以及Mg(OH)2腐蚀物的脱落有利于合金新鲜表面的产生。
(3)电化学性能测试表明,Zn替代Mg2Ni0.75Zn0.25合金电极的最大放电容量有了明显的提升,从Mg2Ni合金电极的16.96 m A·h/g增加到52.22 m A·h/g,增加了2倍之多。主要原因在于Zn元素的溶解破坏了合金表面形成的Mg(OH)2钝化层的连续性,从而改善了电化学过程中的脱氢动力学和放电容量。
