miR-34a靶向调控前列腺癌发生相关基因SIRT 1的表达*
2024-01-10沙仁高娃
沙仁高娃,张 军
(1.内蒙古医科大学附属医院超声科,呼和浩特 010110;2.内蒙古医科大学附属医院泌尿外科,呼和浩特 010110)
前列腺癌在中国的发病率逐年升高,已成为男性第二类常见的癌症,这与人口老龄化、高动物脂肪饮食等密切相关[1]。据世界卫生组织国际癌症研究机构统计,2020年中国前列腺癌发病率约为1.56×10—4,新发病例超11万人,死亡人数超5万人,而在一线城市中前列腺癌发病率则更高[2]。前列腺癌干细胞是一类具有自我更新及多向分化潜能的前列腺癌细胞亚群,因此具有很高的耐药性[3]。在癌症发现早期,80%以上的前列腺癌患者可通过雄激素剥夺治疗(Androgen deprivation therapy,ADT)得到缓解,但经过1~2年的ADT 治疗后,多数患者逐渐发展为去势抵抗性前列腺癌(Castration-resistant prostate cancer,CRPC)[4-5]。Güler等报道极少数的表型为CD44+的前列腺癌细胞可以在裸鼠体内成瘤,并且克隆能力和转移能力也强于其他表型的前列腺癌细胞[6]。Tatar等从Du145细胞中筛选出CD44+细胞和CD44—细胞,研究显示CD44+细胞自我更新相关的干细胞标志物(SOX2、OCT4、Nanog等)呈现高表达,分化程度低,表明CD44基因是一种前列腺癌的干细胞标志物,并且已应用于肿瘤干细胞分选技术[7]。此外,NAD 依赖性去乙酰化酶SIRT1与CD44等肿瘤相关蛋白具有复杂调控作用,在前列腺癌的发生发展和转移中发挥功能[8]。
微小RNA(microRNA,miRNA)是一种高度保守的短链非编码RNA,长度为17~25 nt。miRNA通常与信使RNA(messenger RNA,mRNA)的3'非编码区(Untranslated region,UTR)结合来抑制翻译或促进mRNA 的降解,从而在转录后水平上负调控基因表达[9-10]。据报道,miRNA 广泛参与肿瘤发展及癌细胞的转移,其差异表达与化疗耐药及不良预后等也密切相关[11]。在前列腺癌细胞株中超过70种的miRNAs异常表达。miR-34a已证实在多种肿瘤细胞中异常表达,如乳腺癌、肺癌、胰腺癌、结肠癌以及白血病等。虽然目前报道了miR-34a的一些靶标基因,但是直接实验验证和确认的少之又少。因此,miR-34a靶标基因的确定显得尤为重要。本研究中,我们基于此前研究基础重点验证了miR-34a对SIRT1的转录后调控作用。
1 材料和方法
1.1 载体
p GL3-promoter载体含有猿猴病毒SV40强启动子下游的萤火虫萤光素酶基因(Firefly Luciferase,以下简称F-Luc)表达盒,通过F-Luc基因开放阅读框(Open reading frame,ORF)后面的XbaI位点可以克隆调控序列片段。p RL-TK 载体提供HSV-胸腺嘧啶核苷激酶(Thymidine kinase,TK)启动子下游组成型表达的海肾萤光素酶(Renilla Luciferase,以下简称R-Luc),可与pGL3-promoter载体联合共转染哺乳动物细胞。R-Luc的表达可为实验组的F-Luc表达的定量分析提供内参对照。
1.2 细胞株系及培养基
所用的细胞系从ATCC(American type culture collection)资源库获得。CWR22Rv1细胞培养基:RPMI 1640,10%的FBS,10 mmol HEPES,4.5 g/L葡萄糖(Glucose,C6H12O6),1.0 mmol丙酮酸钠(C3H3NaO3)。LNCap细胞培养基:RPMI-1640(PM150110),10%的FBS(164210-50),1%的P/S(PB180120)。PC3细胞培养基:Ham's F-12K(PM150910),10%的FBS(164210-50),1%的P/S(PB180120)。DU145细胞培养基:89%的MEM 基础培养基,10%的特级胎牛血清,1%的P/S青霉素-链霉素。
1.3 载体构建
从培养的CWR22Rv1细胞中提取基因组DNA,所用的试剂盒为QIAGEN 公司的Blood Cell-Culture Mini Kit。针对SIRT1基因3'-UTR 区域1797 bp片段序列设计扩增引物,引物设计的时候在引物的5'-端加上XbaI的酶切位点序列。通过上述引物从将基因组DNA 上扩增SIRT1 基因3'-UTR序列,PCR 产物纯化回收,XbaI消化,克隆到p GL3-promoter载体,测序验证。为了构建3'-UTR截断载体,将SIRT1基因3'-UTR 区域分成4段,即1-350 nt,351-900 nt,901-1300 nt,1301-1797 nt,其长度分别为350 nt,650 nt,400 nt,497 nt。设计合成扩增引物,从上述重组载体上扩增出来,分别克隆到p GL3-promoter载体的XbaI位点中。
1.4 细胞转染和蛋白表达检测实验
将构建好的p GL3-promoter重组载体(500 ng)与p RL-TK 载体(10 ng)共转染到生长到90%密度的24孔板培养的CWR22RV1细胞,共转染p GL3-promoter和p RL-TK 载体作为对照实验。在Thermo Forma 371 高温灭菌CO2细胞培养箱上培养24 小时后收集细胞,利用Dual-Luciferase Reporter Assay System(Promega)在Glo Max 96 Microplate Luminometer上进行F-Luc蛋白质水平的测定。
1.5 靶标位点的突变
miRNA 的靶标位点较短,只有22 bp左右,因此很容易化学合成。设计合成靶标位点对应的寡核苷酸片段,将其克隆到pGL3-promoter载体。设计合成将靶标位点3次串联重复的寡核苷酸片段,将其克隆到p GL3-promoter载体。设计合成将靶标位点中的与对应miRNA 互补区域突变的寡核苷酸片段,将其克隆到p GL3-promoter载体。
1.6 miRNA的过表达及抑制试验
合成miRNA 靶标位点对应的miRNA 的类似物(Mimic)及抑制剂(Inhibitor),将其分别与报告基因重组载体共转染到CWR22RV1细胞中,检验其对相应靶标位点的作用,检测过表达和抑制相关miRNA 后的雄激素受体激活水平。
1.7 培养细胞中miRNA及靶标SIRT1基因表达水平的分析
将原始获得的LNCap、PC3、DU145和CWR22RV1细胞分别在相应培养基上培养不同代数,收集细胞。利用Invitrogen公司的TRIzol试剂和PureLink纯化试剂盒提取总RNA,通过Invitrogen SuperScript反转录酶合成cDNA,利用RT-qPCR 实验检测miR-34a及SIRT1基因的表达水平。
2 研究结果
2.1 SIRT1基因的3'-UTR区域中存在转录后沉默元件
将SIRT1基因3'-UTR 区域1797bp 片段PCR 扩增产物利用5'-端的XbaI酶切位点克隆到pGL3-promoter载体,获得重组载体p GL3-FLuc-SIRT1,酶切结果表明成功获得了表达载体。在RPMI 1640培养基上培养CWR22RV1细胞,细胞密度达到90%的时候利用Invitrogen公司的Lipofectamine 3000共转染p GL3-SV40-FLuc-X 载体与p RL-TK 载体,培养24 小时后收集细胞检测F-Luc蛋白质的表达水平。结果表明,相比对照组p GL3-promoter,实验组p GL3-FLuc-SIRT1 的F-Luc基因m RNA 水平没有显著变化,而F-Luc蛋白水平降低了52%(图1),说明SIRT1基因的3'-UTR区域中存在转录后沉默元件。
2.2 截断研究显示901-1300 nt片段里存在调控SIRT1基因表达的miRNA
miRbase(microRNA database)是一种提供miRNA 序列数据、注释、预测基因靶标等信息的全方位数据库。利用miRbase数据库进行SIRT1基因3'-UTR 区域中可能的miRNA 靶标位点,发现共有19 个可能的靶标位点(图2-A)。依据这些miRNA 靶标位点的分布构建了4 个截断体(图2-B),分别将这些片段构建到p GL3-promoter载体F-Luc下游XbaI处,获得重组载体p GL3-FLuc-UTR1,p GL3-FLuc-UTR2,p GL3-FLuc-UTR3,p GL3-FLuc-UTR4,测序表明正确。
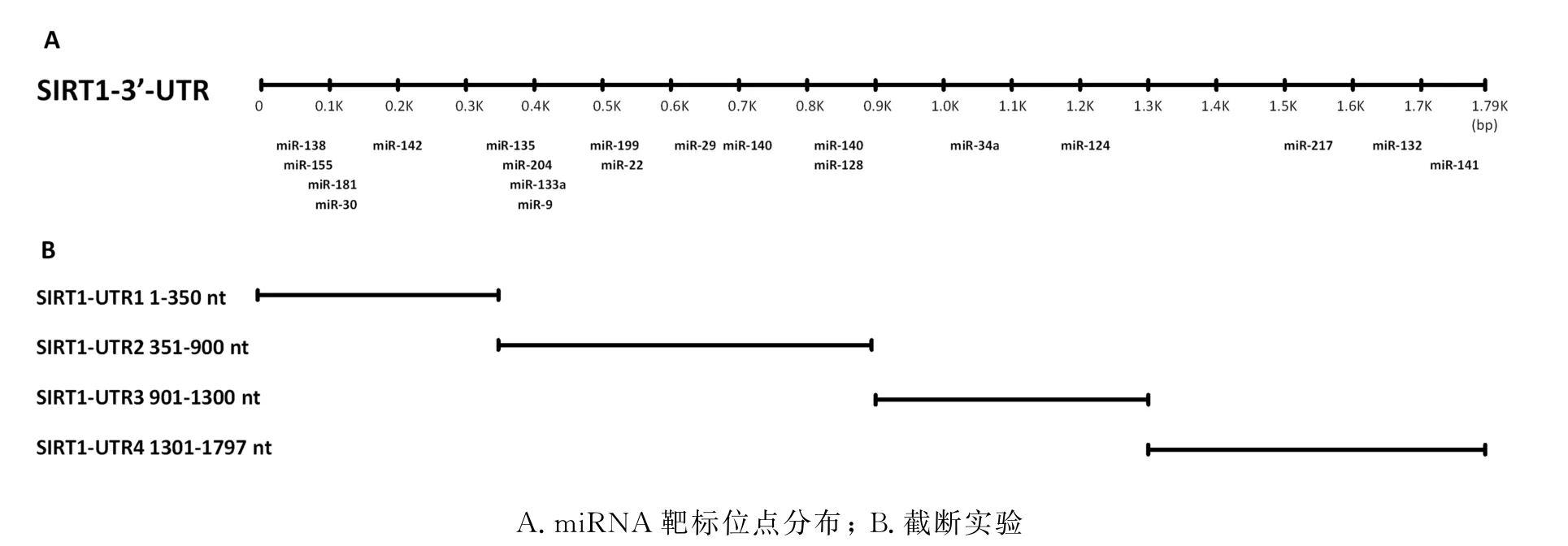
图2 SIRT 1基因3'-UTR 区域中可能的miRNA 靶标位点及截断实验Fig.2 Illustration of putative miRNA binding sites in the 3'-UTR of SIRT 1 and truncation constructs
分别将上述4个截断重组载体与p RL-TK 载体共转染到90%密度的CWR22RV1细胞,培养24小时后收集细胞检测F-Luc蛋白质的表达水平。结果表明,实验组p GL3-FLuc-UTR1,p GL3-FLuc-UTR2,p GL3-FLuc-UTR3,p GL3-FLuc-UTR4的F-Luc蛋白水平是分别为对照组p GL3-promoter的116%,108%,49%,94%(图3)。综合分析图2和图3结果,结果表明SIRT1基因3'-UTR区域中的转录后沉默元件存在于其901-1300 nt片段里,而这个区域的miR-34a和miR-124是潜在的靶位点。
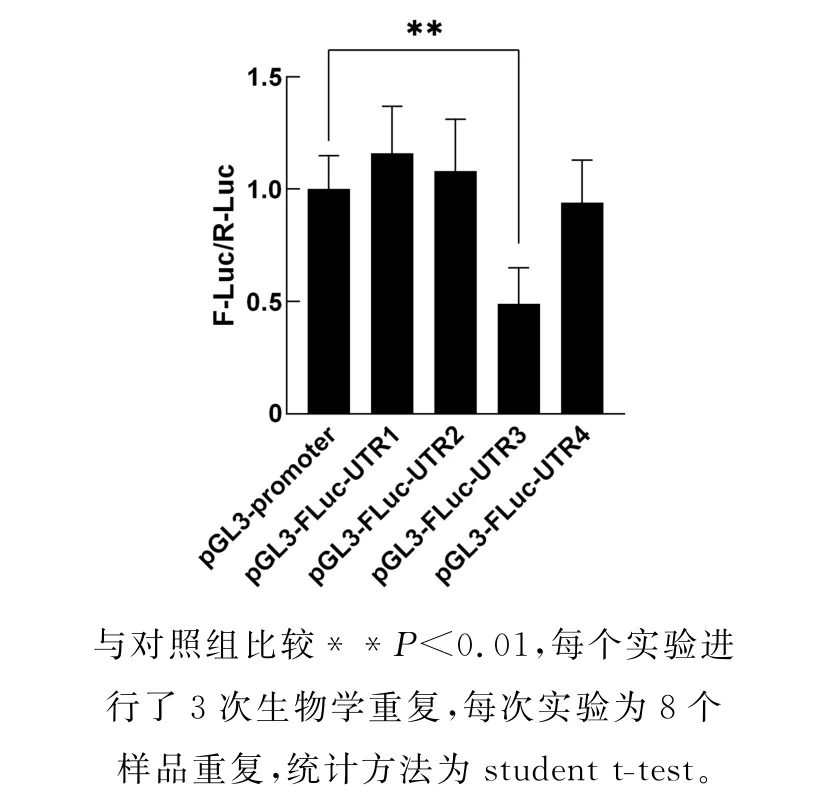
图3 SIRT 1基因3'-UTR 中转录后沉默区域的鉴定Fig.3 Identification of post-transcriptional regulatory region in the 3'-UTR of SIRT 1
2.3 突变和串联研究显示SIRT1是调控SIRT1基因表达的miRNA
由于miR-34a和miR-124是潜在的调控miRNA,我们对这两个miRNA 进行了进一步研究。设计合成了miR-34a靶标位点(以下简称34a)和miR-124靶标位点(以下简称124)对应的寡核苷酸片段,将其克隆到p GL3-promoter载体,分别获得了重组载体p GL3-FLuc-34a和p GL3-FLuc-124。分别将上述2个重组载体与p RL-TK 载体共转染到90%密度的CWR22RV1细胞,培养24小时后收集细胞检测F-Luc蛋白质的表达水平。结果表明,相比对照组p GL3-promoter,实验组p GL3-FLuc-34a和的F-Luc蛋白水平降低了43%,而p GL3-FLuc-124中没有显著变化(图4)。结果表明,miR-34a是SIRT1基因转录后水平的miRNA。
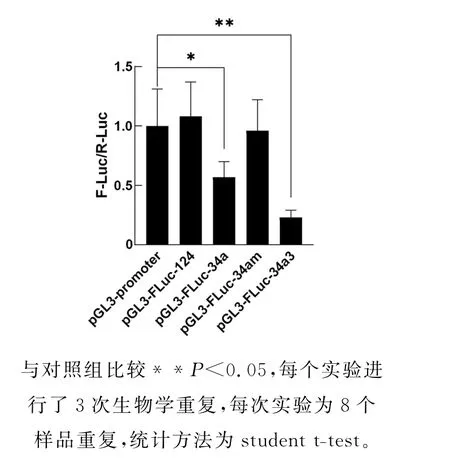
图4 F-Luc蛋白水平的检测Fig.4 Protein test of F-Luc
人类miR-34a的序列如图5所示。为了进一步证明miR-34a对SIRT1基因的调控作用,我们设计合成了靶标位点上与miR-34a互补区域突变(以下简称34am)的寡核苷酸片段,获得了重组载体p GL3-FLuc-34am,克隆了将miR-34a靶标位点3次串联重复(以下简称34a3)的寡核苷酸片段,获得了重组载体p GL3-FLuc-34a3。结果表明,相比对照组p GL3-promoter,p GL3-FLuc-34am 的F-Luc蛋白水平没有显著变化,表明这种突变丧失了调控能力(图4)。相比p GL3-FLuc-34a组,p GL3-FLuc-34a3的F-Luc蛋白水平又降低了34%(图4)。结果表明,SIRT1 基因3'-UTR 区域中存在的miR-34a靶标位点以剂量依赖性方式抑制SIRT1基因的表达,而这个位点的突变导致这种抑制作用的丧失。这个结果证实了miR-34a的确是SIRT1基因转录后水平的miRNA。
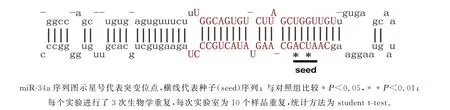
图5 miR-34a调控作用的确定Fig.5 Confirmation of regulatory role of miR-34a
2.4 miR-34a的过表达及抑制试验证明了其调控作用
上述实验从SIRT1 基因3'-UTR 区域中存在的miR-34a靶标位点的角度证明了miR-34a对SIRT1 基因的调控作用。为了进一步从miRNA 角度验证这种调控作用,我们设计合成了miR-34a的类似物(34a-mimic)及抑制剂(34a-inhibitor),将其分别与p GL3-FLuc-34a和p RL-TK 载体共转染到90% 密度的CWR22RV1细胞,培养24小时后收集细胞检测F-Luc蛋白质的表达水平。结果表明,在pGL3-FLuc-34a转染组,相比对照组,实验组34a-mimic的F-Luc蛋白水平降低了31%,而34a-inhibitor的F-Luc蛋白水平提高了32%(图6)。在pGL3-promoter转染组,34a-mimic和34a-inhibitor 并不影响F-Luc 蛋白水平(图6)。这些结果进一步证实了miR-34a 对SIRT1基因的调控作用。
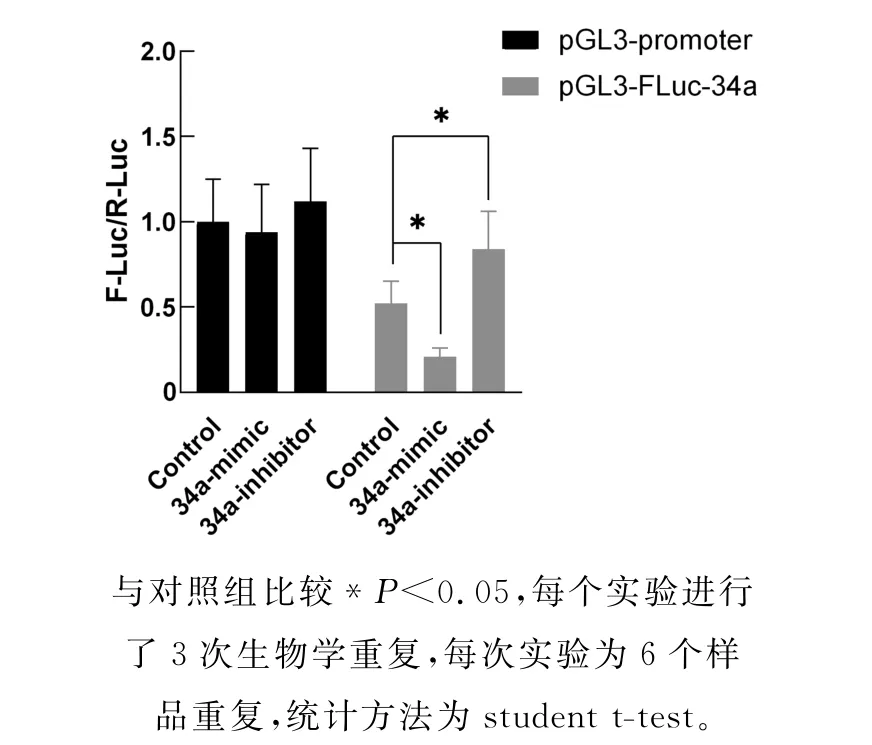
图6 miR-34a的类似物及抑制剂的作用鉴定Fig.6 Identification of the roles of miR-34a mimic and inhibitor
2.5 miR-34a及靶标SIRT 1基因的表达呈现负相关
我们收集了培养代数不同的前列腺癌细胞LNCap、PC3、DU145和CWR22RV1,利用RT-qPCR技术检测上述实验鉴定到的调控miR-34a及靶标SIRT1基因的表达水平,分析了它们之间的相关性。结果表明,在DU145和CWR22RV1中miR-34a及靶标SIRT1基因的表达呈现负相关,而在LNCap和PC3细胞中无相关性(图7)。这说明在有些前列腺癌细胞(DU145和CWR22RV1)中的确存在miR-34a对靶标SIRT1基因的转录后抑制作用,进一步证实了图1—6的结果。

图7 培养细胞中成熟miR-34a和SIRT 1 m RNA 水平的检测Fig.7 Detection of m RNA level of SIRT 1 and mature miR-34a in cultured cells
3 讨论
前列腺癌(prostate cancer,PCa)是男性中常见的恶性肿瘤,前列腺癌自2008年起成为我国男性泌尿生殖系统中发病率最高的肿瘤,年均增长率已达到12.07%,列男性恶性肿瘤发病率的第6位。探讨前列腺癌尤其是去势抵抗性前列腺癌转移发生的分子机制,对降低前列腺癌的患者死亡率具有重大意义[12]。microRNA(miRNA)是重要的调控RNA,具有高度的保守性,由非编码蛋白核基因转录而来。编码miRNA 的基因转录后产生一个长的pri-miRNA 分子,这种原初转录物被剪切成约70-90 nt大小、具发夹结构的单链RNA 前体(pre-miRNA),pre-miRNA 由输出蛋白5(Exportin-5)从细胞核转运入胞液,接着在核糖核酸酶III Dicer的作用下剪切为双链的dsRNA,最终dsRNA 在解旋酶的作用下分解为miRNA 和miRNA*。miRNA 结合到Argonaute2(AGO2)形成miRNA 介导的沉默复合体(RNA-induced silencing complex,RISC)。
RISC中的miRNA 被激活,通过种子序列与m RNA 的3'-UTR 结合,抑制m RNA 的转录或造成m RNA 的分解,从而调控基因的表达[13]。药物耐受是前列腺癌患者治疗最为棘手的环节,而小RNA 分子由于其无免疫原性等特点被认为是具有临床治疗应用前景的分子,结合新型如超声微泡造影剂等靶向基因递送系统可为前列腺癌的基因靶向治疗提供新型手段和药物来源[14]。研究表明,miR-34a在前列腺癌形成中具有重要调节作用,如戈舍瑞林联合比卡鲁胺可上调晚期前列腺癌患者血清miR-34a水平,而手术去势、电切术联合间断性内分泌治疗,可上调晚期前列腺癌患者血清miR-34a水平[15]。通过制备miRNA-34a靶向纳米复合物可以抑制一些癌细胞的增殖,表明可能发挥着肿瘤抑制作用[16]。miR-34a在微小RNA 的临床转化研究中具有较强的临床应用前景,脂质体制剂的miR-34a具有重要临床意义[17]。通过对miR-34a在前列腺癌中的系列研究发现,miR-34a可以通过靶向作用前列腺癌干细胞表面的CD44 以杀伤肿瘤干细胞,进而抑制肿瘤的耐药性[18]。此外,miR-34a也可以同时直接或者间接作用于周期相关蛋白Cyclin D1、Cyclin D3、CDK4及其CDK6从而影响细胞的生长周期甚至诱导凋亡,也可以通过直接或者间接作用于Myc、Notch、JAG1和SIRT1来影响细胞的自我更新能力[19]。虽然上述研究在生物信息学分析、细胞表型等方面证实了miR-34a的作用,但对于其直接靶标基因的实验验证方面缺乏依据。因此,鉴于目前miR-34a的靶标基因不明确问题,本研究中重点分析了癌基因SIRT1和miR-34a间的调控关系,阐明了miR-34a在SIRT1上的靶位点。SIRT1作为一种去乙酰化酶(Histone deacetylase,HDAC)具有广泛的调控作用,并参与包括前列腺癌在内的多种肿瘤的发生[20-22]。本研究直接联系了前列腺癌转移中重要的两个分子miR-34a和SIRT1之间的调控作用。研究结果显示,成熟miR-34a的水平与前列腺癌的发展具有正相关,而SIRT1的m RNA 水平呈现负相关,这表明miR-34a对SIRT1的调控是复杂的转录后调控,而不是简单的翻译抑制。这些表明,微小RNA 的调控具有多种模式,值得进一步探究,因此本研究具有重要研究意义和应用价值。结合miR-34a研究为基础的RNA 疫苗等的研发将为利用RNA 分子进行肿瘤靶向治疗提供广阔的应用前景[23]。
