裂解多糖单加氧酶Af LPMO7的酶学特性研究
2024-01-10娄淑慧尹玉莹安姝宇朱超强高建民
马 磊,娄淑慧,尹玉莹,安姝宇,朱超强,韩 艺,高建民
(河南城建学院生命科学与工程学院,河南 平顶山 467036)
我国是农业大国,每年均会产生大量纤维素类农业废弃物,若能将其有效利用,不仅能够减轻生态环境的压力,还能够避免大量的资源浪费。纤维素是一种高分子有机聚合物,由大量单糖组成。为了有效利用纤维素,需要将其水解成为寡糖或单糖。目前,常使用糖苷水解酶催化降解纤维素[1],但由于糖苷水解酶对纤维素结晶区的利用效率较低,需通过物理或化学方法对纤维素进行预处理[2],以便提高糖苷水解酶对纤维素的降解效率。近年来,学者发现了裂解多糖单加氧酶(LPMO),将其归类于辅酶家族[3](AA家族),其能有效降低多糖底物的结晶度,且能有效提高糖苷水解酶的水解效率。关于AA家族,目前研究最多的是AA9家族[4],其主要作用于纤维素底物。进一步研究AA9家族,将对高效水解纤维素提供一定的技术支持。
木质纤维素是重要的可再生资源,酶解法是将其降解利用的重要途径。对AfLPMO7蛋白的深入研究,提高其降解效率,阐明其在生物质降解中的作用,更好地促进农业废弃物的降解,进而创造较高的经济价值,对我国农业废弃物的资源化利用具有重要的意义。本研究围绕AfLPMO7蛋白进行蛋白表达与纯化、底物吸附、酶活力测定、氧化能力分析与底物识别等。
1 材料与方法
1.1 材料
菌株:大肠杆菌BL21,由平顶山市珍稀食用菌工程技术研究中心保存。
质粒:含有Tev标签的pCold TF载体,由平顶山市珍稀食用菌工程技术研究中心保存。
商业酶:纤维素酶(cellulase)来源于Aspergillus niger。
LB培养基:蛋白胨10 g,氯化钠10 g,酵母粉5 g。
试剂:(1)平衡液。50 mmol NaH2PO4,300 mmol NaCl,10 mmol iminazole,NaOH调节pH至8.0,用0.22μmol滤膜抽滤后使用。(2)洗脱液。50 mmol NaH2PO4,300 mmol NaCl,300 mmol iminazole,NaOH调节pH至8.0,用0.22μmol滤膜抽滤后使用。(3)30%Acr-Bis(29∶1)、浓缩胶缓冲液、分离胶缓冲液、10%过硫酸铵(APS)、四甲基乙二胺(TEMED)、蛋白5×loading、预染蛋白Marker、Xylan、2,6-DMP等均购自源叶生物公司。(4)3%H2O2购自平顶山新城区药店。(5)考马斯亮蓝染色液。0.25 g考马斯亮蓝R-250溶解于包含40%甲醇的水溶液中。(6)脱色液。10%乙酸、5%乙酸溶解于去离子水中。(7)结晶纤维素(Avicel PH101)购自Sigma公司;没食子酸和氯化铜均购自南试公司。
供试仪器:AKTA蛋白纯化仪(美国通用GE/AKTA Pufier10)。
1.2 方法
1.2.1AfLPMO7的进化树分析
选取与AfLPMO7关系相近的22个蛋白的氨基酸序列,将其保存为fasta格式,使用MEGA(version 5.1,Mega Limited,Auckland,New Zealand)绘制进化树。
1.2.2AfLPMO7的功能预测
将AfLPMO7的氨基酸序列录入在线数据库Conserved Domain Database(CDD)(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)上,对其功能模块进行预测。
1.2.3AfLPMO7的表达和纯化
将AfLPMO7的基因序列连接至含有Tev标签的pCold TF载体上,通过42℃热击转化方式将其导入大肠杆菌BL21中,得到转化子,将转化子接入LB培养基中培养,当吸光度600(OD600)达到0.5时加入500μmol的异丙基-β-D-硫代半乳糖苷(IPTG),诱导AfLPMO7蛋白的表达,并用SDS-PAGE电泳验证蛋白是否表达。若蛋白表达,使用亲和层析的方法纯化AfLPMO7蛋白,并使用核酸定量仪(ND-2000,Thermo,USA)测定AfLPMO7的蛋白浓度[5]。
1.2.4AfLPMO7与PASC的吸附实验
吸附实验根据Manjeet的方法[6]稍作改动。底物选择PASC,实验分为两组,一组为仅有AfLPMO7蛋白,另一组为AfLPMO7蛋白和PASC。AfLPMO7的蛋白浓度为0.5 mg/mL,PASC的浓度为10 mg/mL,反应缓冲液为磷酸盐缓冲液(PBS,pH 7.4),反应温度为50℃,转速为200 r/min,反应时间为2 h。反应结束后,10 000 r离心2 min,固液分离,并将PASC用PBS洗涤3次。最后用50μL PBS重悬PASC,加入10μL蛋白上样缓冲液,沸水浴10 min,10 000 r离心2 min后取上清,进行SDS-PAGE电泳,检测吸附在底物上的AfLPMO7蛋白含量。
1.2.5AfLPMO7对PASC和Xylan的降解实验
将AfLPMO7与过量氯化铜逐步混合,室温静置20 min。使用50 mmol醋酸钠缓冲液(pH 5.0)平衡脱盐柱G25,将混合物流经脱盐柱,并用50 mmol醋酸钠缓冲液冲洗脱盐柱,收集蛋白溶液,即得到Cu2+-AfLPMO7。以下酶活力实验均用Cu2+-AfLPMO7。
1 mL的反应体系包括底物PASC(1%)或者Xylan(1‰),1μmol Cu2+-AfLPMO7,2 mmol的没食子酸,50 mmol醋酸钠缓冲液(pH 5.0)。反应温度为50℃,转速为150 r/min,反应时间为12 h。在同等条件下设置灭活的AfLPMO7蛋白作为对照(CK)。反应结束后,将样品沸水浴5 min后,10 000 r离心10 min,取上清,加入等量DNS,沸水浴5 min,在波长540 nm处测吸光度,计算还原糖的含量[7]。
1.2.6AfLPMO7与纤维素酶对天然底物的糖化实验
1 mL的反应体系包括1%水稻秸秆、1%小麦秸秆、1%玉米秸秆,0.05 U纤维素酶,1.0、2.0和3.0μmol Cu2+-AfLPMO7,2 mmol没食子酸,50 mmol醋酸钠缓冲液(pH 5.0)。反应温度为50℃,转速为150 r/min,反应时间为24 h。反应结束后,计算还原糖的量。
1.2.7AfLPMO7动力学实验
动力学实验根据Breslmayr的方法[8]稍作改动。将2,6-DMP作为底物。1 U的酶活力定义为每分钟产生1μmol木醋醌(coerulignone)的LPMO的量。缓冲液分别选择50 mmol醋酸钠缓冲液(pH 5.0)和PBS(pH 7.4),辅助因子H2O2的浓度为100μmol,反应温度为30℃,在同等条件下设置灭活的AfLPMO7蛋白作为对照(CK)。反应结束后,在波长469 nm处测吸光度,计算coerulignone的量。
1.2.8AfLPMO7的同源建模和分子对接
AfLPMO7的同源建模采用AlphaFold2 server(https://colab.research.google.com/github/deepmind/alphafold/blob/main/notebooks/AlphaFold.ipynb#scrollTo=woIxeCPygt7K)。活性中心的预测采用在线预测网站Zhang Lab(https://zhanglab.ccmb.med.umich.edu/)。
用Vina[9-10]软件进行分子对接实验。以预测的AfLPMO7结构为受体、纤维六糖为配体,分别添加氢原子使其为质子化状态,并计算扭转分支中心和配体扭转自由度。将His3、His85和Tyr163视为柔性,受体坐标分为刚性部分和柔性侧链。最后,设置参数(包含全部可变换氨基酸的大网格)运行Vina程序。
2 结果与分析
2.1 Af LPMO7的序列分析
AfLPMO7的进化树结果见图1(a),由图1(a)可知,AfLPMO7蛋白与多数AA9家族蛋白具有较近的亲缘关系,其中具有最近关系的为PsAA9蛋白(PDB数据号:7PQR),它们的氨基酸相似度为33.36%,又与部分内切葡聚糖酶具有一定的亲缘关系。基于CDD比对结果对AfLPMO7蛋白进行功能区预测见图1(b)。由图1(b)可知,AfLPMO7蛋白N端具有一个AA9家族功能模块,中间部分为蛋白linker,起到连接蛋白质N端和C端的作用,C端为一个CBM1功能区,确认AfLPMO7蛋白为AA9家族蛋白。
2.2 Af LPMO7的表达纯化和底物吸附实验
AfLPMO7蛋白存在于大肠杆菌细胞内,将细胞破碎,经过镍柱分离纯化后得到其纯化蛋白。经SDS-PAGE电泳验证后,结果如图2(a)所示,泳道1为纯化后的AfLPMO7蛋白,其大小约为38 kDa,与理论预测值一致,表明其表达成功。

图2 Af LPMO7的SDS-PAGE电泳及底物吸附结果
在AfLPMO7蛋白对PASC的吸附实验中,经过2 h的结合,结果如图2(b)所示,泳道2为不加底物的蛋白含量,泳道3为反应体系中未吸附的AfLPMO7蛋白,结果表明游离蛋白减少了较多的量。吸附在底物PASC的AfLPMO7蛋白含量如图2(c)所示,其中泳道4~6均为吸附在PASC的AfLPMO7蛋白。结果表明AfLPMO7蛋白对PASC具有较强的吸附能力。
2.3 Af LPMO7对PASC和Xylan的直接降解及与纤维素酶对天然底物的糖化作用
PASC和Xylan分别为纤维素和半纤维素,将其作为底物研究AfLPMO7蛋白的酶活力。如图3(a)所示,AfLPMO7作用于PASC时,产生了浓度为17.12μg/mL的还原糖,作用于Xylan时,产生了浓度为41.24μg/mL的还原糖,表明AfLPMO7能作用于纤维素和半纤维素,且对半纤维素的降解能力较强。

图3 Af LPMO7对底物的直接作用及与纤维素酶对天然底物的糖化作用
本文主要研究AfLPMO7与纤维素酶协同降解天然底物。如图3(b)所示,当以水稻秸秆为底物时,经过24 h反应后,与仅加入纤维素酶相比,分别添加1.0μmol、2.0μmol和3.0μmol的AfLPMO7蛋白,糖化率依次提高了37.53%、111.89%和87.69%。如图3(c)所示,当以小麦秸秆为底物时,经过24 h反应后,与仅添加纤维素酶相比,分别添加1.0μmol、2.0μmol和3.0μmol的AfLPMO7蛋白,糖化率依次提高了20.48%、35.55%和38.82%。如图3(d)所示,当以玉米秸秆为底物时,经过24 h反应后,与仅添加纤维素酶相比,分别添加1.0μmol、2.0μmol和3.0μmol的AfLPMO7蛋白,糖化率依次提高了29.97%、50.95%和22.05%。说明AfLPMO7蛋白能有效地协助纤维素酶降解天然底物,如水稻秸秆、小麦秸秆和玉米秸秆等。
2.4 Af LPMO7的动力学实验分析
为了探究AfLPMO7蛋白的反应速率,选择2,6-DMP作为底物,H2O2浓度为100μmol,测定AfLPMO7蛋白的动力学参数。在50 mmol醋酸钠缓冲液(pH 5.0)中,AfLPMO7的Vmax值为109.99±3.91 U/g,Km值为2.82±0.33 mmol(见图4(a))。在PBS(pH 7.4)中,AfLPMO7的Vmax值为91.07±1.28 U/g,Km值为0.52±0.05 mmol(见图4(b))。
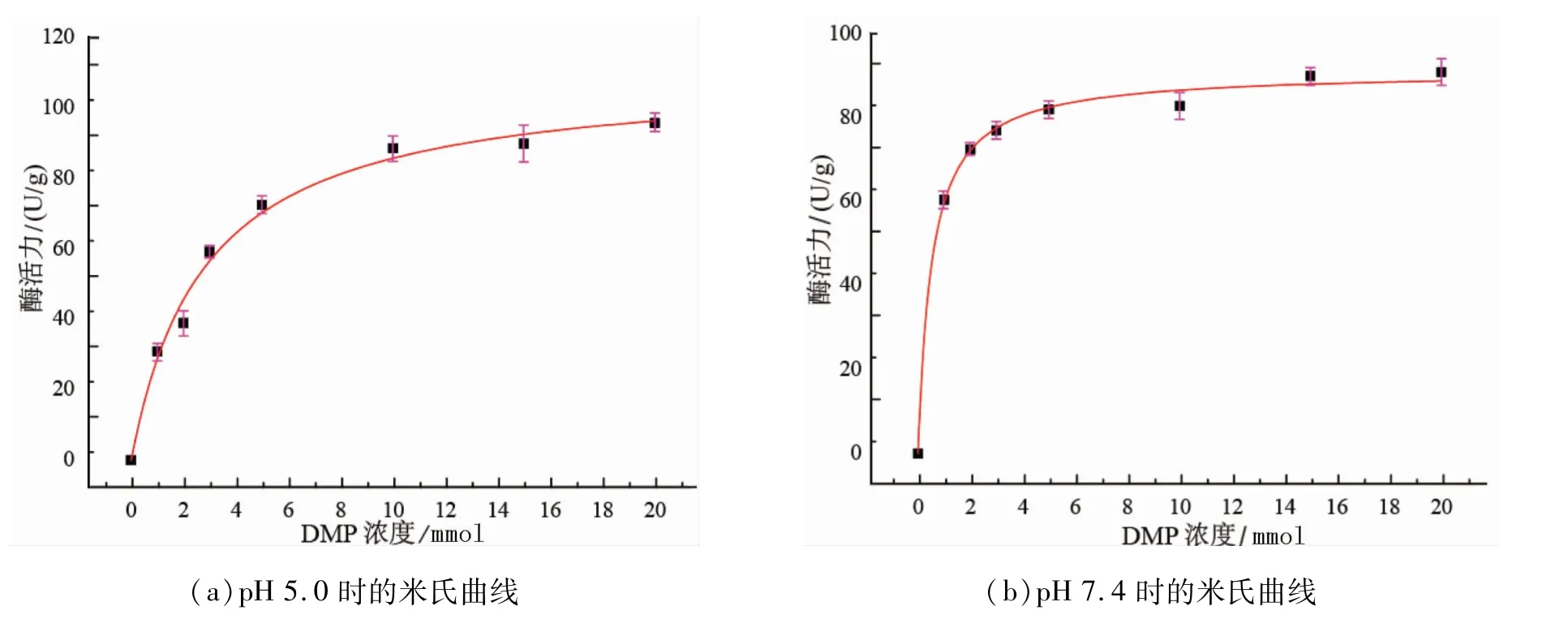
图4 不同pH条件下Af LPMO7的米氏曲线
2.5 Af LPMO7的同源建模和活性中心的预测
使用AlphaFold2 server对AfLPMO7进行同源建模,生成的结构如图5(a)所示,AfLPMO7的主体由AA9家族蛋白功能区和CBM1(红色部分)组成。AA9家族蛋白功能区的核心由8个反向平行的β折叠(粉红色)和3个α螺旋(紫色部分)组成。其活性中心位于蛋白平坦的表面,活性中心His3、His85和Tyr163氨基酸残基组成了其铜离子活性中心(见图5(b))。
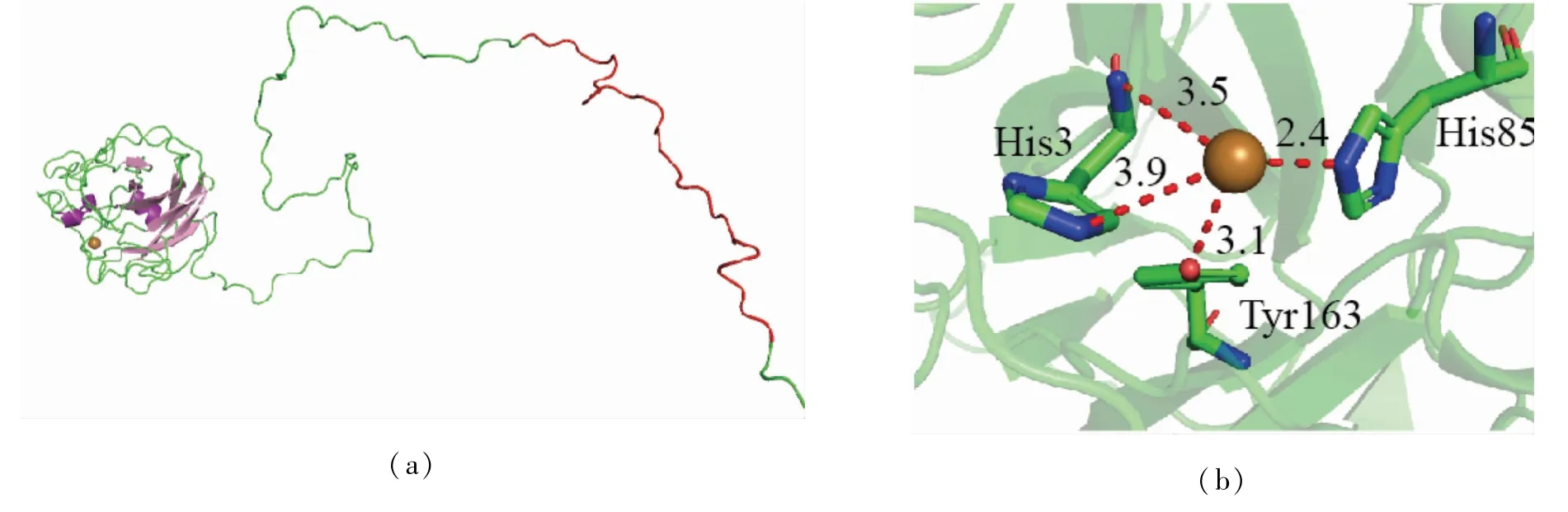
图5 Af LPMO7的三维结构图
2.6 Af LPMO7的分子对接
采用分子对接技术探究AfLPMO7与纤维素的结合位点。模拟运算后,选取能量最小的作为对接模型,其能量为-9.2 kcal/mol。在AfLPMO7与纤维六糖的对接模型(见图6(a))中,纤维六糖分子悬浮在AfLPMO7蛋白表面,且接近其活性中心的铜离子,此外还有4个氨基酸(Ser33、Thr36、Arg74、Gly159)与纤维六糖分子之间形成了氢键,并以此相互作用(见图6(b))。图6(c)为相互作用的二维可视化图,结果表明AfLPMO7与纤维六糖的作用方式不仅有氢键,还有疏水作用(His3、Asn31、Thr73)。
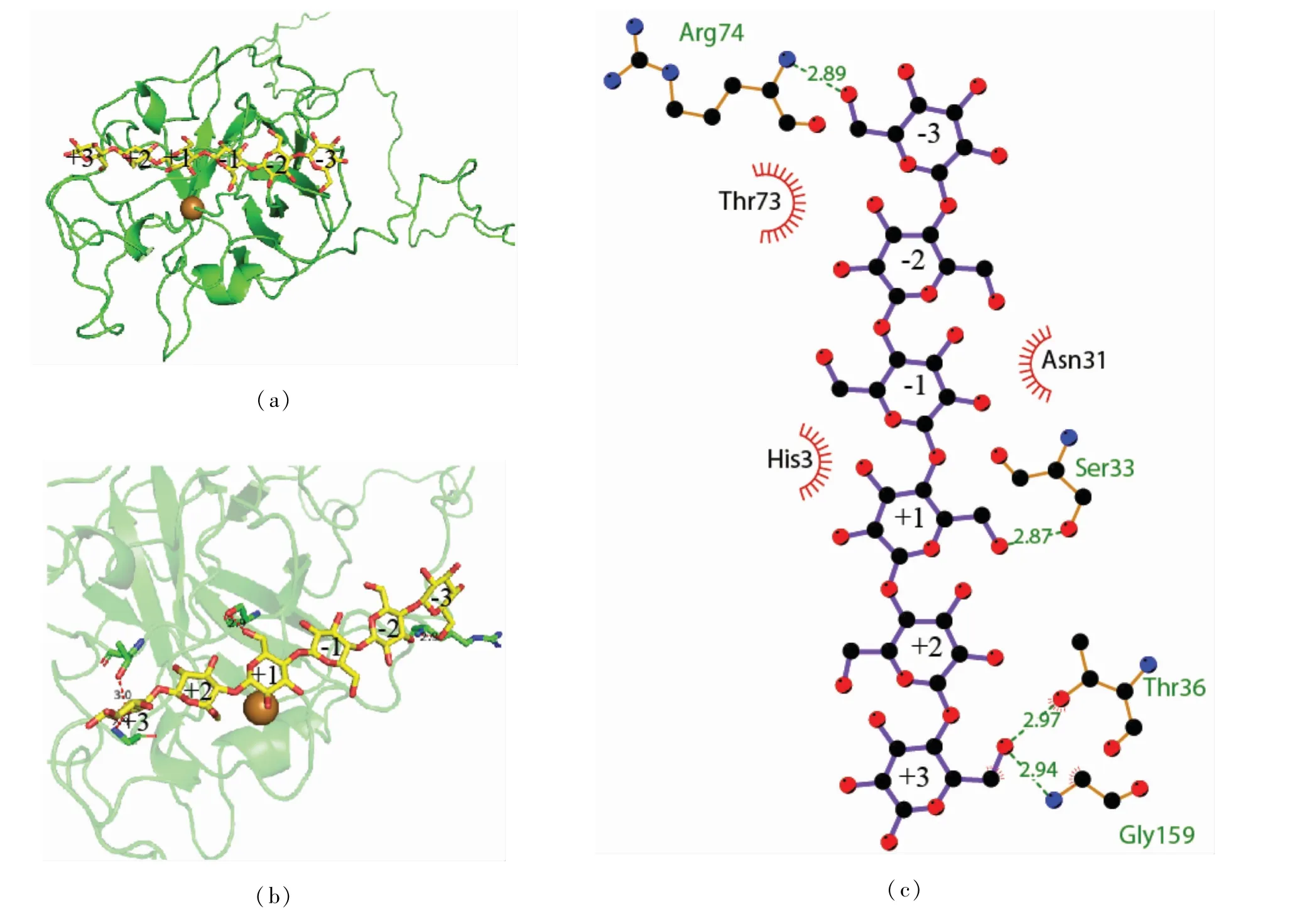
图6 Af LPMO7与纤维六糖的分子对接
3 讨论与结论
AA9家族LPMOs是一类能有效协助纤维素酶降解纤维素的辅酶,可对纤维素多糖链进行破坏,使多糖链的结构变得疏松,进而促进纤维素水解酶进一步降解纤维素。在对AA9家族蛋白的研究中,着重研究其对纤维素的吸附作用,只有酶与底物结合,才能更好地发挥作用。评价AA9家族LPMOs对纤维素的吸附能力有两种方法,一种是反应体系游离蛋白的减少,另一种是吸附于纤维素的蛋白量,均用SDS-PAGE电泳结果直接显现。AfLPMO7具有一个CBM1模块,表现出对纤维素具有较强的吸附能力。其他AA9家族蛋白如HjLPMO9A(来源于Hypocrea jecorina),在其蛋白C端,同样具有一个CBM1功能区,因而也表现出对PASC具有较强的吸附能力[11]。此外,还有AA9家族蛋白携带名为X278的保守结构域,由4个半胱氨酸残基和1个芳香残基组成,可能具有与CBM相似的功能[12]。
AfLPMO7蛋白能够作用于PASC和Xylan并产生还原糖,证明其能够作用于纤维素和半纤维素。已有研究认为大部分AA9家族蛋白只能作用于纤维素底物,极少数能作用于半纤维素底物,同时能对木葡聚糖产生作用,如来源于Malbranchea cinnamomea的PMO9A_MALCI[13]。AfLPMO7能与纤维素酶协同作用,提高纤维素酶对水稻秸秆、小麦秸秆、玉米秸秆的水解效率,提高幅度为20.48% ~111.89%。表明AfLPMO7能有效降解秸秆中难降解的部分,如木质素。一般认为,木质素对于纤维素的水解有着不利影响,但是由于AA9家族蛋白的特殊性,木质素反而会成为其降解纤维素的重要辅助因子,因为低分子量木质素具有二聚体和三聚体两种主要构象,这种具有一簇pi-轨道的结构有利于未配对电子的稳定性,使木质素成为一种有效的电子供体[14]。
在对AfLPMO7蛋白的动力学参数测定中,在50 mmol的醋酸钠缓冲液(pH 5.0)中,AfLPMO7具有最高的Vmax值,为109.99±3.91 U/g,Km值为2.82±0.33 mmol,表明AfLPMO7蛋白在此pH下,具有较高的氧化能力。AfLPMO7表现的氧化能力稍强于LPMO9F(来源于Neurospora crassa),这种差别可能与其蛋白质结构相关,尤其是铜离子活性中心的不同,这将影响AA9家族蛋白接受电子的能力[8]。AfLPMO7蛋白的Km值小于3 mmol,表明其铜离子活性中心进化为能结合2,6-DMP的结构。也有研究表明漆酶能有效地结合2,6-DMP,其Km值从15μmol到1 000μmol,尽管漆酶比AA9家族蛋白对2,6-DMP具有更强的结合能力,但是在木质素降解过程中,AA9家族蛋白的酶活力优于漆酶[15]。此外,在自动建模和分子对接实验中,发现AfLPMO7蛋白铜离子活性中心由His3、His85和Tyr163氨基酸残基组成,而其与纤维六糖结合的氨基酸为Ser33、Thr36、Arg74、Gly159,表明催化中心不一定为结合部分。
在本研究中,来源于Aspergillus fumigatusZ5的AfLPMO7蛋白被定性。AfLPMO7对PASC具有很强的吸附能力,能直接作用于PASC和Xylan,并释放出可溶性产物,且对2,6-DMP具有较强的氧化能力,并能协助纤维素酶有效降解天然底物。该结果为更好地利用AA9家族蛋白提供了一定的支持。
