乳腺癌保乳术后大分割放疗致急性放射性皮肤损伤的影响因素分析及风险预测模型构建
2024-01-10王建廷邵瑞雨王晓红
王建廷, 邵瑞雨, 王 晶, 李 娜, 熊 伟, 王晓红
乳腺癌是临床常见的女性恶性肿瘤,发病及病死人数均居女性癌症首位[1-2]。外科手术切除是乳腺癌主要治疗方法之一,以改良根治术及保乳术最为常见,但前者可使女性第二性征缺损,损害患者形象并增加其自卑感。在此背景下,保乳术逐渐成为目前早期乳腺癌治疗的主流术式,其可有效切除大体病灶,并结合术后放疗消灭残留微小病灶,显著降低局部复发及远处转移风险,患者总体生存率与改良根治术相近[3]。近年来,大分割放疗以其治疗时间短及治疗效果佳的优点已逐渐替代常规分割放疗,成为保乳术后首选的放疗方式,但其带来的毒副反应并未减少,其中急性放射性皮肤损伤因其显著影响外观及生活质量而最受患者重视[4]。本研究旨在探讨乳腺癌患者保乳术后行大分割放疗发生放射性皮肤损伤的危险因素,并构建其风险预测模型,以期为临床诊治及患者管理提供参考。
1 资料与方法
1.1临床资料 回顾性分析2020年10月至2022年9月于唐山市人民医院接受保乳切除术的170例乳腺癌患者的临床资料,年龄39~64(48.12±7.36)岁。将170例患者按7∶3分为模型组(119例)和验证组(51例)。纳入标准:(1)符合《中国抗癌协会乳腺癌诊治指南与规范(2021年版)》[5]中关于乳腺癌的诊断标准,并经病理学检查确诊;(2)初诊患者,未接受相关治疗;(3)接受保乳切除术及大分割放疗;(4)单侧乳腺癌。排除标准:(1)有放疗禁忌证者;(2)合并远处转移者;(3)合并心、肝、肾等重要脏器功能不全者;(4)合并血液类疾病者;(5)合并其他恶性肿瘤者;(6)合并神经系统疾病者;(7)合并严重感染性疾病者;(8)妊娠期或哺乳期者。本研究获得唐山市人民医院医学伦理委员会批准,所有患者手术及放疗前签署知情同意书。
1.2保乳切除术方法 行常规全麻术,根据肿瘤位置选择切口:(1)肿瘤位于上方时,选择弧形切口;(2)肿瘤位于外上或腋尾部时,选择放射状切口并向腋窝延伸;(3)肿瘤位于下方时,采用放射状切口。切除肿瘤病灶,并将肿块边缘约1 cm的组织切除,于瘤床边缘取出9个方位的标本进行病理活检。若均未发现癌细胞,则认为保乳手术成功。对于部分乳腺肿块较大的患者,切除肿块后会导致乳房外形出现偏差,需要对乳腺进行转移修复,并对乳房外形进行调整。
1.3放疗方法 采用瘤床同步补量大分割调强放疗,或先行全乳大分割调强放疗之后序贯瘤床电子线补量放疗。具体如下:嘱患者仰卧于乳腺Access Supine Breast and Lung托架(广州科莱瑞迪公司)上,平静呼吸,用铅丝标记患侧乳腺各边界及手术瘢痕,勾画体表标记线,应用大孔径BrillianceTMBig Bore型CT模拟定位机(荷兰飞利浦公司)扫描。层厚5 mm;范围上至胸廓入口,下至对侧乳腺褶皱下2 cm。将扫描图像传至Pinnacle 9.10治疗计划系统(荷兰飞利浦公司)。勾画瘤床同步补量大分割放疗患者靶区,临床靶区(clinical target volume,CTV)范围参考定位时的体表铅丝,包括患侧乳腺、胸大肌筋膜,CTV前、后、左、右外放0.5 cm,上、下外放1 cm,之后缩至皮下0.5 cm形成计划靶区(planning target volume,PTV)。瘤床根据术中放置的钛夹标记、术后血清肿、铅丝标记的手术瘢痕等共同确定,瘤床各方向外放1.0 cm且不超过CTV;CTVboost各方向外放0.5 cm且不超过CTV形成PTVboost。处方剂量:95%PTV 43.5 Gy/2.9 Gy/15F,95%PTVboost 49.5 Gy/3.3 Gy/15F,使用Varian Trilogy医用电子直线加速器(美国瓦里安公司)予6 MV X线照射。勾画序贯瘤床补量患者靶区,勾画PTV原则与瘤床同步补量患者相同。处方剂量:95%PTV 43.5 Gy/2.9 Gy/15F,予6 MV X线照射。放疗结束后,参考术前乳腺肿瘤影像、术后瘢痕、术后肿瘤残腔改变等确定补量区,之后外扩2~3 cm于体表勾画,根据原肿瘤深度行6~12 MeVβ电子线补量8.7 Gy/2.9 Gy/3F。勾画危及器官,主要包括双肺、心脏(包括冠状动脉左前降支/右冠状动脉)、脊髓、健侧乳腺、皮肤。
1.4放射性皮肤损伤判定 于放疗期间至放疗结束后3个月,根据放射治疗肿瘤协作组(Radiation Therapy Oncology Group,RTOG)放射性皮肤损伤分级标准[6]评估急性放射性皮肤损伤的情况,分为0~4级。见表1。根据急性放射性皮肤损伤发生情况,将模型组患者进一步分为损伤组(89例)和无损伤组(30例)。

表1 放射性皮肤损伤分级标准
1.5临床资料收集 通过医院电子病历系统收集患者临床资料:(1)一般资料:年龄、体质量指数(body mass index,BMI)、既往史、月经状态、肿瘤T分期、分子分型、化疗情况、放疗形式。(2)T淋巴细胞凋亡率:首次放疗前采集患者空腹肘部静脉血5 ml,加入肝素抗凝,将采集到的全血样本转移到试验管中,通过梯度密度离心法分离淋巴细胞,将细胞予标记染料处理,应用CytoFLEX S流式细胞仪(美国Thermo Fisher Scientific公司)进行检测。T淋巴细胞凋亡率=T淋巴细胞凋亡细胞数/T淋巴细胞总数×100%[7]。(3)首次放疗前实验室指标:白细胞(white blood cell,WBC)、中性粒细胞百分比(neutrophilic granulocyte percentage,NEU%)、血红蛋白(hemoglobin,Hb)、白蛋白(albumin,Alb)、血小板(platelet,PLT),采用BC-7500血常规分析仪(深圳迈瑞生物医疗电子股份有限公司)进行检测。
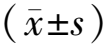
2 结果
2.1验证组与模型组临床资料比较 模型组发生急性放射性皮肤损伤1级79例,2级10例,发生率为74.79%(89/119)。验证组发生急性放射性皮肤损伤1级34例,2级4例,发生率为74.51%(38/51)。两组急性放射性皮肤损伤发生率及其他临床资料比较差异无统计学意义(P>0.05)。见表2。
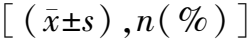
表2 验证组与模型组临床资料比较
2.2模型组发生急性放射性皮肤损伤的单因素分析结果 与无损伤组比较,损伤组BMI≥28 kg/m2、有糖尿病史、肿瘤T分期为T2期、三阴性乳腺癌、采用序贯瘤床电子线补量放疗形式的患者比例更大,CD4+T淋巴细胞凋亡率、Hb水平更高,差异有统计学意义(P<0.05)。见表3。
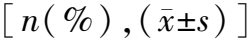
表3 模型组发生急性放射性皮肤损伤的单因素分析结果
2.3模型组发生急性放射性皮肤损伤的多因素logistic回归分析结果 以急性放射性皮肤损伤发生情况为因变量(无=0,有=1),以单因素分析中有统计学意义的指标作为自变量进行多因素logistic回归分析,结果显示,BMI≥28 kg/m2,有糖尿病史,肿瘤T分期为T2期,三阴性乳腺癌,放疗形式为序贯瘤床电子线补量放疗,以及较高的CD4+T淋巴细胞凋亡率及Hb水平是患者发生急性放射性皮肤损伤的独立危险因素(P<0.05)。见表4。
2.4急性放射性皮肤损伤风险预测模型的构建与验证 根据多因素logistic回归分析结果,纳入BMI、糖尿病史、肿瘤T分期、三阴性乳腺癌、放疗形式、CD4+T淋巴细胞凋亡率及Hb水平建立急性放射性皮肤损伤的列线图风险预测模型。见图1。经ROC曲线评估,对于模型组,该模型预测急性放射性皮肤损伤发生风险的曲线下面积(area under the curve,AUC)为0.942(95%CI:0.890~0.974),灵敏度为97.14%,特异度为86.24%。对于验证组,该模型预测急性放射性皮肤损伤发生风险的AUC为0.926(95%CI:0.880~0.966),灵敏度为86.36%,特异度为90.40%。见图2。
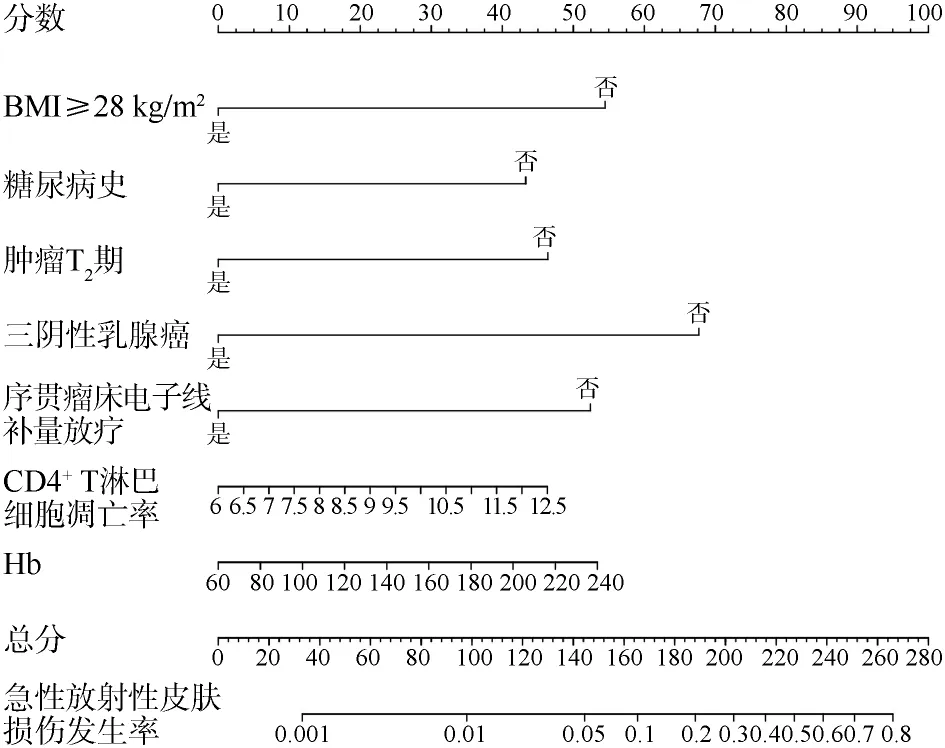
图1 预测急性放射性皮肤损伤风险的列线图模型
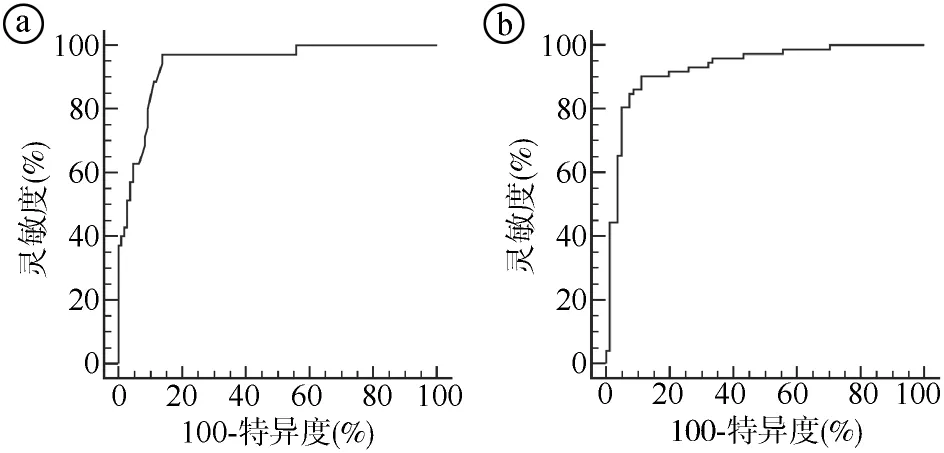
ⓐ模型组;ⓑ验证组
3 讨论
3.1放疗是肿瘤治疗最常用的方法之一,其以肿瘤细胞为靶点,通过辐射电离DNA链中的原子,诱导双链DNA断裂,杀灭肿瘤细胞。然而,目前放疗技术无法仅针对肿瘤细胞,在最大程度杀灭恶性肿瘤细胞的同时,应尽量减少对正常细胞的损伤[8]。与其他快速增殖的恶性肿瘤细胞不同,乳腺癌细胞与正常乳腺细胞具有相似的辐射敏感性及放射生物学效应。大分割放疗可在达到等效生物学剂量的前提下,缩短整体照射时间,节省时间及经济成本,且不增加正常组织放射损伤[9-10]。但大分割放疗的剂量仍然较高,引发的放射性皮肤损伤风险与常规分割放疗相比并未降低。辐射能量产生次级电子及活性氧可直接攻击表皮层细胞,在重复辐射的累积下炎性细胞大量聚集进一步损伤表皮层,辐射又可穿透攻击真皮层,增加组织胺释放,增强血管通透性并促进血管扩张,引发皮肤红斑,同时扰乱细胞分裂及再生过程。而皮肤仅能通过加快基底角质细胞有丝分裂进行代偿,新生细胞数量远远少于脱落死亡细胞数量,导致皮肤增厚、硬化,皮肤屏障功能削弱,最终坏死。放射性皮肤损伤可增加潜在的感染风险,使放疗被迫中断或延迟放疗时间[11]。因此,筛选放射性皮肤损伤中高危患者,并及时予以干预具有重要的临床意义。
3.2本研究的多因素logistic回归分析结果显示,BMI≥28 kg/m2,有糖尿病史,肿瘤T分期为T2期,三阴性乳腺癌,放疗形式为序贯瘤床电子线补量放疗,以及较高的CD4+T淋巴细胞凋亡率及Hb水平是患者发生急性放射性皮肤损伤的独立危险因素。分析其原因为:(1)BMI≥28 kg/m2的肥胖患者,因其乳腺体积相对较大,放疗过程中乳腺受照体积大,故更容易发生急性放射性皮肤损伤。Patel等[12]针对502例接受大分割放疗的乳腺癌患者的分析结果也证实了BMI是急性放射性皮肤损伤的独立影响因素。(2)合并糖尿病的患者在周围神经病变及微血管病变的影响下,皮肤营养不足,在放疗中易损伤黏膜管壁,加之该类患者通常存在不同程度的动脉粥样硬化,放射性皮肤损伤的发生风险进一步增加。徐璐等[13]研究显示,合并糖尿病的乳腺癌根治术后患者急性放射性皮炎发生率较高,血糖控制不良的患者更易发生急性放射性皮肤损伤。(3)本研究中入组的乳腺癌患者肿瘤T分期为T1~T2期,放疗靶区照射范围为全乳和瘤床,不包括淋巴引流区。肿瘤T分期越高表明肿瘤细胞浸润越深,手术需切除组织越多,残存皮肤组织越少,皮肤保护屏障作用也越低,其所承受的放射性损伤也更严重。Chugh等[14]认为,肿瘤T分期与急性放疗引起的皮肤黏膜毒性密切相关,可能干扰治疗方案,影响患者生活质量。(4)乳腺癌根据免疫组化指标划分出不同的分子分型[15]。有研究认为三阴性乳腺癌患者对化疗敏感性更强[16],但其机制尚不明确,有待进一步研究和证实。(5)本中心根据患者术中是否放置金属标记瘤床,在大分割放疗时采用两种治疗形式:瘤床同步补量大分割调强放疗;先行全乳大分割调强放疗,之后序贯瘤床电子线补量放疗。研究结果显示采用序贯瘤床电子线补量放疗者更容易发生急性放射性皮肤损伤,这与Forster等[17]的研究结果一致。其原因可能在于序贯瘤床电子线补量放疗是根据临床经验和术前影像确定原肿瘤所在位置及深度,之后制定照射范围、摆位方式及电子线照射能量,但不能客观地从放疗计划评估实际照射剂量,因此可能造成照射野内瘤床和皮肤的实际受照范围、受照剂量超出预定。有学者提出保乳术后患者发生急性放射性皮肤损伤与放疗剂量密切相关[18]。(6)CD4+T淋巴细胞是机体免疫应答的主要效应细胞,与B细胞相互配合生成抗体,参与机体免疫[19]。放疗可通过上调肿瘤相关抗原表达,增强肿瘤基质免疫介导,降低CD4+T淋巴细胞活性,从而影响机体免疫水平,导致放射性皮肤损伤发生率升高。国外有研究表明放疗所致淋巴细胞凋亡与乳腺癌放疗所带来的放射性毒副反应相关[20]。(7)Hb能够将氧气输送到人体的器官和组织,其水平较低时可能会引发乏氧细胞增多,对放射线产生抗拒,降低疗效。尽管提高Hb水平可改善放疗效果,但会增强正常组织器官对放射线的敏感性,从而增加放射性皮肤损伤风险[21]。
3.3本研究根据多因素logistic回归分析筛选出的指标建立了预测乳腺癌保乳术后急性放射性皮肤损伤的列线图模型,ROC曲线结果显示其具有较高的预测效能。列线图模型可以将复杂的回归方程转变为简单且可视化的图形,方便临床医师对患者进行评估,并提供个性化的风险评估和治疗建议,从而提高临床决策的质量和效率,降低急性放射性皮肤损伤发生率和严重程度,确保患者放疗能够如期进行。
综上所述,BMI、糖尿病史、肿瘤T分期、三阴性乳腺癌、放疗形式、CD4+T淋巴细胞凋亡率及Hb水平是乳腺癌保乳术后急性放射性皮肤损伤的独立影响因素。根据上述指标建立的列线图模型可对急性放射性皮肤损伤发生风险进行定量评估,预测效能高,有较好的临床应用价值。
