人脂肪间充质干细胞来源外泌体联合黄芪多糖对心肌损伤保护机制研究
2024-01-10郭彩茹刘欣欣牛宇杰贾富鑫
郭彩茹, 刘欣欣, 牛宇杰, 贾富鑫
急性心肌梗死(acute myocardial infarction,AMI)发病急,病死率高,严重威胁人类健康。再灌注治疗可使AMI患者预后得到改善,但缺血再灌注也会损伤机体组织。有研究发现,AMI患者即使接受及时的再灌注治疗,住院死亡率仍有5.4%,住院期间心力衰竭发生率达14.2%,缺血再灌注损伤是影响患者最终梗死面积和预后的重要因素[1]。因此,减轻AMI患者缺血再灌注损伤,改善患者的预后,是目前心血管领域亟待解决的难题。有研究显示,人脂肪间充质干细胞来源外泌体(human adipose mesenchymal stem cell-derived exosomes,Exosome-HADSCs)可通过促细胞存活,促进血管生成、抗炎、免疫调节和抑制纤维化,改善心肌功能,在预防或治疗心血管疾病方面具有巨大的应用潜力[2-4]。但是,Exosome-HADSCs治疗仍存在治疗靶向性欠佳的问题,且在心肌缺血、缺氧的环境下,仅凭少量的外泌体难以从根本上改善心肌梗死区以及梗死边缘区恶劣的微环境。黄芪多糖(astragalus polysaccharides,APS)是从豆科植物黄芪干燥根茎中提取的一种水溶性杂多糖,已被证实具有降血脂、抗炎和抗氧化等作用[5]。本课题组的前期研究表明APS对心肌细胞过氧化氢损伤有保护作用[6]。也有研究应用APS来干预干细胞,结果显示APS可通过动员干细胞迁移、促进增殖、诱导分化及干预外泌体的方式,增强干细胞移植修复梗死心肌的治疗效果,改善心脏功能[7-9]。因此推测APS有可能通过改善局部微环境的炎症反应、降低细胞凋亡、促进血管再生等方面,提高Exosome-HADSCs治疗的有效率,从而加强Exosome-HADSCs的心肌保护作用。本研究通过心肌细胞AC16体外氯化钴(CoCl2)损伤模型探索Exosome-HADSCs联合APS在心肌损伤修复中的作用,旨在为进一步改善AMI患者预后提供新的思路和治疗靶点。现报道如下。
1 材料与方法
1.1实验细胞及主要试剂 AC16细胞购自赛百慷(上海)生物技术股份有限公司。DMEMF/12细胞培养基、胎牛血清(fetal bovine serum,FBS)购自Gibco公司。人脂肪间充质干细胞(human adipose mesenchymal stem cells,HADSCs)、人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),以及无外泌体的HADSCs专用培养基、HUVECs专用培养基购自OriCell赛业(广州)生物科技有限公司。外泌体提取试剂盒购自于郑州贝贝生物科技有限公司。CD63、肿瘤易感基因101(tumor susceptibility gene 101,TSG101)、CD9一抗购自武汉三鹰生物技术有限公司。半胱氨酸天冬氨酸蛋白酶3(caspase-3)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关x蛋白(Bcl-2 associated x protein,Bax)、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)、磷酸化磷脂酰肌醇-3-激酶(phosphated phosphatidylinositol-3-kinase,p-PI3K)、苏氨酸-丝氨酸蛋白激酶(serine-threonine kinase,Akt)、GAPDH一抗,以及辣根过氧化物酶标记的羊抗兔IgG H&L购自北京博奥森生物技术有限公司。ECL化学发光检测试剂盒购自苏州新赛美生物科技有限公司。APS、CoCl2、全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、CCK8试剂盒、磷酸缓冲盐溶液(phosphate buffered saline,PBS)购自北京索莱宝科技有限公司。细胞膜红色荧光染色试剂盒(DiI)购自上海碧云天生物技术有限公司。PVDF膜购自Millipore公司。Matrigel基质胶购自于美国BD公司。
1.2主要仪器 二氧化碳培养箱(Thermo,型号:3111)。透射电镜(Hitachi,型号:HT7700)。荧光显微镜(徕卡,型号:DMI4000B)。酶标仪(PerkinElmer,型号:VICTOR X3)。电泳仪(Bio-Rad,型号:Bio-Rad Mini-PROTEANTetra Systems)。蛋白转印仪(Bio-Rad,型号:Bio-Rad Mini Trans-Blot)。凝胶成像仪(上海天能,型号:Tanon 5200 Multi)。
1.3细胞培养 AC16细胞使用含10% FBS和1%青霉素-链霉素双抗的DMEMF/12培养基进行培养,HADSCs和HUVECs使用对应的专用培养基进行培养。细胞培养箱条件设置为37 ℃,5% CO2。每2~3 d换一次液,待细胞生长密度达80%~90%时进行传代。
1.4Exosome-HADSCs提取、鉴定及内化实验 收集传代培养48 h、处于对数生长期的HADSCs细胞培养上清液,按照外泌体提取试剂盒说明书步骤提取Exosome-HADSCs。使用透射电镜对提取的Exosome-HADSCs进行形态学观察。通过Western blot实验检测Exosome-HADSCs特异性标志物CD9、CD63、TSG101的表达情况。按照细胞膜红色荧光染色试剂盒(DiI)说明书步骤标记外泌体,将标记的外泌体与AC16细胞共孵育4 h,弃上清。以DAPI核染5 min,PBS清洗3次,荧光显微镜下拍照,观察AC16内化外泌体情况。
1.5血管形成实验评估HUVECs成管能力 将Matrigel基质胶用无血清培养基按1∶2稀释,在冰上铺于96孔板内,60~70 μl/孔,置于37 ℃培养箱中孵育30 min。取对数生长期HUVECs,分别用培养基(control组)、含20 μg/ml Exosome-HADSCs培养基(Exo组)、含100 μg/ml APS培养基(APS组)、含20 μg/ml Exosome-HADSCs+100 μg/ml APS培养基(Exo+APS组)进行重悬,调整密度为4×105cells/ml,取100 μl接种于Matrigel基质凝胶表面,培养箱中继续孵育4 h后在显微镜下观察、拍照。使用ImageJ软件对各组形成血管网格数量进行统计,每组3个复孔,行3次独立重复实验。
1.6划痕实验评估HUVECs细胞迁移能力 取对数生长期HUVECs进行胰酶消化,离心后按方法1.5的分组方法进行处理,调整细胞密度为3×105cells/ml,每孔2 ml,种植于6孔板中。待细胞贴壁后用无菌1 ml移液枪头在细胞中央均匀划1条痕,用PBS洗去漂浮细胞,换新鲜培养基,显微镜下拍照记录。将6孔板放置于培养箱继续培养,于24 h、48 h时间点在显微镜下拍照记录。使用ImageJ软件计算不同时间点的划痕面积,48 h细胞迁移率=(0 h划痕面积-培养48 h后划痕面积)/0 h划痕面积×100%。每组3个复孔,行3次独立重复实验。
1.7心肌缺氧损伤构建与修复实验分组 通过500 μmol/L氯化钴(CoCl2)处理AC16心肌细胞12 h构建心肌缺氧损伤模型。取对数生长期AC16细胞用不含FBS的DMEMF/12培养基进行饥饿处理12 h后按下述方法进行干预。(1)control组:正常培养AC16细胞,不进行CoCl2损伤处理;(2)CoCl2组:CoCl2(500 μmol/L)损伤处理12 h后,用不含Exosome-HADSCs和APS的培养基继续培养48 h;(3)CoCl2+Exo组:CoCl2(500 μmol/L)损伤处理12 h后,用含Exosome-HADSCs(20 μg/ml)的培养基修复48 h;(4)CoCl2+APS组:CoCl2(500 μmol/L)损伤处理12 h后,用含APS(100 μg/ml)的培养基修复48 h;(5)CoCl2+Exo+APS组:用CoCl2(500 μmol/L)损伤处理12 h后,用含Exosome-HADSCs(20 μg/ml)和APS(100 μg/ml)培养基修复48 h。
1.8CCK8实验评估AC16细胞存活率 取对数生长期AC16细胞5×104cells/ml,100 μl/孔接种至96孔板,按照方法1.7的分组及干预方法进行处理,结束后每孔加10 μl CCK8试剂,培养箱中孵育2 h。用酶标仪检测450 nm波长处吸光度值(OD值)。细胞存活率(%)=(实验组OD值-空白孔OD值)/(control组OD值-空白孔OD值)×100%。每组3个复孔,行3次独立重复实验。
1.9Tunel细胞凋亡实验检测AC16细胞凋亡情况 取对数生长期AC16细胞1×105cells/ml,1 ml/孔接种至24孔板,按照方法1.7的分组及干预方法进行处理,结束后弃上清液,PBS清洗3次。加入200 μl/孔Tunel工作液,室温下避光孵育30 min,弃工作液。加入DAPI,室温避光染色5 min,PBS清洗3次。立即于荧光显微镜下进行观察、拍照,视野中DAPI蓝染为细胞核,Tunel红染为发生凋亡的细胞。使用ImageJ软件统计细胞数量,细胞凋亡率=每个视野中红染凋亡细胞数/蓝染细胞数×100%。每组细胞计数5个视野,取平均值。每组3个复孔,行3次独立重复实验。
1.10Western blot检测凋亡相关蛋白及PI3K/Akt信号通路相关蛋白表达水平 取对数生长期AC16细胞按照6×105cells/孔接种于6孔板中,按照方法1.7的分组及干预方法进行处理AC16细胞,胰酶消化细胞。按照全蛋白提取试剂盒步骤提取各组细胞蛋白,使用BCA蛋白分析试剂盒测定蛋白浓度,调整各组蛋白浓度一致。取15 μg蛋白,用10%的SDS-PAGE凝胶电泳(80~120 V)分离蛋白,在300 mA、90 min的条件下将蛋白转移至PVDF膜。用5%脱脂牛奶室温封闭处理PVDF膜1 h。加入caspase-3、Bax、Bcl-2、PI3K、p-PI3K、Akt、GAPDH一抗液(1∶1 000稀释),4 ℃条件下避光孵育过夜。TBST液洗膜3次,10 min/次,加入二抗液(1∶1 000稀释),室温避光孵育1 h。TBST溶液洗膜3次,10 min/次。滴加ECL发光液后用凝胶成像仪进行拍照,以GAPDH为内参,使用ImageJ软件对蛋白条带进行定量分析。重复3次独立实验。
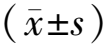
2 结果
2.1Exosome-HADSCs鉴定及内化结果 经过磷钨酸染色,透射电子显微镜下可见的Exosome-HADSCs直径70~150 nm,呈圆形或椭圆形,呈“杯托”样结构的囊形小泡,见图1ⓐ。Western blot实验结果显示其外泌体标记蛋白CD9、CD63和TSG101呈阳性表达,见图1ⓑ。提示成功提取到外泌体。红色荧光染料DiI标记的外泌体与AC16细胞共孵育4 h后,荧光显微镜下显示外泌体分布在AC16细胞核周围,提示外泌体被AC16细胞摄取,见图2。
ⓐ透射电子显微镜下所见(箭头所指为Exosome-HADSCs);ⓑWerstern blot实验结果图

图2 DiI标记的Exosome-HADSCs内化实验结果图(×400)
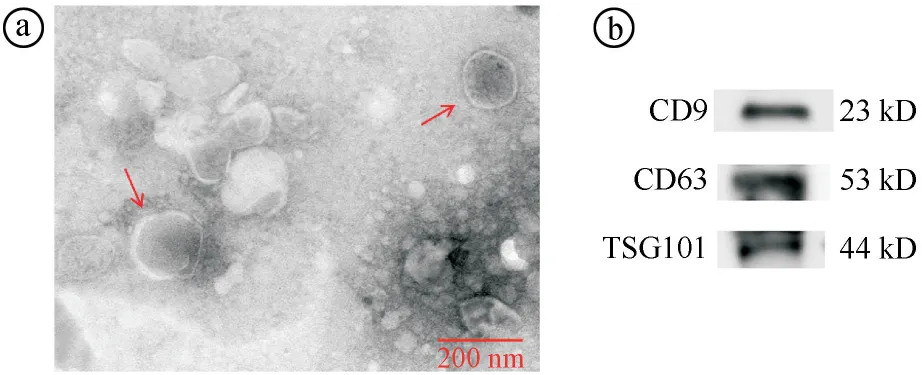
2.2Exosome-HADSCs联合APS对HUVECs血管形成的影响结果 与control组相比,Exo组、APS组和Exo+APS组形成血管网格数量显著增多(P<0.05),且Exo+APS组形成血管网格的数量显著多于Exo组和APS组(P<0.05)。见图3。
ⓐHUVECs细胞血管形成实验结果图(×100);ⓑ四组形成血管网格数量比较(F=312.400,P<0.001;*P<0.05)
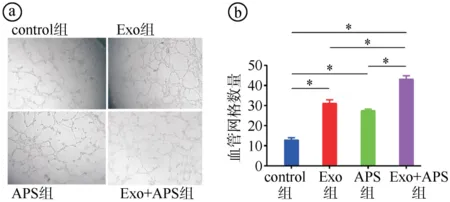
2.3Exosome-HADSCs联合APS对HUVECs迁移能力的影响结果 划痕实验结果显示,与control组相比,Exo组、APS组和Exo+APS组的HUVECs细胞迁移率更高,差异有统计学意义(P<0.05),且Exo+APS组细胞迁移率较Exo组和APS组更高,差异有统计学意义(P<0.05)。见图4。
ⓐ划痕实验结果图(×50);ⓑ四组细胞迁移率比较(F=87.010,P<0.001;*P<0.05)
2.4Exosome-HADSCs联合APS对心肌细胞存活率的影响结果 与control组相比,CoCl2组细胞存活率显著降低(P<0.05)。与CoCl2组相比,CoCl2+Exo组、CoCl2+APS组和CoCl2+Exo+APS组的细胞存活率提高,且CoCl2+Exo+APS组的细胞存活率较CoCl2+Exo组和CoCl2+APS组更高,差异有统计学意义(P<0.05)。见图5。
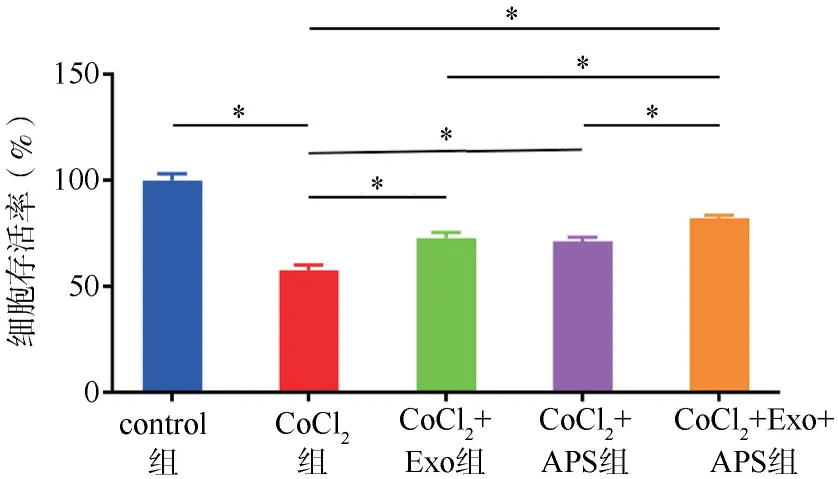
注:F=175.600,P<0.001;*P<0.05
2.5Exosome-HADSCs联合APS对AC16心肌细胞凋亡的影响结果 Tunel实验结果显示,与control组相比,CoCl2组细胞凋亡率显著增高(P<0.01),提示心肌缺氧损伤模型构建成功。与CoCl2组相比,CoCl2+Exo组、CoCl2+APS组和CoCl2+Exo+APS组的细胞凋亡率更低,且CoCl2+Exo+APS组的细胞凋亡率较CoCl2+Exo组和CoCl2+APS组更低,差异有统计学意义(P<0.05)。见图6。Western blot实验结果显示,与control组相比,CoCl2组caspase-3、Bax蛋白表达水平增高,Bcl-2蛋白表达水平降低,差异有统计学意义(P<0.05)。与CoCl2组相比,CoCl2+Exo组、CoCl2+APS组、CoCl2+Exo+APS组caspase-3、Bax蛋白表达水平显著降低(P<0.05),Bcl-2蛋白表达水平显著升高(P<0.05),且CoCl2+Exo+APS组表达水平变化趋势更明显。见图7。
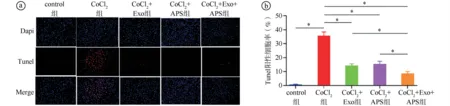
ⓐTunel实验结果图(×100);ⓑ五组细胞凋亡率比较(F=250.700,P<0.001;*P<0.05)
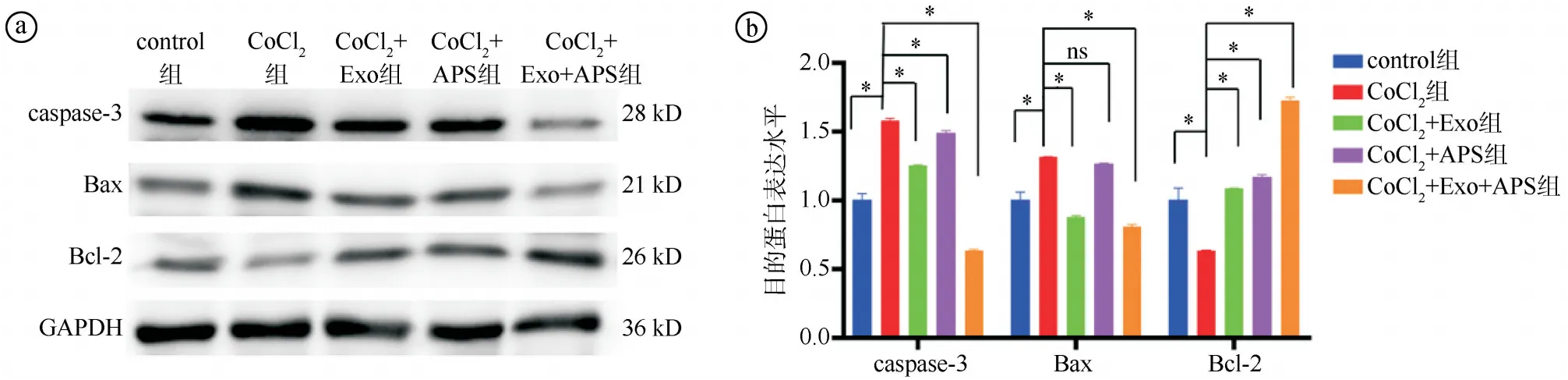
ⓐWestern blot实验结果图;ⓑ五组caspase-3、Bax、Bcl-2蛋白表达水平比较(F=632.200,P<0.001;F=194.600,P<0.001;F=260.300,P<0.001;*P<0.05,ns为P>0.05)
2.6Exosome-HADSCs联合APS对PI3K-Akt信号通路的影响结果 Western blot实验结果显示,与CoCl2组相比,CoCl2+Exo组、CoCl2+APS组和CoCl2+Exo+APS组的PI3K、p-PI3K、Akt蛋白表达水平均显著上升(P<0.05),且CoCl2+Exo+APS组的表达水平上升趋势更明显(P<0.01)。见图8。
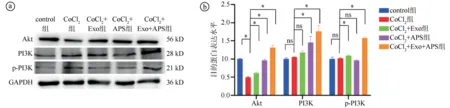
ⓐWestern blot实验结果图;ⓑ五组Akt、PI3K、p-PI3K蛋白表达水平比较(F=184.400,P<0.001;F=25.240,P<0.001;F=236.500,P<0.001;*P<0.05,ns为P>0.05)
3 讨论
3.1外泌体是主动或被动释放到细胞外的直径30~150 nm的纳米级囊泡,其生成以后便以胞吐形式从细胞内释放到细胞外[10-12]。干细胞主要是通过旁分泌途径发挥作用,其中外泌体起到重要作用,外泌体通过介导miRNA与相关蛋白或靶基因的表达,在抑制心肌细胞凋亡、抗心肌组织纤维化、促进血管新生、促进内源性细胞修复、减缓心室重构、改善心功能方面发挥作用[13-15]。APS由豆科植物蒙古黄芪的干燥根茎无菌提取,具有抗氧化、抗炎、免疫调节、抗肿瘤及抗病毒等多重作用[16-18]。
3.2AMI是一种危重疾病,通常伴有血管生成功能障碍[19]。在心肌缺血期间,为心脏供血的血管变窄,导致心脏血液和营养供应不足[2]。有研究表明,间充质干细胞外泌体中的缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)过表达能够促进受损的血管生成、迁移和增殖,并通过上调促血管生成因子和促进新血管形成来发挥心脏保护作用[19]。本研究HUVECs血管形成实验结果显示,与control组相比,Exosome-HADSCs、APS干预均可增加HUVECs生成血管网格的数量,且Exosome-HADSCs联合APS处理的效果更加显著。HUVECs划痕实验结果显示,与control组相比,Exosome-HADSCs、APS均可促进HUVECs的迁移,Exosome-HADSCs联合APS干预可进一步促进HUVECs迁移。因此推测在心肌缺血再灌注损伤过程中,Exosome-HADSCs联合APS可能通过促进内皮细胞血管生成和迁移,从而减少心肌细胞凋亡。
3.3细胞凋亡是由多基因调控的细胞自主的有序的死亡过程。其中Bcl-2为抑凋亡因子,Bax为促凋亡因子。Bcl-2主要在凋亡的上游发挥作用,它能够与Bax蛋白结合形成异二聚体,抑制Bax蛋白的促凋亡作用[20]。caspases家族是细胞凋亡过程中的调控因子,其中caspase-3被认为是介导细胞凋亡的重要因子之一[21]。有研究显示,间充质干细胞外泌体可显著降低凋亡标志物caspase-3、Bcl-2关联死亡启动子(Bcl-2 associated death promoter,Bad)和Bax的表达水平,并上调心肌梗死大鼠的抗凋亡因子Bcl-2的水平[22]。本课题组的前期研究发现APS能够有效降低过氧化氢引起的心肌细胞凋亡并调节凋亡相关基因和蛋白的表达[6]。本研究也得出相似的结论,Exosome-HADSCs联合APS干预可降低经CoCl2损伤处理的AC16心肌细胞的凋亡率,且作用效果较单独使用Exosome-HADSCs或APS干预更加显著。这可能是因为APS具有抗炎、抗氧化应激作用,可以协同提高Exosome-HADSCs抗心肌细胞凋亡的效果。
3.4PI3K/Akt途径是一种细胞内信号转导途径,响应细胞外信号,促进代谢、增殖、细胞存活、生长和血管生成等生物学行为。有研究表明骨髓间充质干细胞来源的外泌体通过PI3K/Akt途径减轻过氧化氢诱导的心肌损伤[23]。间充质干细胞外泌体可通过提升腺嘌呤核苷三磷酸(adenosine-triphosphate,ATP)水平,减少氧化应激并激活PI3K/Akt通路增强心肌活力,减轻缺血再灌注后的不良心脏重塑[24]。陈广琴等[25]的研究发现APS可通过PI3K/Akt/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路抑制自噬改善心肌细胞凋亡。本研究也观察到Exosome-HADSCs联合APS在修复CoCl2损伤的心肌细胞过程中,PI3K、p-PI3K、Akt蛋白的表达水平均显著升高,说明Exosome-HADSCs联合APS可能通过PI3K/Akt途径抑制心肌细胞的凋亡和促进心肌细胞增殖。
综上所述,Exosome-HADSCs联合APS可能是一种潜在的心血管疾病治疗方式,其保护作用可能是通过激活PI3K/Akt通路实现,研究结果为临床中西医结合治疗缺血再灌注后的心肌损伤提供了理论依据。
