一株海洋真菌与细菌共培养次级代谢产物的研究
2024-01-09朱夏濠郝宝聪李申奥徐奥翔王梦如
朱夏濠, 郝宝聪, 郑 杨, 李申奥, 徐奥翔, 王梦如, 陈 敏
(扬州大学环境科学与工程学院, 江苏扬州 225127)
海洋微生物,尤其是海洋真菌,是获得结构新颖、生物活性显著的次级代谢产物的重要来源,为海洋药物先导化合物的筛选和发现提供了丰富的活性模板分子[1]。然而,随着对海洋真菌研究的不断深入,部分菌株被重复研究,已知化合物的重复分离率逐渐增加,新化合物的发现概率逐年降低。研究[2]表明,在传统的试验培养条件下,微生物只进行一些常规基因的表达,其体内大部分编码化合物的基因是处于沉默状态的。因此,为从微生物中分离得到更多的结构新颖的化合物,就必须想方设法激活微生物的沉默基因。共培养策略是利用微生物群落中的种间相互作用,来激发微生物沉默基因簇表达的一种直接有效且简便易行的方法[3-4]。本研究采用共培养技术,将海洋真菌PenicilliumjanthinellumHK1-6与耐甲氧西林金黄色葡萄球菌(Staphylococcusaureus) ATCC 43300共培养,并对其共培养次级代谢产物进行分离与结构鉴定,为新型抗生素类化合物的发现提供有效方法。
1 材料与方法
1.1 仪器与试剂
Micromass Q-TOF高分辨质谱仪(美国 Waters公司); Bruker amazon SL离子阱液质联用仪(德国BRUKER公司); AVANCE 600/400核磁共振仪(德国BRUKER公司); WTF-203B暗箱式紫外分析仪(上海精科实业有限公司); KQ-250E超声波清洗器(昆山市超声仪器公司); QYC-2112B双层摇床(上海沪粤明科学仪器公司); CR21GIII超高速低温冷冻离心机(日本HITACHI公司); L-2000高效液相色谱仪(HPLC) (日本HITACHI公司)。硅胶薄层层析板(烟台江友硅胶开发公司); 柱层析硅胶48~75 μm (青岛海洋化工公司); Sephadex LH-20 (美国Amersham Biosciences公司); ODS反相硅胶(香港优尼康公司); 色谱纯甲醇(天津四友精细化学品公司)。
1.2 菌株来源
海洋真菌HK1-6分离于海南东寨港红树林自然保护区的海桑根际土壤样品,经分子生物学及形态学鉴定为微紫青霉(Penicilliumjanthinellum)[5], GenBank登录号为KY412802。真菌P.janthinellumHK1-6 与耐甲氧西林金黄色葡萄球菌(S.aureus) ATCC 43300均保存于扬州大学海洋科学与技术研究所。
1.3 发酵、提取与分离
1) 发酵: 采用PDB-LB培养基(每1 L纯净水中加入10 g葡萄糖, 100 g土豆浸出液, 2.5 g酵母膏, 15 g海盐, 5 g蛋白胨, 2.5 g NaCl, pH 7.0)进行发酵, 每400 mL培养基中接种1 mL真菌以及接种耐甲氧西林金黄色葡萄球菌(吸光度为0.5) 200 μL, 共发酵液15 L, 于28 ℃摇床(140 r·min-1)上培养2周。
2) 提取: 利用超高速低温冷冻离心机对菌体与发酵液进行分离(8 000 r·min-1离心5 min), 取上清发酵液,用等体积的乙酸乙酯萃取3次,减压浓缩后得到乙酸乙酯提取物7.5 g。
3) 分离: 上述提取物采用减压硅胶柱层析,以石油醚-乙酸乙酯、乙酸乙酯-甲醇为溶剂进行梯度洗脱,分为12个组分(Fr.1-Fr.12), 再经反复的正、反相硅胶柱层析、Sephadex LH-20柱层析及HPLC分离纯化,最终分别从Fr.2中分离得到化合物4(6.3 mg); 从Fr.3中分离得到化合物3(12.1 mg); 从Fr.4中分离得到化合物2(2.3 mg); 从Fr.6中分离得到化合物1(9.2 mg)和化合物5(12.0 mg)。
1.4 LC-MS/MS测试与分子网络分析
采用超高效液相色谱-高分辨质谱联用仪对提取物进行检测。色谱柱为YMC-Park-C18column (5 μm, 250 mm×4.6 mm)。流动相为甲醇与水,流速为0.8 mL·min-1, 梯度洗脱条件如下: 0~7 min, 30%~70%甲醇; 7~14 min, 70%~85%甲醇; 14~20 min, 85%~90%甲醇; 20~25 min, 90%~95%甲醇; 25~27 min, 95%甲醇。进样量为8 μL。质谱采用正离子模式,离子源为ESI源。
将mzXML格式的质谱数据上传至GNPS分子网络平台构建分子网络。具体参数设置: 前体离子质量误差值2.0 Da, 碎片离子质量误差值0.5 Da, 匹配的二级质谱碎片峰≥6, 节点之间相关余弦值≥ 0.7。 最终生成的质谱分子网络图借助Cytoscape软件实现可视化。
2 结果与分析
2.1 化合物结构鉴定
化合物1为白色粉末。其核磁共振氢谱(1H NMR)和碳谱(13C NMR)表明结构中含有一个吲哚片段及一个羧基(δC173.5)。具体核磁数据如下:1H NMR (400 MHz, DMSO-d6)δH10.90 (1H, s, NH), 7.49 (1 H, d,J=8.0 Hz, 7-H), 7.34 (1 H, d,J=8.0 Hz, 4-H), 7.22 (1H, d,J=2.4 Hz, 2-H), 7.07 (1H, td,J=8.0, 1.2 Hz, 5-H), 6.97 (1H, td,J=8.0, 1.2 Hz, 6-H), 3.62 (2H, s, 10-H);13C NMR (100 MHz, DMSO-d6)δC173.5 (C, C-1), 136.1 (C, C-9), 127.3 (C, C-8), 123.9 (C, C-2), 121.0 (CH, C-6), 118.6 (CH, C-7), 118.4 (CH, C-5), 111.3 (CH, C-4), 107.8 (C, C-3), 31.2 (CH2, C-10)。以上波谱数据与文献[5]报道基本一致,因此鉴定化合物1为吲哚-3-乙酸(indole-3-aceticacid)。
化合物2为无色针状结晶化合物,核磁数据如下:1H NMR (400 MHz, DMSO-d6)δH7.89 (1H, s, 4-OH), 5.41 (1H, brs, 6-Ha), 5.32 (1H, brs, 6-Hb), 5.13 (1H, s, 2-H), 3.86 (3H, s, 3-OCH3), 1.66 (3H, s, H-7);13C NMR (100 MHz, DMSO-d6)δC170.4 (C, C-1), 140.8 (C, C-5), 115.9 (CH2, C-6), 102.8 (C, C-4), 89.9 (CH, C-2), 60.28 (CH3O, C-8), 17.56 (CH3, C-7)。以上波谱数据与文献[6]报道基本一致,因此鉴定化合物2为青霉酸(penicillic acid)。
化合物3为淡黄色油状物,是一个对称结构,核磁数据仅出现一半信号。其氢谱如下:1H NMR (400 MHz, DMSO-d6)δH11.48 (2H, s, 3-OH, 3′-OH), 6.83 (2H, brs, 2-H, 2′-H), 6.59 (2H, brs, 4-H, 4′-H), 6.03 (2H, d,J=2.6 Hz, 6-H, 6′-H), 2.02 (6H, s, 5-H, 5′-H)。以上波谱数据与文献[7]报道基本一致,因此鉴定化合物3为二苯醚类化合物diorcinol。
化合物4为棕红色油状物。其结构存在对称轴,部分核磁数值重叠,具体核磁数据如下:1H NMR (acetone-d6, 600 MHz)δH9.03 (1H, s, 3-OH), 6.01 (1H, s, H-4),5.95 (1H, s, H-2), 2.15 (3H, s, H-7);13C NMR (acetone-d6,150 MHz)δC158.4 (C, C-1, C-3), 139.7 (C, C-5), 107.4 (C, C-4, C-6), 99.6 (C, C-2), 20.6 (CH3, C-7)。结合文献[8]数据,确定化合物4为苯酚类化合物orcinol。化合物4是化合物3的单体结构。
化合物6为棕色油状物。高分辨质谱HR-ESI-MS给出m/z464.2562 [M+H]+, 提示分子式为C27H33N3O4(C27H34N3O4+理论值为464.2544)。其核磁数据如下:1H NMR (acetone-d6, 600 MHz)δH7.16 (1H, d,J=8.4 Hz, H-4), 6.70 (1H, d,J=8.4 Hz, H-5), 6.38 (1H, d,J=7.8 Hz, H-24), 4.98 (1H, d,J=7.8 Hz, H-25), 4.28 (1H, brs, Ha-12), 3.91 (1H, brs, Ha-16), 3.41 (1H, brs, Hb-12), 3.16 (1H, overlapped, H-20), 3.03 (1H, m, Hb-16), 2.52 (1H, brs, Ha-10), 2.42 (1H, m, Ha-15), 2.33 (1H, brs, Hb-10), 2.24 (1H, m, Ha-19), 2.10 (1H, m, Hb-19), 2.08 (1H, m, Hb-15), 1.80 (1H, m, H-14), 1.50 (3H, s, H-17), 1.43 (3H, s, H-27), 1.41 (3H, s, H-28), 1.14 (3H, s, H-22), 0.88 (3H, s, H-23);13C NMR (acetone-d6, 150 MHz)δC182.8 (C, C-2), 168.6 (C, C-18), 147.5 (C, C-6), 140.0 (CH, C-24), 136.5 (C, C-7), 134.6 (C, C-8), 125.8 (C, C-9), 122.1 (CH, C-4), 117.8 (CH, C-5), 116.1 (CH, C-25), 80.4 (C, C-26), 72.2 (C, C-13),65.0 (C, C-11), 63.6 (C, C-3), 57.6 (CH2, C-12), 53.5 (CH2, C-16), 52.3 (CH, C-20), 46.7 (C, C-21), 38.5 (CH2, C-15), 36.0 (CH2, C-10), 30.6 (CH3, C-28), 30.4 (CH3, C-27), 23.9 (CH, C-14), 23.1 (CH3, C-23), 20.8 (CH2, C-19), 20.5 (CH3, C-22), 12.4 (CH3, C-17)。通过与文献[9]数据对比,确定该化合物为吲哚生物碱类化合物paraherquanide N。
2.2 化合物结构
采用共培养技术,将海洋真菌P.janthinellumHK1-6与耐甲氧西林金黄色葡萄球菌(S.aureus) ATCC 43300共培养,并对其共培养次级代谢产物进行分离与结构鉴定,最终获得5个化合物(图1), 包括吲哚-3-乙酸(1)、青霉酸(2)、二苯醚类化合物diorcinol (3)、苯酚类化合物orcinol (4)以及吲哚生物碱类化合物paraherquanide N (5)。运用液质联用技术(LC-MS)获得共培养产物的二级质谱(MS/MS), 通过全球天然产物分子网络(GNPS)平台形成质谱-分子网络,又鉴定了处于吲哚生物碱类分子簇中的 3 个化合物notoamide B (6)、paraherquanide F (7)及paraherquamide E (8)(图1)。
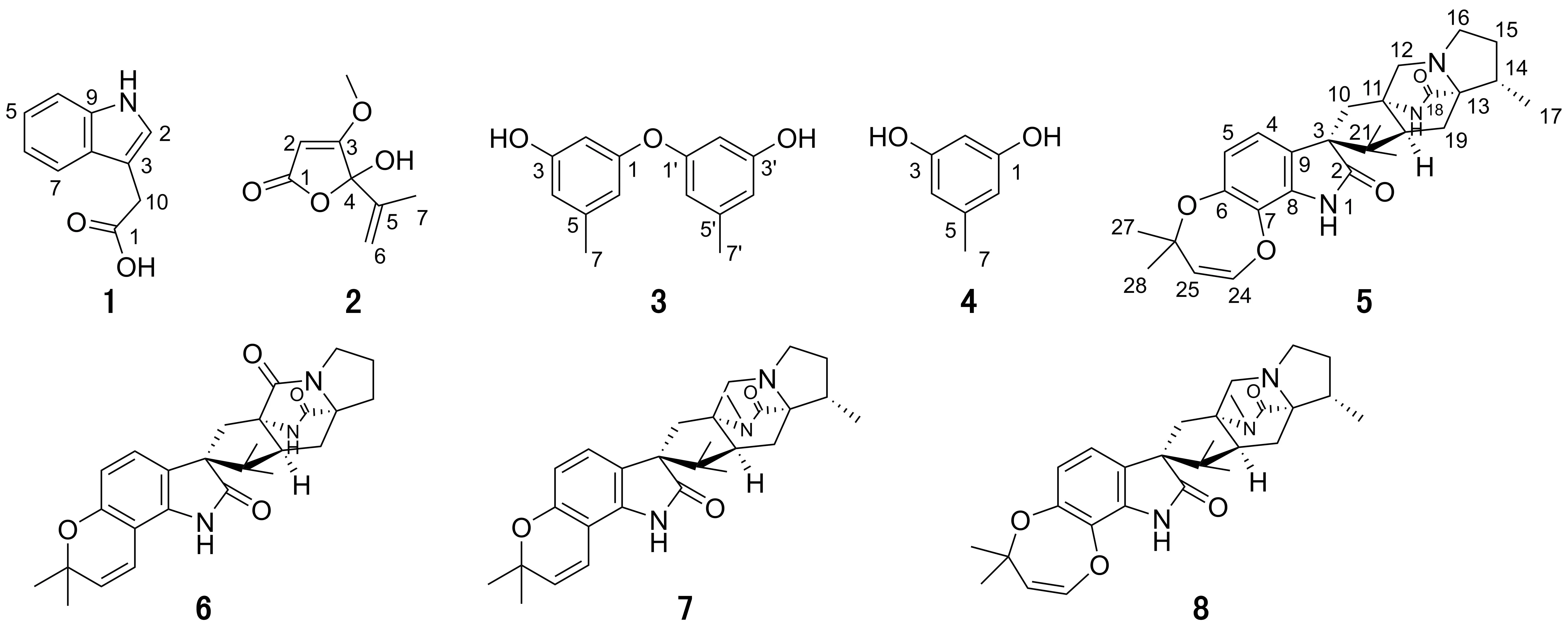
图1 化合物1-8的结构Fig.1 Structures of compounds 1-8
2.3 抗菌活性测试
本课题组在前期研究[10-11]中已测试化合物2和3的抗菌活性, 2个化合物均显示出较强的抗菌活性,尤其是化合物2显示出对S.aureusATCC 43300的强抗菌活性。本研究采用滤纸片法[12]测试了化合物1、4、5的抗菌活性,遗憾的是当浓度为100 μg·片-1时, 3个化合物对测试菌株均没有显示出抗菌活性。
2.4 质谱-分子网络分析
本研究采用基于 LC-MS/MS 的分子网络技术对共培养发酵产物的吲哚生物碱类化合物的化学多样性进行了重点分析,所形成的质谱-分子网络见图2。该分子网络中共含有257个节点,节点数≥ 3个的分子簇有13个。经与GNPS数据库检索比对,可知部分分子簇为甾醇类、吡喃酮类及脂肪酸类化合物。同时还以分离到的吲哚生物碱化合物paraherquanide N (5)对应的节点(m/z464)为指导,凸显出如图2红框所示的吲哚生物碱类化合物分子簇。该分子簇中包含4个母离子节点,除paraherquanide N (m/z464)外,节点m/z448与GNPS数据库中的notoamide B (6)[13]高度匹配。仔细分析4个节点的MS/MS裂解碎片(表1), 并结合各母离子之间的分子量差异,最终确定节点m/z462为化合物paraherquamide F (7)[14], 节点m/z478为化合物paraherquamide E (8)[15]。真菌P.janthinellumHK1-6在纯培养时可代谢产生吲哚生物碱类化合物paraherquanide N (5)和paraherquamide E (8)等[16], 而化合物6和7为首次从该真菌发酵产物中检测发现,表明细菌与其共培养后,一定程度上激活了真菌分泌吲哚生物碱的代谢潜能。
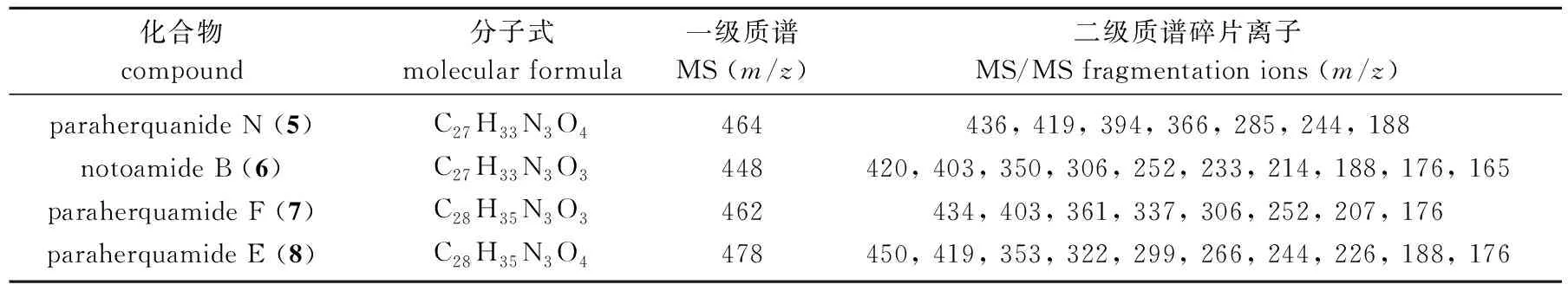
表1 吲哚生物碱类化合物二级质谱碎片离子Tab.1 Observed MS/MS fragmentation ions of indole alkaloids

图2 共培养发酵产物的质谱-分子网络图Fig.2 Mass Spectrometry-Molecular Network of the co-culture fermentation products
3 小结与讨论
吲哚-3-乙酸(1)作为信号分子调控细菌基因表达,并参与调节细菌多种生物学过程和行为[17]; 青霉酸(2)及diorcinol (3)衍生物均具有抗菌、细胞毒等多种生物学活性[10-11];而吲哚生物碱类化合物则具有良好的细胞毒、杀虫等活性[12-13]。这些化合物作为真菌P.janthinellumHK1-6与细菌S.aureusATCC 43300共培养体系中的主要代谢产物,与2种微生物的化学防御机制密切相关。真菌HK1-6在细菌刺激下,产生强抗菌活性化合物青霉酸(2)及diorcinol (3)来抵御细菌带来的生存压力。青霉酸是真菌HK1-6纯培养时的主要代谢产物; 当真菌HK1-6与其他真菌共培养时,其代谢产生青霉酸的产量有所提升[18]。由此可见,无论是与真菌还是与细菌共培养,青霉酸均是HK1-6的重要化学防御物质。Diorcinol (3)在真菌HK1-6纯培养时并未被发现,其是真菌HK1-6在细菌刺激下产生的。据报道diorcinol (3)经常在真菌被细菌污染的混合培养体系中发现,其与许多真菌的化学防御机制有关[19]。真菌HK1-6在共培养体系中还代谢产生纯培养时不曾被发现的具有细胞毒等活性的吲哚生物碱类化合物notoamide B (6)和paraherquamide F (7)。同时,细菌ATCC 43300也通过加强分泌对其生长和机能修复有重要促进作用的吲哚-3-乙酸(1)来提高生存竞争力,在共培养体系中维护自身生长。
综上所述,在实验室条件下建立人工微型共培养体系,可有效激活微生物沉默基因簇的表达,产生具有抗菌、细胞毒等活性的化合物,同时提高某些化学防御物质的产量,从而抵御外来微生物带来的生存竞争,获得营养物质和生存空间。在共培养体系中被诱导产生的化合物均显示出多种活性,尤其是抗菌活性。共培养作为一种非靶向的基因激活策略,可刺激微生物产生结构多样化的抗生素类次级代谢产物,对发现新的抗生素类化合物具有十分重要的意义。
