子宫内膜异位症组织中HMGB1、GSDMD、IL-1β表达变化及其意义
2024-01-09侯岩岩李曼叶国柳
侯岩岩,李曼,叶国柳
蚌埠医学院第一附属医院妇产科,安徽蚌埠 233004
子宫内膜异位症(EMS)是一种常见的慢性炎症性妇科疾病,子宫内膜组织定植和生长在子宫腔以外解剖部位(主要在盆腔腹膜和卵巢),是育龄期妇女盆腔疼痛和不孕的重要危险因素之一[1]。研究[2]表明,细胞焦亡促进EMS 中的炎症反应。消皮素D(GSDMD)是一种新型的细胞死亡调节蛋白,是细胞焦亡的执行蛋白,介导的细胞炎症性坏死,当机体受到内源性和外源性刺激后,激活半胱天冬氨酸酶(Caspase-1),活化的Caspase-1 促使IL-1β 的前体产生成熟的IL-1β[3],同时切割GSDMD 被产生N 末端(GSDMD-N),细胞发生肿胀、溶解,最终破裂死亡[4]。高迁移率族蛋白B1(HMGB1)是一种关键的炎症介质,广泛分布于机体的组织器官中,参与DNA 的重组、修复、转录、细胞复制及分化等生命活动[5],其可通过诱发细胞焦亡表达来促进肝衰竭患者免疫功能障碍和炎症反应的发生。但关于HMGB1在EMS 组织中的表达,以及HMGB1、GSDMD、IL-1β表达相关性的研究鲜有报道。本研究观察了EMS组织中HMGB1、GSDMD表达变化,并探讨其意义。
1 资料与方法
1.1 临床资料 选取2022 年4 月—2023 年4 月蚌埠医学院第一附属医院收治的EMS患者80例,年龄(37.28 ± 7.04)岁;按1997 年美国生育协会分期标准进行分期[6],Ⅰ~Ⅱ期有19例,Ⅲ~Ⅳ期有51例。另选因子宫平滑肌瘤并排除EMS 行全子宫切除术患者70例,年龄(44.84 ± 7.05)岁。纳入标准:①经病理确诊异位组患者均诊断为EMS;②临床资料完整;③至少3个月内未接受激素治疗。排除标准:①有胚胎停育史;②子宫先天发育不全;③合并其他肿瘤、急慢性感染性疾病等。手术留取EMS 异位内膜组织80 例份(观察组)及子宫平滑肌瘤正常内膜组织70例份(对照组)。两组一般资料无统计学差异,具有可比性。本研究经本院伦理委员会审核通过(批准号:2023YJS169),患者及家属均签署知情同意书。
1.2 主要试剂 HMGB1抗体购于碧云天生物技术有限公司(批号:A19529),GSDMD 抗体(批号:AF4012)、IL-1β 抗体(批号:AF5103)均购于江苏亲科生物有限公司。
1.3 子宫内膜异位症异位内膜组织中HMGB1、GSDMD、IL-1β 检测 采用免疫组化法。标本固定24 h,石蜡包埋,选取厚度4 μm 切片,二甲苯脱蜡,水化,添加柠檬酸盐缓冲液(PBS)进行抗原修复,一抗放于4 ℃冰箱湿盒内过夜,加入二抗,DAB 显色。结果判定标准:根据染色强度计分,无色为阴性、淡黄色为弱阳性、棕黄色为阳性、褐色/黑色为强阳性,分别计为0、1、2、3 分;根据阳性细胞所占比例计分,<10%、11%~50%、51%~75%、>75%分别计为1、2、3、4 分;两项评分相乘,<3 分判定为阴性,≥3 分判定为阳性。
1.4 统计学方法 采用SPSS25.0 统计软件。计数资料比较采用χ2检验;相关性分析采用Spearman 相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 两组HMGB1、GSDMD、IL-1β 阳性率比较 观察组HMGB1、GSDMD、IL-1β 阳性率分别为77.50%(62/80)、66.25%(53/80)、68.75%(55/80),对照组分别为32.96%(23/70)、22.86%(16/70)、17.14%(12/70),两组比较,P均<0.05。HMGB1、GSDMD、IL-1β在两内膜组织中的免疫组化染色图见图1。
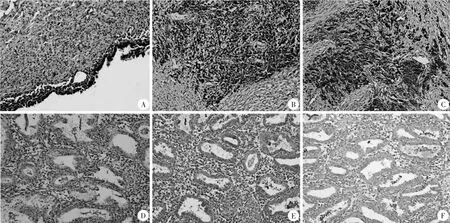
图1 HMGB1、GSDMD、IL-1β在两内膜组织中的免疫组化染色图(SP,×200)
2.2 HMGB1、GSDMD、IL-1β 表达与EMS 临床病理特征的关系 HMGB1、GSDMD、IL-1β 表达与EMS临床病理特征的关系见表1,由表1 可知,HMGB1、GSDMD、IL-1β 表达与EMS 临床分析有关(P<0.05),而与患者年龄、痛经程度和囊肿直径无关(P均>0.05)。
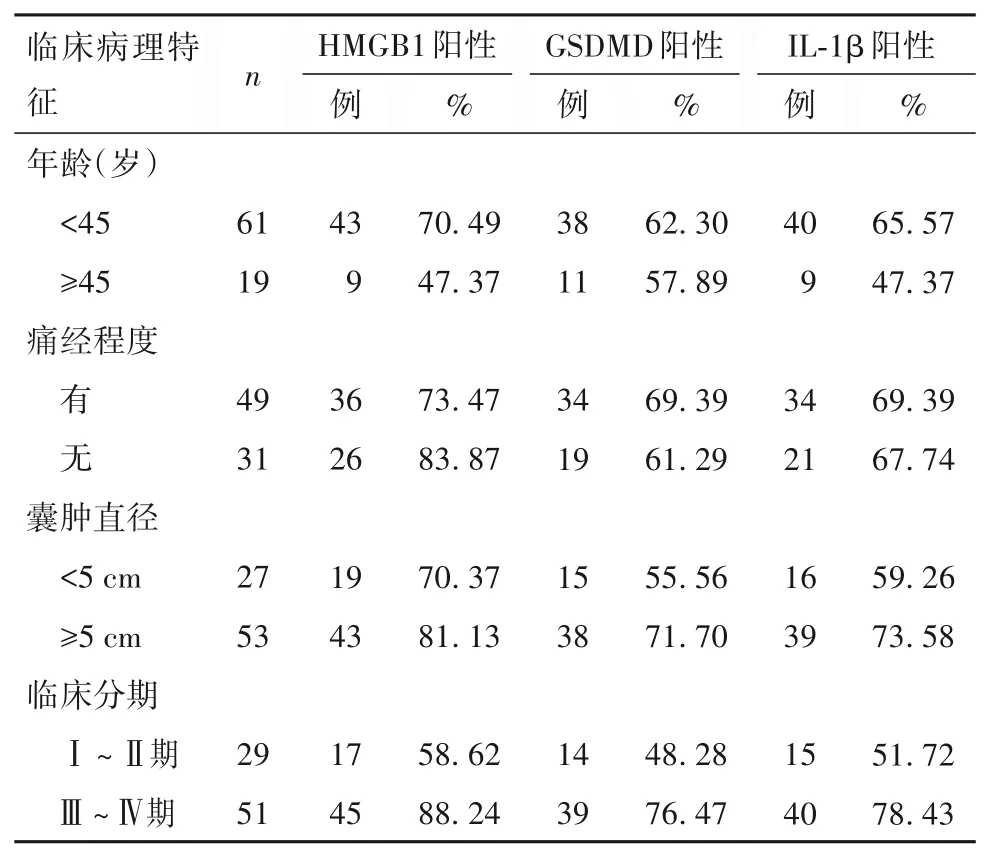
表1 HMGB1、GSDMD、IL-1β表达与EMS临床病理特征的关系
2.3 观察组HMGB1、GSDMD、IL-1β相关性分析 观察组HMGB1与GSDMD、IL-1β 表达呈正相关(r分别为0.577、0.717,P均<0.05),GSDMD 与IL-1β 表达呈正相关(r为0.797,P<0.05)。
3 讨论
EMS 是一种复杂的综合征,其特征是慢性炎症性、雌激素依赖性疾病[7],严重威胁女性生育能力和个人生活质量。探究影响EMS 发生发展及复发的危险因素,对改善EMS 患者的生活质量及预后具有重要的意义[8]。据报道,HMGB1是一种参与EMS 发展的炎症介质,EMS 患者血清、组织中HMGB1 表达上调,其有作为诊断EMS 的生物标志物的潜能[9]。考虑到HMGB1 的活化与焦亡密切相关,HMGB1 可与晚期糖基化终末产物受体(RAGE)结合诱发焦亡,进一步研究HMGB1 在EMS 患者观察组织中是否发生焦亡,GSDMD、IL-1β 作为细胞焦亡的常见因子,是否在EMS 患者观察组织中呈现高表达,以及HMGB1 是否与细胞焦亡因子GSDMD、IL-1β 具有协同性,是研究者一直关注的热点。
HMGB1是一种普遍存在的核蛋白,当机体受到内源性或外源性损伤时,其释放到细胞外,起到损伤相关分子模式(DAMP)的作用,诱导巨噬细胞释放促炎因子,引发炎症反应,从而在EMS 中起到关键致炎作用[10]。先前研究表明,单独的HMGB1 不能激活NLRP3 炎性小体,也不能诱导IL-1β 和IL-18 的表达,但HMGB1 释放到细胞外后,会与晚期糖基化终产物(RAGE)受体或toll 样受体(TLR)-2 和4 结合,以DAMP 分子的形式启动焦亡作用并引发炎症反应[11]。因此,HMGB1/RAGE 信号通路可能在EMS 焦亡释放IL-1β 和IL-18 的第一步中起重要作用[12]。本研究显示,与对照组对比,子宫内膜异位症患者HMGB1 阳性率高,Ⅲ~Ⅳ期子宫内膜异位症明显高于Ⅰ~Ⅱ期,说明子宫内膜异位症的发生与HMGB1 有关,且HMGB1 水平随着疾病进展不断上升。GSDMD是细胞焦亡的执行者,在自身免疫性疾病或炎症性疾病中发挥关键功能。在EMS 组织中,炎症因子IL-1β 和IL-18 的表达和阳性细胞的百分比显著增加,这些因子通过激活巨噬细胞[13],释放炎性小体,活化Caspase-1,一方面,活化的Caspase-1切割GSDMD,导致细胞膜穿孔,细胞通透性增加,释放细胞内物质,促进焦亡和炎症反应[14]。另一方面,活化的Caspase-1 分泌IL-1β 和IL-18,形成反馈环,进一步导致焦亡和子宫内膜间质细胞的迁移[15]。故HMGB1/RAGE 信号通路可能通过影响经典途径的细胞焦亡在EMS 中发挥重要作用,诱发异位内膜细胞级联放大的炎症过程,引起异位内膜细胞的迁移、增生及新血管生成机制,促进异位病灶的形成,最终导致EMS 的发生、发展。本研究还显示,子宫内膜异位症患者异位内膜组织中GSDMD、IL-1β 阳性率高,Ⅲ~Ⅳ期子宫内膜异位症高于Ⅰ~Ⅱ期。通过相关性分析证实,HMGB1 与GSDMD、IL-1β 在EMS表达中存在明显正相关性,说明HMGB1、GSDMD、IL-1β 三种因子在子宫内膜异位症的发病中具有一定的协同作用,三者联合进一步加重EMS 的发生发展,因此HMGB1 诱导的细胞焦亡将可能成为EMS的潜在且有价值的治疗靶点。
总之,HMGB1、GSDMD、IL-1β 在EMS 中表达上调,三指标异常表达可能与EMS 的发生发展密切相关,因此在子宫内膜异位症的诊断与分期方面具有较高的参考价值。
