藻源性有机质沉降对沉积物甲烷释放促进作用
2024-01-06钟继承安燕飞袁和忠
张 楠 ,何 凯 ,钟继承 ,安燕飞 ,袁和忠 ,张 雷 *
藻源性有机质沉降对沉积物甲烷释放促进作用
张 楠1,2,何 凯2,3,钟继承2,安燕飞3,袁和忠1,张 雷2*
(1.南京信息工程大学环境科学与工程学院,江苏 南京 210044;2.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008;3.安徽大学资源与环境工程学院,安徽 合肥 230601)
采集巢湖西北湖湾区水与沉积物样品,模拟藻源性有机质沉降对 CH4释放的驱动作用.培养结果显示,加藻组 CH4释放通量(1.59±0.51)~(98.89±14.30) μmol/(m2· h)显著高于对照组(0.02±0.016)~(1.37±0.44)mmol/(m2· h)(<0.001).培养过程中,藻源性有机质降解迅速,提供了大量产甲烷底物,溶解氧和硫酸根等电子受体减少,创造了有利产甲烷菌的环境,增加了产甲烷菌数量,尤其是乙酸营养型产甲烷菌.综上,藻源性有机质的大量输入,可以增大沉积物产甲烷速率和甲烷释放通量,其中乙酸营养型产甲烷菌起到重要作用.
释放通量;产甲烷菌;温室气体;二氧化碳;湖泊;水华
甲烷(CH4)年释放量约737Tg,是仅次于二氧化碳(CO2)的重要温室气体,对气候变暖的贡献达16%~25%[1-2].目前大气中CH4浓度已超过1.80× 10-6,是工业革命以前的近2.6倍[3].湖泊作为CH4的重要自然排放源与CH4代谢微生物的主要栖息地,其CH4年释放量可达(150.9±73.0)Tg[2].不同湖泊CH4释放强度差异较大[4],这是产甲烷底物及环境因子对产甲烷及CH4排放共同影响的结果[5].底物数量是限制产甲烷速率的主要因素,有机质增加会提高产甲烷产量[6];而不同产甲烷菌所利用底物种类不同,因此产甲烷途径受限于底物类型[7].湖泊中CH4主要来自严格厌氧条件下产甲烷菌对有机质的分解过程,除底物外产甲烷过程还会受到氧气的严格限制.另外,湖泊中的硫酸盐(SO42-),硝酸盐(NO3-)和金属氧化还原过程能够与产甲烷菌群落竞争乙酸,H2等底物从而影响产甲烷[8-10],且SO42-,NO3-和金属离子的存在可通过厌氧氧化消耗CH4[11-12].
人类活动使得水体富营养化成为全球普遍现象,无论单个大型湖泊的分区研究结果[13],还是多个湖泊的对比研究结果[4],以及不同区域湖泊的统计分析结果均表明富营养化可以促进CH4产生与释放[14];有研究表明这将会导致2100年CH4释放量升高30%~90%[15].在富营养化湖泊中,大量蓝藻繁殖,严重堆积后还会形成湖泛,长期监测数据表明蓝藻对CH4释放有促进作用[16-17],但尚未阐明具体蓝藻不同阶段,包括生长繁殖阶段与衰亡阶段,对CH4释放的影响.悬浮在水体中的蓝藻颗粒物衰亡后,最终沉积至沉积物表面,其残体分解并沉降至沉积物表面,为沉积物带来大量乙酸[18],甲基硫醚[19]等易降解有机质,这些有机质能促进沉积物CH4的产生[20],且通过改变沉积物中有机质种类,使产甲烷菌代谢途径及优势种变化,影响CH4的产生与释放[7].所以本研究以藻源性有机质的沉降为重点,利用室内模拟,探索藻源性有机质沉降对CH4释放的促进作用以及影响机制.
1 材料与方法
1.1 野外采样
实验沉积物和水样采集于巢湖西北湖湾(117.35760°E,31.70499°N).现场利用彼得森采泥器(HL–CN,恒岭科技,武汉)采集表层沉积物装于聚乙烯塑料桶中.原水样用浮游植物网过滤,除去水中的藻类和其他浮游生物,滤后储存于白色聚乙烯桶中,当天带回实验室.同时用浮游植物网采集蓝藻生物样品,滤去多余的水分后收集蓝藻样品带回实验室.
1.2 培养装置
用12根有螺口的有机玻璃管(内径8.4cm,高度30cm)建立培养装置.将采集的沉积物样品过30目筛以去除大颗粒物,并用搅拌器使沉积物样品搅拌均匀,将沉积物样品注入有机玻璃管中装填至20cm处,之后缓缓注入原位水样至柱高30cm.装样完成后,将培养装置放入恒温水浴培养箱中,20℃下稳定一周.将12个培养装置随机分为两组,每组6个.一组命名为加藻组,每根柱子加入5g 冻干蓝藻和少量干沉积物颗粒,用玻璃棒缓慢搅拌,使干藻絮凝沉降;添加量根据蓝藻大量聚集时的生物量与含水率确定[23-24].另一组作为对照组,不添加蓝藻.浅水湖泊水底通常氧气条件良好,为模拟水体覆氧过程,避免沉积物-水界面随培养时间的延长而出现缺氧,每天用小型充气泵对各柱样上覆水曝气10min,空气流量为0.5L/min;同时为避免曝气对水体监测的影响,曝气安排在每天21:00进行.
1.3 分析方法
1.3.1 培养装置的取样 干藻加入微型实验装置稳定1d后,开始持续19d的培养实验,并在培养过程监测上覆水,间隙水和沉积物化学指标变化,在培养结束时分析各组沉积物产甲烷菌变化.每个实验组选择3根柱样监测上覆水的溶解氧(DO),CH4和CO2溶存浓度及通量,根据实验进程每2或3d监测1次,监测均在上午进行.另外3根柱样,分别在实验第5,12,19d用来监测间隙水中SO42-,CH4溶存浓度及沉积物中叶绿素(Chl)含量.
1.3.2 沉积物和上覆水理化性质分析 用便携式溶氧测定仪(JPB–607A,雷磁,上海)测定水面下方5cm 处DO含量.间隙水SO42-用微型Peeper获取间隙水[25],首先将组装好的Peeper板放置于超纯水中用高纯氮气曝气3h,随后将其插入培养装置的沉积物中,平衡2d后取出,取其中的间隙水置于酶标板中,用硫酸钡沉淀法测定间隙水中SO42-浓度[26].将沉积物柱样每2cm分为一层,每层沉积物取一定量样品先冷冻干燥,然后研磨粉碎过100目筛,用90%丙酮在4℃条件下萃取其中Chl,用分光光度法分析其中的Chl含量[26],用过硫酸钾氧化法对沉积物样品进行消解,再分别用紫外分光光度法和钼酸铵分光光度法测定总氮(TN),总磷(TP)含量[27],采用重铬酸钾法测定沉积物中有机质(OM)的含量[27].
1.3.3 CH4及CO2溶存浓度及通量测量 上覆水CH4和CO2溶存浓度监测:首先在水面下方5cm处取15mL水样注入预置有2g氯化钾,预先抽真空并注入15mL高纯氮气的30mL顶空瓶中,每个位置取两个平行测定水样中溶存的CH4与CO2,将所取样品放置于恒温培养箱中静置12h,使气相和液相达到平衡后测定CH4与CO2,所有样品在24h内分析完毕.对于培养装置水–气界面通量的观测,先用装有三通阀的有机玻璃瓶盖密封瓶口,再用注射器通过三通阀抽取10mL气体注入50mL 铝箔采样袋中,每间隔30min取样一次,累积取样5次.在前述沉积物分层中,沉积物中的CH4含量通过用顶端截断的5mL注射器获取每2cm一层的沉积物样品,装入预先装有50mL 2.5% NaOH 溶液的100mL血清瓶中,立即用丁基橡胶塞密封,再利用高纯氮气通过注射针吹扫残留空气2min,每层沉积物做3个平行样品,倒置保存在恒温培养箱内待测CH4.气袋,上覆水及沉积物中CH4含量均用配有火焰离子检测器的气相色谱仪(GC–FID,7890B,Agilent)测定.
总CO2释放当量通过CH4和CO2的CO2当量之和表示.先将CH4和CO2释放通量以单位时间释放的质量表示,再乘对应的全球变暖潜能值(GWP),得到二者相应的CO2当量.其中CO2的GWP为1, CH4的GWP为28[28].最后,用所计算出来的CO2和CH4的CO2当量相加,即为培养实验的总CO2释放当量.
工序任务对应的物料节点等同于其父节点(即某个部件任务)对应的部件节点,用t.Parent表示t的父节点,有
1.3.4 分子生物学分析 从对照组,加藻组各取3份表层(0~2cm)沉积物样品,放入冻干机冻干,用Omega公司的DNA提取试剂盒(Omega,cat:M5635–02)提取总DNA,严格按照试剂盒说明书操作.将提取的DNA进行基因的PCR扩增,引物序列运用mcrA–F(GGTGGTGTMGGDTTCA-CMCARTA)和mcrA–R(CGTTCATBGCGTAGTTV- GGRTAGT).测定样品时,标准品与未知样品同时进行PCR循环,根据未知样品的阈值循环值(C),结合标准曲线求得未知样品cDNA的起始拷贝数,拷贝数(0)计算方法:
Ct
= -
K
log
X
0
+
b
(1)
式中:为标准曲线斜率;为标准曲线截距.
在上海派森诺生物科技股份有限公司运用Illumina Miseq测序平台进行PCR产物的高通量测序.运用DADA2方法[29]对原始序列进行去引物,质量过滤,去噪,拼接和去嵌合体等步骤得到特征序列(ASVs).运用QIIME2(2019.4)将处理好的ASVs与Silva数据库中的参考序列进行比对,对结果进行物种注释.用稀疏(Rarefaction)的方法预测各样本在该测序深度下所能观测到的ASVs及其相对丰度[30-31],该过程运用QIIME2(2019.4)的qiime feature–table rarefy功能实现,抽平深度设为最低样本序列量的95%.通过对抽平后的ASV表格进行统计,可以获得每个样本中的微生物群落在各分类水平的具体组成.对去除singleton后的特征表进行统计,实现各样本在属分类水平上的组成分布的可视化,并以柱状图呈现分析结果表.
1.4 数据统计与分析
基于气相色谱仪测量的平衡瓶中气相浓度,利用理想气体状态方程以及亨利定律计算水样溶解CH4和CO2原始浓度[13].CH4总释放通量(t,μmol/ (m2· h)的计算公式如下[32]:

式中:为培养装置上方气相体积,m3;为培养装置截面积,m2;为培养装置中CH4浓度随时间变化的斜率,μmol/(L·h);为培养装置气相柱高,m.
运用origin绘制柱形图和折线图,并且利用其中的–test 进行对照组和处理组间DO,CH4,CO2浓度的差异统计分析.
2 结果与分析
2.1 水体及沉积物环境变化

图1 上覆水中DO的变化
巢湖西北湖湾沉积物的含水率为(59%±7.6%), TN含量为(2988±481) mg/kg,TP含量为(1062±394) mg/kg,OM为(2.36%±0.31%).在19d的培养过程中,对照组DO在(5.18±0.20)~(7.68±0.27) mg/L之间波动.加藻组DO在第2d为0,然后逐渐升高,在培养结束时DO升高到(2.43±0.15) mg/L(图1).加藻组的DO浓度在整个培养过程中都要低于对照组的DO浓度(<0.001),说明藻源性有机质的加入大量消耗了水体DO.
用Chl含量表示藻源性有机质含量.从5~19d的培养过程中,表层沉积物(0~2cm)Chl含量由31.4μg/g降至12.9μg/g,这标志着藻源性有机质的快速分解(图2).从5~12d 培养过程中加藻组硫酸根离子逐渐降低,12d后略微升高;整个培养过程中对照组间隙水中SO42-均大于加藻组,两组之间在5,12d差异大,在第19d差异缩小(图3).

图2 沉积物中Chl a的垂向分布

图3 间隙水中硫酸根不同培养时间垂向分布
2.2 CH4含量及释放通量
沉积物间隙水中CH4的垂直分布呈现先随深度增加而增大,在8~12cm某一深度达到峰值,然后趋于稳定(图4).加藻组0~8cm处的CH4含量整体大于对照组(图4).随着实验的进行,加藻组,对照组沉积物中CH4浓度逐渐升高.其中加藻组第5,12,19d表层0~2cm沉积物CH4含量分别达到(106±6.2),(162±10.3),(92.3±1.0)μmol/L,对照组表层沉积物CH4含量则分别为(10.5±0.9),(26.1±4.7),(57.7±6.4) μmol/L.
在整个培养过程中,对照组上覆水CH4浓度维持在(0.047±0.004)~(0.27±0.30)μmol/L;加藻组CH4浓度呈现先升高后降低的趋势,在第8d达到峰值(9.95±2.2)μmol/L,之后逐渐降低,第13d后趋于平稳(图5).加藻组的CH4浓度在13d之前浓度都显著高于对照组(<0.001).加藻组CO2浓度从(109±10.3)μmol/L增加至(135±2.4)μmol/L,整体逐渐升高,显著高于对照组(<0.001).
对照组CH4释放通量为(0.02±0.01)~(1.37±0.44)μmol/(m2·h);加藻组的CH4释放通量为(1.59±0.51)~(98.9±14.3)μmol/(m2·h),在第4d达到最大值,之后逐渐降低.对照组CO2释放通量维持在(95.3±14.9)~(204±10.8)μmol/(m2·h),呈现上升趋势;加藻组CO2释放通量在培养的第2d最大,为(934±86.5)μmol/(m2·h),然后不断下降最低至(194±70.3)μmol/(m2·h).
如图6所示,对照组的总CO2释放当量在(271±34.7)~(581±30.8) µg C-CO2/h波动,变化幅度不大.在培养的第2d,加藻组总CO2释放当量达到最大值(2830±285)µg C-CO2/h,随后在培养结束时降为最低为(558±2328)µg C-CO2/h.在整个培养过程中,加藻组的总CO2释放当量的均值比对照组高出1.2~10.4倍.其中加藻组CH4的释放量为(4.54±1.76)~ (281±57.6)µg C-CO2/h,占总CO2释放当量的0.95%~18.7%,而对照组CH4的释放量在总CO2释放当量中仅占0.025%~0.88%.

图4 各组沉积物中CH4的垂向分布
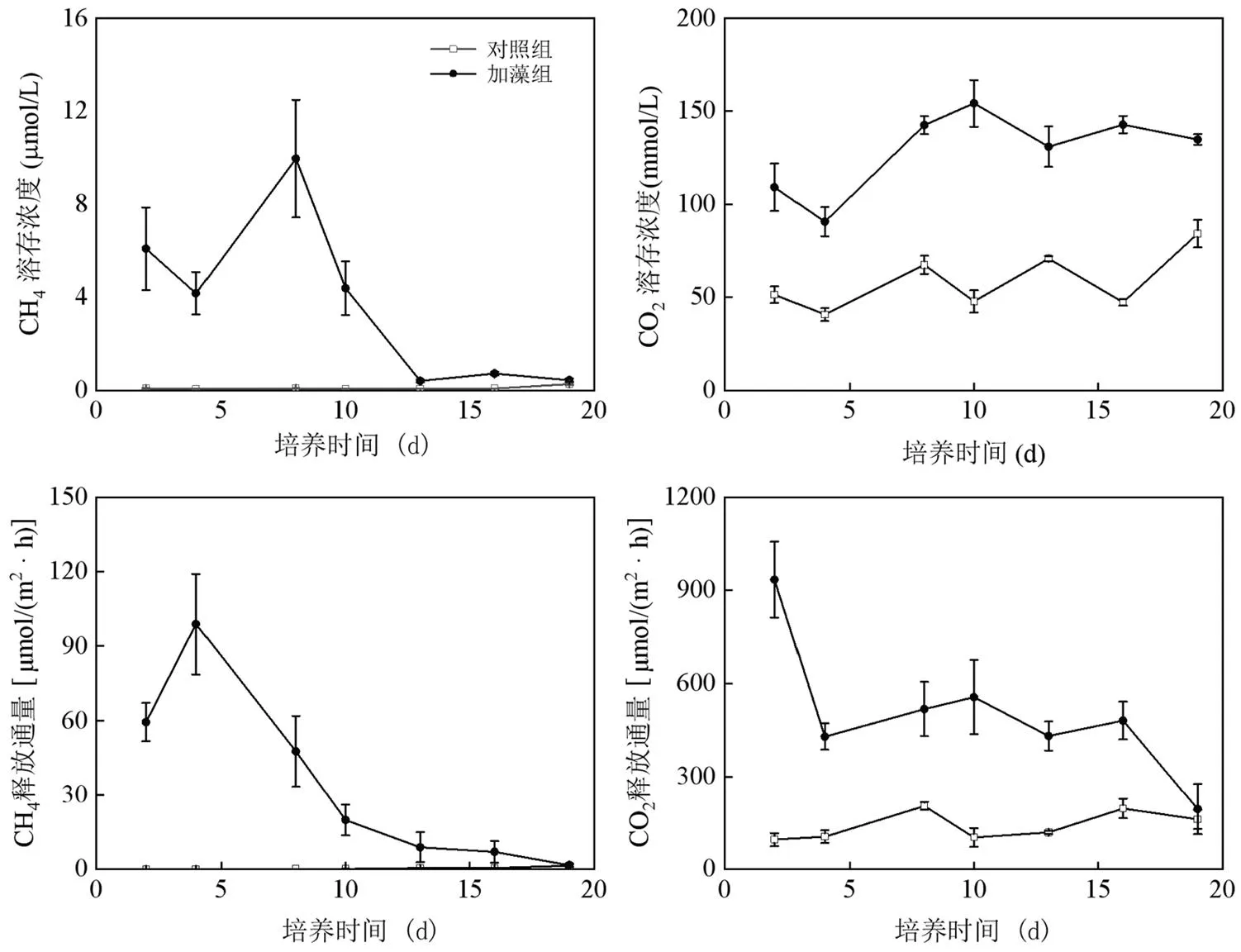
图5 培养过程中上覆水CH4和CO2浓度及释放通量变化
2.3 沉积物中微生物变化及分布
加藻组表层沉积物基因拷贝数为(3.3±0.65)×106copies/g,比对照组(2.4±0.48)×106copies/g升高37.5%(<0.001,图7).沉积物中产甲烷菌相对丰度较高的依次为甲烷丝菌属(),甲烷杆菌属()和甲烷瘤球菌属().相较对照组,加藻组产甲烷菌群落中仅甲烷丝菌属和甲烷杆菌属相对丰度有增加,甲烷丝菌属丰度较对照组提高了10.1%,增幅最大.而甲烷瘤球菌属丰度减少了4.91%,嗜氢型甲烷菌()丰度减少了1.24%,其他产甲烷菌属(Others)丰度减小了3.64%.
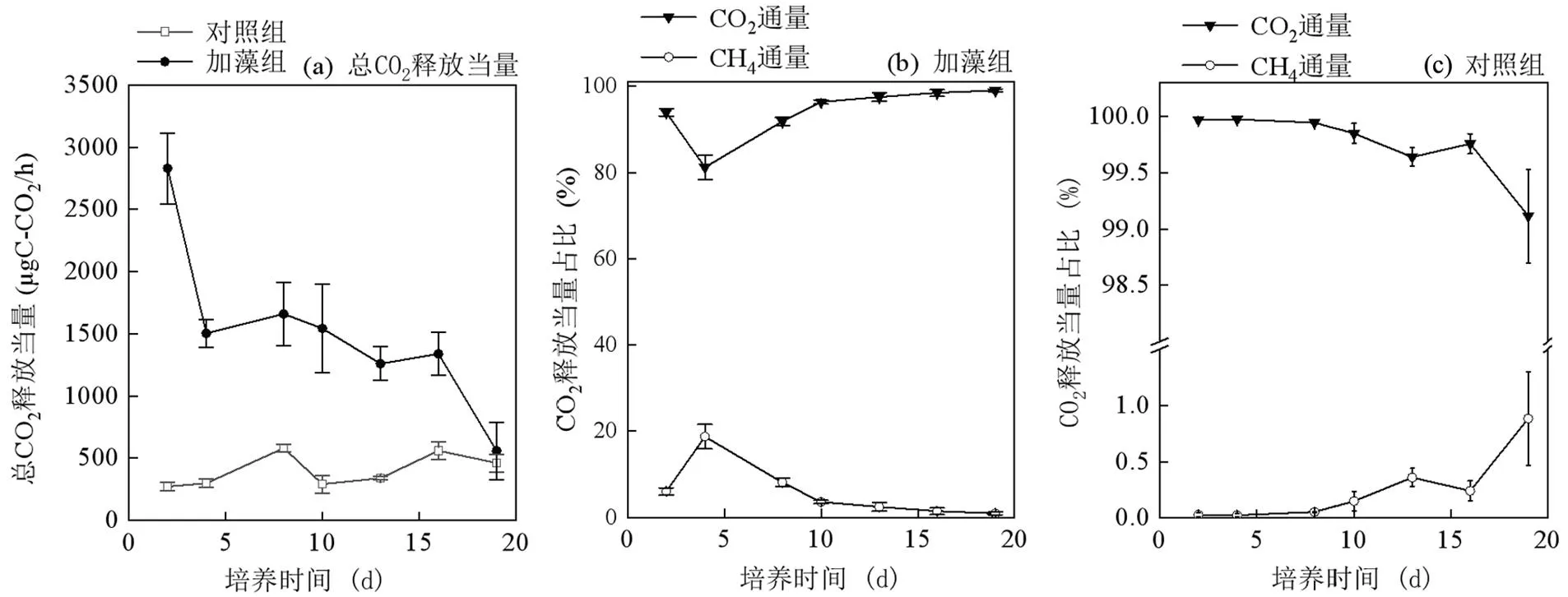
图6 总CO2释放当量及CH4和CO2的占比
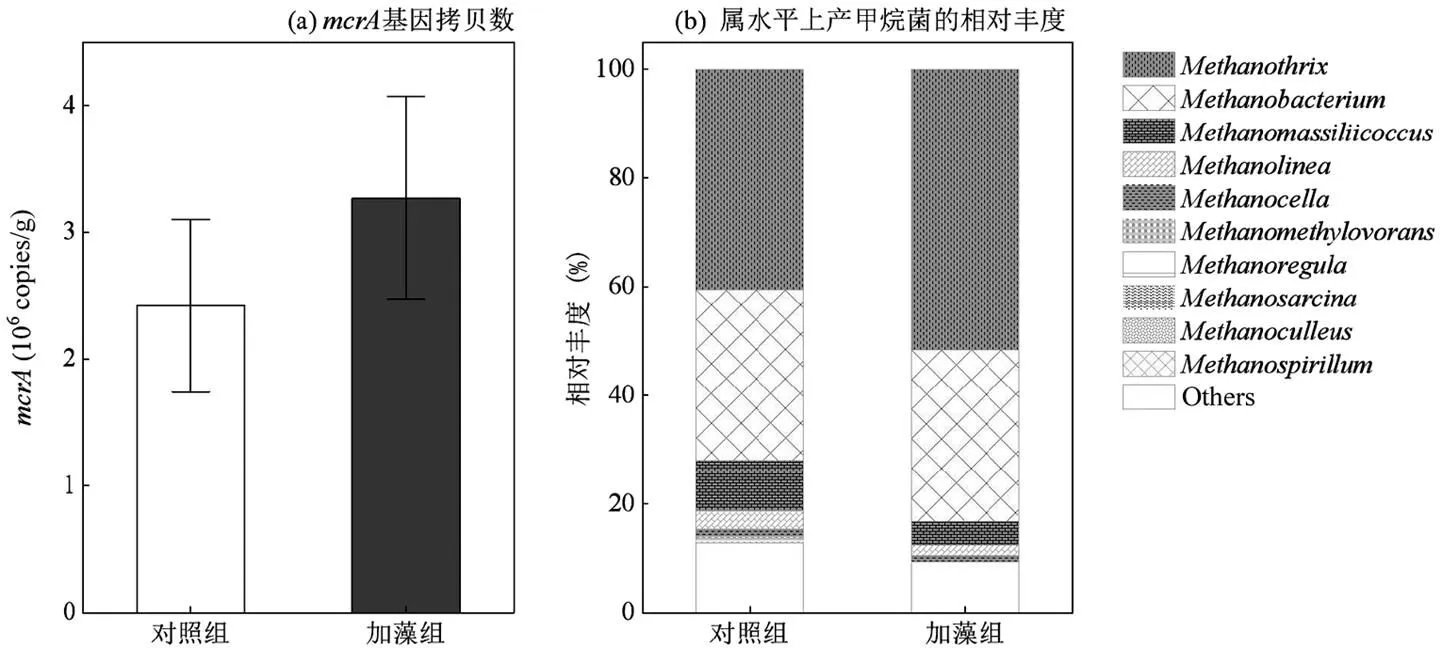
图7 沉积物中产甲烷菌群变化,
3 讨论
3.1 藻源性有机质对CH4释放的促进作用
沉积物分析结果显示加藻组0~8cm的表层沉积物中CH4含量高于对照组(图4),说明藻源性有机质能促进沉积物产甲烷.本研究将藻源性有机质引入到沉积物表面,模拟蓝藻沉降过程,因此加藻组Chl a含量增加出现在沉积物表面,下层沉积物没有受到藻源性有机质的直接影响(图3).表层沉积物有机碳增加,从而导致加藻组表层沉积物更有利于CH4的生成,因此在培养前期碳源充足的情况下,加藻组上层沉积物CH4含量高出对照组10倍左右.Furlanetto等[22]对比研究不同营养水平人工湖,发现富营养化湖泊表层0~1cm沉积物CH4最高,为寡营养湖泊的8倍左右, Wang等[33]观察到高浓度加藻处理组表层沉积物CH4比对照组高出约10倍.从Chl a监测结果来看,虽然2~8cm沉积物未直接接触到沉降的藻源性有机质(图3),但这部分沉积物中CH4含量也大幅升高(图4).这可能有三方面的原因:一是藻源性有机质降解产生的溶解性有机质向下迁移,为2~8cm沉积物产甲烷提供了更多的易降解有机质;二是溶解性有机质的向下迁移促进了这部分沉积物中原有有机质的降解;三是藻源性有机质沉降所引起SO42-含量下降,还原环境提升(图3),有利于沉积物产甲烷.因此,本研究表明,藻源性有机质沉降不仅可以促进表层沉积物产甲烷,也可以促进深处沉积物产甲烷.
沉积物中CH4含量的升高,造成水体中CH4溶存浓度在藻源性有机质的作用下也明显升高.在培养实验的第8d,加藻组水体中CH4的溶存浓度达到最大(9.95±2.2) µmol/L,平均为对照组的133倍.巢湖西北湖湾野外调查中发现,沿岸蓝藻水华易发区水体CH4浓度也高达4.09µmol/L[34].太湖蓝藻聚集区研究表明CH4浓度高达(1.78±1.43)μmol/L,是开阔区的190倍[35].对于藻源性有机质沉降引起的上覆水中CH4浓度升高,除上述沉积物中CH4含量增大以外,沉积物间隙水中SO42-的减小(图2),是由于在缺氧条件下沉积物微生物会优先利用NO3-,然后会利用SO42-[36],因此SO42-的减小表明藻源性有机质沉降减少了间隙水中NO3-,金属离子等电子受体浓度,从而减缓沉积物中其他微生物对产甲烷菌的底物的竞争以及厌氧CH4氧化作用[5].而水体中DO的降低(图1),也可能降低上覆水中CH4有氧氧化速率.综上,藻源性有机质沉降对水中CH4含量提升是上述CH4产生与氧化两方面的共同作用结果.
何强等通过模拟铜绿微囊藻死亡降解过程,发现铜绿微囊藻有机质的降解可将CH4释放量提高到1549μmol/(m2·d),为对照组的62倍[37].本实验模拟藻源性有机质大量输入,使得培养的第4d,加藻组CH4释放通量达到最大为(98.89±14.30)μmol/(m2·h),与上述两个巢湖西北湖湾蓝藻聚集区的原位释放通量结果相近[32,38].在前10d加藻组CH4释放通量整体高出对照组三个数量级.对照组去除了蓝藻且覆氧良好,未受到藻源性有机质的影响,产甲烷反应底物相对较少,制约着产甲烷速率;且良好的溶解氧有利于CH4的氧化,进一步导致释放通量低,造成加藻组和对照组差异高于前人研究.综上,蓝藻衰亡沉降,为水生生态系统输入大量藻源性有机质,所以衰亡沉降后导致的有机质输入可能是CH4的释放提高主要原因.
在培养第4d后,CH4释放通量快速降低,这可能是缺少底物以及电子受体升高的结果(图2,图3).蓝藻分解产生的易降解有机质消耗速度很快[39],可能在培养前4d易降解有机质被快速消耗,CH4释放量快速提高.第4d后易降解有机质开始限制产甲烷的速率,导致0~2cm沉积物第5~12d的监测中CH4含量变化不大(图4),并且电子受体(DO,NO3-,铁离子,SO42-)逐渐恢复表层沉积物中的产甲烷菌被抑制,厌氧甲烷氧化菌开始增强氧化作用[5,40],使得表层沉积物的CH4浓度在培养后期降低(图4).本实验结果与在长期监测过程中的结果类似,在蓝藻爆发期CH4高,随后因缺少底物而降低[41],实验在有限空间内进行,所以CH4释放量的变化较快.
然而,实际环境下蓝藻的生长,死亡和沉降是一个不断发生的过程,其对沉积物CH4释放的促进作用通常不如本研究及其他培养实验显示的这么强烈.生长期的蓝藻在光照下有利于CH4氧化的发生,降低CH4释放量[42],导致昼夜CH4释放量有差异[43].蓝藻含量高的月份,CH4释放通量随之增高[34],在圣奥古斯丁湖蓝藻爆发年份,CH4平均通量是其他年份的2倍左右[16];荀凡等[38]在巢湖西北湖湾近岸进行蓝藻连续打捞,发现未打捞蓝藻区的CH4平均释放通量是打捞区域的2倍.
根据CO2释放结果可知(图5),加藻组的总CO2释放当量高于对照组,说明藻源性有机质可能还会引起湖泊的总CO2释放当量增加.虽然,碳释放整体是以CO2的释放为主,CH4仅占很小一部分,但是藻源性有机质使得碳释放中CH4的比重显著提高(图6),表明藻源性有机质会增大碳释放量更多归因于CH4产量的增加,Sun等[44]在乌梁素海观察到的现象与本文一致.因此,藻源性有机质会促进CH4释放量升高,而CO2释放占比则会下降,从而改变温室气体释放模式,使得湖泊成为CH4的重要自然释放源.
3.2 藻源性有机质沉降促进CH4释放的微生物机制
蓝藻的加入改变了沉积物-水系统的理化性质,产甲烷菌数量也随之增加(图7).本研究中加藻组沉积物基因为(3.3±0.65)×106copies/g,相比对照组提高了37.5%.Xu等[37]选取御临河的沉积物利用铜绿微囊藻进行的培养实验,在第61d培养结束沉积物基因增加至8.39×106copies/g,提高了2.8倍,与本研究结果相似;另外在巢湖的原位围隔实验中也发现,含高浓度蓝藻的下层水基因,在第5d就提高了一个数量级[45].然而,在美国密歇根州的贫营养化湖引入蓝藻进行培养后,虽然CH4产生速率提高了约3倍,但基因拷贝数与对照组无显著差异,因为分解菌群落代谢产生的有机质能被产甲烷菌利用的有限,使得产甲烷菌活性提高但丰度变化不大[46].因此,藻源性有机质的出现通常会增加基因数量,但同时也受其他因素影响.
可供产甲烷菌利用的分解产物的增加提高产甲烷菌丰度,而底物的多样性影响产甲烷菌群落结构.本研究中加藻组和对照组群落结构差异不大(图7),甲烷丝菌属为二者相对丰度最高的产甲烷菌属,是一类专性的乙酸型产甲烷菌,只能利用乙酸作为碳源产甲烷[47],该属在加藻组的相对丰度相较对照组提高了1.27倍;第二优势属甲烷杆菌属是氢营养型产甲烷菌,以H2作为电子供体产甲烷[25].加藻组和对照组乙酸营养型产甲烷菌(甲烷丝菌属与马泽氏甲烷八叠球菌属())相对丰度最高为51.6%和40.8%,其中马泽氏甲烷八叠球菌属既能利用乙酸也能利用甲醇和甲胺化合物进行产甲烷[48];加藻组和对照组氢营养型产甲烷菌包含甲烷丝菌属,嗜氢型甲烷菌,甲烷胞菌目(),甲烷微菌(),甲烷袋状菌属(),亨氏甲烷螺菌()[49-52]约占34.8%和36.71%.加藻组除上述两种类型产甲烷菌外其他产甲烷菌相对丰度都略微降低,只有乙酸型产甲烷菌大幅度增加,表明加藻组产甲烷菌的增加主要依赖乙酸型产甲烷菌,其他属的产甲烷菌可能在绝对丰度上有略微变化,但因乙酸型产甲烷菌的丰度增幅更大使其它属表现出在相对丰度上减小.
藻源性有机质易被微生物分解利用,尤其巢湖的优势种微囊藻(spp.)[53-54].分解时DO快速下降[55],同时伴随着电子受体(NO3-,SO42-)[56-57]的降低,抑制反硝化菌和硫酸盐还原菌对有机质的利用,促进产甲烷菌的生存.藻源性有机质厌氧分解促进产甲烷菌生长繁殖[58],当蓝藻完全分解时会产生大量乙酸[59],有利于乙酸营养型途径,而促进其丰度的增加.本研究中藻源性有机质对乙酸型产甲烷菌在沉积物中的促进作用明显,表明藻源性有机质分解产物含大量乙酸,促进乙酸型产甲烷的进行.巢湖采集的原位沉积物中乙酸型及氢营养型产甲烷菌丰度最高(图7),在额外添加藻源性有机质后,优势种群快速利用有机质生长繁殖,使得其丰度增加.
在波兰富营养化水库研究中发现表层沉积物乙酸营养途径占到43%~82%,尤其在夏季乙酸营养型途径占比更高[60].另外,在德国康斯坦茨湖的培养实验也发现,藻类提高了底物中乙酸的含量促进乙酸型产甲烷途径的进行[18].虽然,在太湖蓝藻严重堆积区域,蓝藻分解会产生甲基硫醚物质促进甲基营养型产甲烷,但并没有取代淡水中优势氢营养型产甲烷[19].Zhu等[61]研究表明蓝藻会造成水体中乙酸和甲基物质含量不断升高,甲基型产甲烷菌和乙酸型相对丰度都有所提高.而本实验在整个培养过程中,仅乙酸型产甲烷菌相对丰度变化明显.综上,底物的多样性影响产甲烷群落结构,产甲烷菌可利用的基质来源于周围的分解细菌代谢的产物,所以产甲烷菌群落结构以及产甲烷途径与周围的分解细菌群落结构密切相关.
4 结论
4.1 藻源性有机质降解过程中水体DO以及间隙水中SO42-含量降低,有利于表层产甲烷活动进行,间接促进了下层沉积物产甲烷.
4.2 藻源性有机物促进沉积物产甲烷菌活动,使得上覆水CH4含量及释放量快速升高,加藻组甲烷释放量最高可达(98.9±14.3)μmol/(m2×h),提升总CO2释放当量及CH4的贡献作用.
4.3 藻源性有机质沉降将表层沉积物中基因数量提高了37.5%,丰度的增加主要因为乙酸型产甲烷菌(甲烷丝菌属)的增加.
[1] Saunois M, Stavert A R, Poulter B, et al. The global methane budget 2000~2017 [J]. Earth System Science Data, 2020,12(3):1561-1623.
[2] Rosentreter J A, Borges A V, Deemer B R, et al. Half of global methane emissions come from highly variable aquatic ecosystem sources [J]. Nature Geoscience, 2021,14(4):225-230.
[3] Dean J F, Middelburg J J, Röckmann T, et al. Methane feedbacks to the global climate system in a warmer world [J]. Reviews of Geophysics, 2018,56(1):207-250.
[4] West W E, Creamer K P, Jones S E. Productivity and depth regulate lake contributions to atmospheric methane [J]. Limnology and Oceanography, 2016,61(S1):S51-S61.
[5] Borrel G, Jezequel D, Biderre-Petit C, et al. Production and consumption of methane in freshwater lake ecosystems [J]. Microbiological Research, 2011,162(9):832-847.
[6] Vizza C, West W E, Jones S E, et al. Regulators of coastal wetland methane production and responses to simulated global change [J]. Biogeosciences, 2017,14(2):431-446.
[7] Tong C, She C X, Yang P, et al. Weak correlation between methane production and abundance of methanogens across three brackish marsh zones in the Min River Estuary, China [J]. Estuaries and Coasts, 2015,38(6):1872-1884.
[8] Kim S Y, Veraart A J, Meima-Franke M, et al. Combined effects of carbon, nitrogen and phosphorus on CH4production and denitrification in wetland sediments [J]. Geoderma, 2015,259:354- 361.
[9] Roden E E, Wetzel R G. Competition between Fe(III)-reducing and methanogenic bacteria for acetate in iron-rich freshwater sediments [J]. MicrobialEcology, 2003,45(3):252-258.
[10] Olsson L, Ye S, Yu X, et al. Factors influencing CO2and CH4emissions from coastal wetlands in the Liaohe Delta, Northeast China [J]. Biogeosciences Discussions, 2015,12:3469-3503.
[11] Segarra K E, Schubotz F, Samarkin V, et al. High rates of anaerobic methane oxidation in freshwater wetlands reduce potential atmospheric methane emissions [J]. Nature Communications, 2015,6: 7477.
[12] Hinrichs K U, Hayes J M, Sylva S P, et al. Methane-consuming archaebacteria in marine sediments [J]. Nature, 1999,398(6730):802- 805.
[13] Zhang L, Liao Q, Gao R, et al. Spatial variations in diffusive methane fluxes and the role of eutrophication in a subtropical shallow lake [J]. Science of The Total Environment, 2021,759:143495.
[14] DelSontro T, Beaulieu J J, Downing J A. Greenhouse gas emissions from lakes and impoundments: upscaling in the face of global change [J]. LimnologyandOceanographyLetters, 2019,3(3):64-75.
[15] Beaulieu J J, DelSontro T, Downing J A. Eutrophication will increase methane emissions from lakes and impoundments during the 21 st century [J]. NatureCommunications, 2019,10(1):1375.
[16] Bartosiewicz M, Maranger R, Przytulska A, et al. Effects of phytoplankton blooms on fluxes and emissions of greenhouse gases in a eutrophic lake [J]. WaterResearch, 2021,196:116985.
[17] Zhang L, Liu C, He K, et al. Dramatic temporal variations in methane levels in black bloom prone areas of a shallow eutrophic lake [J]. Science of The Total Environment, 2021,767:144868.
[18] Schulz S, Conrad R. Effect of algal deposition on acetate and methane concentrations in the profundal sediment of a deep lake (Lake Constance) [J]. Fems Microbiology Ecology, 1995,16(4):251-260.
[19] Zhou C, Peng Y, Yu M, et al. Severe cyanobacteria accumulation potentially induces methylotrophic methane producing pathway in eutrophic lakes [J]. Environmental Pollution, 2022,292(PartB):118443.
[20] Guillemette F, Leigh McCallister S, Del Giorgio P A. Selective consumption and metabolic allocation of terrestrial and algal carbon determine allochthony in lake bacteria [J]. ISME Journal J, 2016,10(6): 1373-1382.
[21] Yan X, Xu X, Wang M, et al. Climate warming and cyanobacteria blooms: Looks at their relationships from a new perspective [J]. Water Research, 2017,125:449-457.
[22] Furlanetto L M, Marinho C C, Palma-Silva C, et al. Methane levels in shallow subtropical lake sediments: Dependence on the trophic status of the lake and allochthonous input [J]. Limnologica, 2012,42(2):151- 155.
[23] Liu C, Shen Q, Zhou Q, et al. Precontrol of algae-induced black blooms through sediment dredging at appropriate depth in a typical eutrophic shallow lake [J]. Ecological Engineering, 2015,77:139-145.
[24] 何 洁,陈建斌,柳周新,等.滇池打捞蓝藻含总磷的检测方法研究 [J]. 云南农业大学学报, 2013,28(5):687-691.
He J, Chen J, Liu Z, et al. Research on total phosphorus detection methods infrom Dianchi Lake [J]. Journal of Yunnan Agricultural University, 2013,28:687-691.
[25] Zheng S, Liu F, Wang B, et al. Methanobacterium capable of direct interspecies electron transfer [J]. Environmental Science & Technology, 2020,54(23):15347-15354.
[26] Kurth J M, Op den Camp H J M, Welte C U. Several ways one goal- methanogenesis from unconventional substrates [J]. Applied Microbiol Biotechnol, 2020,104(16):6839-6854.
[27] 刘国君,陈绍业.图书馆目录[M]. 北京:高等教育出版社, 1957:15- 18.
Liu G, Chen S. Library catalogue [M]. Beijing: Higher Education Press, 1957:15-18.
[28] Pachauri K, Meyer A. Climate Change 2014: Synthesis report [M]. Geneva, Switzerland: Intergovernmental Panel on Climate Change, 2014.
[29] Benjamin Y, Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing [J]. Royal Statistical Society, 1995,57:289-300.
[30] Kenneth L, Heck J, Gerald van Belle et al. Explicit Calculation of the Rarefaction Diversity Measurement and the Determination of Sufficient Sample Size [J]. Ecological Society of America, 1975,56:1459-1461.
[31] Kemp P F, Aller J Y. Bacterial diversity in aquatic and other environments: what 16S rDNA libraries can tell us [J]. Fems Microbiology Ecology, 2004,47(2):161-177.
[32] 何 凯,王洪伟,胡晓康,等.巢湖不同富营养化区域甲烷排放通量与途径 [J]. 中国环境科学, 2021,41(7):3306-3315.
He K, Wang H, Hu X, et al. Emission fluxes and pathways of methane in different eutrophic areas of Lake Chaohu [J]. China Environmental Science, 2021,41:3306-3315.
[33] Wang Y, Feng M, Wang J, et al. Algal blooms modulate organic matter remineralization in freshwater sediments: A new insight on priming effect [J]. Sci Total Environ, 2021,784(37):147-187.
[34] Zhang L, He K, Wang T, et al. Frequent algal blooms dramatically increase methane while decrease carbon dioxide in a shallow lake bay [J]. Science of The Total Environment, 2022,312:120-161.
[35] Yan X, Xu X, Ji M, et al. Cyanobacteria blooms: A neglected facilitator of CH4production in eutrophic lakes [J]. Science of The Total Environment, 2019,651:466-474.
[36] 刘 丹,莫永亮,彭 超,等.不同电子受体对河岸湿地土壤中甲烷氧化及其关键微生物群落的影响 [J]. 长江流域资源与环境, 2022, 31(10):2230-2245.
Liu D, Mo Y, Peng C, et al. Effects of different electron acceptor on methane oxidation and key microbial communities in riparian wetland soil [J]. Journal of Resources and Environment in the Yangtze River Basin, 2022,31(10):2230-2245.
[37] Xu H, Li H, Tang Z, et al. Underestimated methane production triggered by phytoplankton succession in river-reservoir systems: Evidence from a microcosm study [J]. Water Research, 2020,185: 116233.
[38] 荀 凡,杜 先,陈新芳,等.秋季连续打捞蓝藻对水-气界面温室气体通量的影响 [J]. 湖泊科学, 2020,32(6):1707-1722.
Xun F, Du X, Chen X, et al. Effects of continuous cyanobacterial salvaging on greenhouse gas flux on water-air interface in autumn [J]. Journal of Lake Science, 2020,32:1707-1722.
[39] 汪 旋,李致春,李 翔,等.蓝藻水华衰亡对沉积物碳库有机碳组分的影响 [J]. 湖泊科学, 2020,32(2):346-356.
Wang X, Li Z, Li X, et al. Effect of the decline of cyanobacterial bloom on the organic carbon composition of lake sediment carbon pool [J]. Journal of Lake Sciences, 2020,32:346-356.
[40] Van Grinsven S, Sinninghe Damste J S, Harrison J, et al. Impact of Electron Acceptor Availability on Methane-Influenced Microorganisms in an Enrichment Culture Obtained From a Stratified Lake [J]. Front Microbiol, 2020,11:715.
[41] Bange H W, Bergmann K, Hansen H P, et al. Dissolved methane during hypoxic events at the Boknis Eck time series station (Eckernförde Bay, SW Baltic Sea) [J]. Biogeosciences, 2010,7(4): 1279-1284.
[42] Prasanna R, Kumar V, Kumar S, et al. Methane production in rice soil is inhibited by cyanobacteria [J]. Microbiological Research, 2002, 157(1):1-6.
[43] Liu X, Gao Y, Zhang Z, et al. Sediment-water methane flux in a eutrophic pond and primary influential factors at different time scales [J]. Water, 2017,9(8):601.
[44] Sun H, Lu X, Yu R, et al. Eutrophication decreased CO2but increased CH4emissions from lake: A case study of a shallow Lake Ulansuhai [J]. Water Research, 2021,201:117363.
[45] 胡万婷,唐 千,孙 伟,等.水体中蓝藻水华分解产甲烷动态过程研究 [J]. 中国环境科学, 2017,37(2):702-710.
Hu W, QianTang, Sun W, et al. Dissolved methane dynamics during the degradation of organic matter derived from cyanobacterial bloom [J]. China Environmental Science, 2017,37:702-710.
[46] West W E, Coloso J J, Jones S E. Effects of algal and terrestrial carbon on methane production rates and methanogen community structure in a temperate lake sediment [J]. Freshwater Biology, 2012,57(5):949-955.
[47] Eggen R I L, de Vos W M. Molecular biology of the acetoclastic methanogen Methanothrix soehngenii [M]. Springer Verlag, 1992:54- 63.
[48] 李小飞,侯立军,刘 敏.长江口沉积物甲烷产生潜力与产甲烷菌群落特征 [J]. 环境科学学报, 2019,39(5):1682-1690.
Li X, Hou L, Liu M. Methane production potential and methanogens community in the sediments of the Yangtze Estuary [J]. Journal of Environmental Sciences, 2019,39:1682-1690.
[49] Zhang L, Ban Q, Li J. Microbial community dynamics at high organic loading rates revealed by pyrosequencing during sugar refinery wastewater treatment in a UASB reactor [J]. Frontiers of Environmental ence & Engineering, 2018,12(4):1045-1048.
[50] Mohamad Shahimin M F, Foght J M, Siddique T. Methanogenic biodegradation of iso-alkanes by indigenous microbes from two different oil sands tailings ponds [J]. Microorganisms, 2021,9(8): 1569-1577.
[51] Barret M, Gagnon N, Morissette B, et al. Methanoculleus spp. as a biomarker of methanogenic activity in swine manure storage tanks [J]. Fems Microbiology Ecology, 2012,80(2):427-440.
[52] Rowe A R, Mansfeldt C B, Heavner G L, et al. Relating mRNA and protein biomarker levels in a Dehalococcoides and Methanospirillum- containing community [J]. Applied Microbiology and Biotechnology, 2015,99(5):2313-2327.
[53] 李永慧,李玉成,王 宁,等.巢湖蓝藻死亡衰败过程中典型有害成分形成及控制对策 [J]. 湖泊科学, 2012,24(4):513-518.
Li Y, Li Y, Wang N, et al. Formation and control of the harmfuI ingredients during the decaying process of cyanobacteria from Lake Chaohu [J]. Journal of Lake Science, 2012,24:513-518.
[54] Qin B. Lake eutrophication: Control countermeasures and recycling exploitation [J]. Ecological Engineering, 2009,35(11):1569-1573.
[55] 代亮亮,郭亮亮,吴中奎,等.不同浓度藻类水华对两种沉水植物的影响 [J]. 中国环境科学, 2016,36(9):2765-2773.
Dai L, Guo L, Wu Z, et al. The effects of different concentrations of algal blooms on the two submerged macrophytes [J]. China Environmental Science, 2016,36:2765-2773.
[56] Li Z, Zhao Y, Xu X, et al. Migration and transformation of dissolved carbon during accumulated cyanobacteria decomposition in shallow eutrophic lakes: a simulated microcosm study [J]. PeerJ, 2018,6: e5922.
[57] Zhou C, Peng Y, Deng Y, et al. Increasing sulfate concentration and sedimentary decaying cyanobacteria co-affect organic carbon mineralization in eutrophic lake sediments [J]. Science of The Total Environment, 2022,806(Pt 3):151260.
[58] 黎丽雯,潘 纲,李 梁,等.蓝藻对太湖底泥反硝化过程的影响和机理分析 [J]. 湖泊科学, 2013,25(5):628-634.
Li L, Pan G, Li L, et al. Effect and mechanism of algae bloom On the denitrification processes in the sediments of Lake Taihu [J]. Journal of Lake Science, 2013,25:628-634.
[59] Conrad R. Importance of hydrogenotrophic, aceticlastic and methylotrophic methanogenesis for methane production in terrestrial, aquatic and other anoxic environments: A mini review [J]. Pedosphere, 2020,30(1):25-39.
[60] Gruca-Rokosz R, Koszelnik P. Production pathways for CH4and CO2in sediments of two freshwater ecosystems in south-eastern Poland [J]. PLoS One, 2018,13(6):0199755.
[61] Zhu Y, Chen X, Yang Y, et al. Impacts of cyanobacterial biomass and nitrate nitrogen on methanogens in eutrophic lakes [J]. Scienceof The Total Environment, 2022,848:157570.
Enhancement and mechanism of algal-derived organic matter deposition on lake sediment methane release.
ZHANG Nan1,2, HE Kai2,3, ZHONG Ji-cheng2, AN Yan-fei3, YUAN He-zhong1, ZHANG Lei2*
(1.School of Environmental Science and Engineering, Nanjing University of Information Science & Technology, Nanjing 210044, China;2.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;3.School of Resources and Environmental Engineering, Anhui University, Hefei 230601, China)., 2023,43(12):6641~6650
Lakes are important natural sources of methane (CH4) release. A well-known view is that frequent cyanobacterial blooms promote CH4release in freshwater lakes, but the specific driving process and mechanism are still unclear. In this study, the driving process and effect of algal-derived organic matter deposition on CH4release were simulated and studied by using water and sediment samples from Lake Chaohu. The results showed that the CH4release flux in the group with the treatment of additional added algae was (1.59±0.51)~(98.89±14.30) μmol/(m2·h)) significantly higher than that in the control group (0.02±0.016)~(1.37±0.44) μmol/(m2·h)) (<0.001). During the simulating experiment, the degradation of algal-derived organic matter provided a large number of substrates for methane production while the reduction of electron acceptors such as dissolved oxygen and sulfate created an environment conducive to methanogens, which resulted in a massive proliferation of methanogens, especially acetic acid trophic methanogens. Our study clearly demonstrated that the large input of algal-derived organic matter increased the methane production rate and methane release flux of lake sediments with acetic acid trophic methanogens playing an important role.
emission flux;methanogens;greenhouse gases;carbon dioxide;lake;algal bloom
X511
A
1000-6923(2023)12-6641-10
张 楠,何 凯,钟继承,等.藻源性有机质沉降对沉积物甲烷释放促进作用 [J]. 中国环境科学, 2023,43(12):6641-6650.
Zhang N, He K, Zhong J C, et al. Enhancement and mechanism of algal-derived organic matter deposition on lake sediment methane release [J]. China Environmental Science, 2023,43(12):6641-6650.
2023-04-16
国家自然科学基金资助项目(42177228,41771122);自然资源部国土(耕地)生态监测与修复工程技术创新中心开放课题(GTST2021- 007)
* 责任作者, 副研究员, leizhang@niglas.ac.cn
本研究在采样,实验过程中得到等王洪伟,胡晓康,朱利钊等同学的支持与帮助,在此一并感谢.
张 楠(1999-),女,湖北襄阳人,南京信息工程大学资源与环境硕士研究生,研究方向为环境生物地球化学.发表论文1篇. 1967761818@qq.com.
