聚对苯二甲酸乙二醇酯微塑料对Anammox颗粒污泥的尺寸影响效应
2024-01-06洪先韬
洪先韬,周 鑫
聚对苯二甲酸乙二醇酯微塑料对Anammox颗粒污泥的尺寸影响效应
洪先韬1,2,周 鑫1,2*
(1.太原理工大学环境科学与工程学院,山西 晋中 030600;2.山西省市政工程研究生教育创新中心,山西 晋中 030600)
为探究微塑料(MPs)对活性污泥脱氮性能的尺寸影响效应,采用水质测定、活性测试、物化表征及微生物群落分析等方法,探索了不同粒径下(75~500μm)聚对苯二甲酸乙二醇酯(PET)对厌氧氨氧化颗粒污泥(AnGS)的影响.结果显示,投加75和150μm的PET-MPs时,Anammox脱氮效能低于控制组,而300和500μm组中却表现出优于控制组.厌氧氨氧化活性(SAA)测试具有相似结果.胞外聚合物(EPS)分析发现PET-MPs粒径越小,EPS分泌和PN/PS越高,AnGS结构越不完整.小粒径下PET对Anammox抑制主要与颗粒污泥所具有的较低Zeta电位和较小的比表面积显著相关.而大粒径PET-MPs则减少了与MPs接触的机率且能提供更多的活性位点,促进了Anammox底物的传递效率.高通量测序结果表明PET-MPs粒径大小决定了微生物群落的多样性和丰富度,尤其对Anammox菌属(Candidatus)相对丰度影响显著.
微塑料;聚对苯二甲酸乙二醇酯;厌氧氨氧化;生物脱氮;微生物群落;影响
微塑料(MPs)是指直径小于5mm的塑料颗粒[1].自2004年被首次提出,MPs一直作为典型的新污染物而成为国内外环境领域研究的热点.污水处理厂(WWTPs)是MPs最重要的源和汇.目前,研究人员已经在城市污水处理厂中检测到各种形态和不同类型的MPs[2].据统计,有约占总量16.9%的MPs遗留在二级处理系统中[3],这些MPs与活性污泥通过静电吸附作用相互接触,进而对生化处理效能产生不可避免的影响.
厌氧氨氧化(Anammox)是在厌氧条件下,厌氧氨氧化菌(AnAOB)以亚硝酸盐氮作为电子受体,将氨氮直接氧化生成氮气的过程.大幅节约曝气能耗和无需有机碳源投加是Anammox最显著的优势.然而,AnAOB属于无机自养菌,本身生长速率缓慢,同时对于外界环境污染物(如MPs)十分敏感[4].因此,MPs的引入势必对Anammox脱氮工程应用提出了新挑战.
MPs粒径大小决定了MPs与微生物之间的相互作用以及底物传输速率等方面,进而对生物脱氮效率产生重要影响.有研究指出,在活性污泥中加入粒径为150~300μm的PS-MPs后,总氮去除率(NRR)与对照组基本一致,而随着粒径减小至0~75μm,这一数值也降低至56.18%[5].另外,Zhou等[6]发现相同浓度(1000μg/L)下,100μm的PS塑料对脱氮性能没有表现出显著影响,而100nm的PS塑料却使NRR减少了24.48%.
聚对苯二甲酸乙二醇酯(PET)是污水处理厂被检出的最典型的MPs类型之一.因此,本文以PET作为模型MPs,探究不同粒径PET-MPs对厌氧氨氧化颗粒污泥(AnGS)性能的影响机制.
1 材料与方法
1.1 MPs准备和物化性质测定
PET-MPs购买于东莞名誉兴塑胶原料有限公司(中国东莞).PET的密度范围为1.29~1.41g/cm3,粒径的误差限不超过5%.
PET-MPs的Zeta电位采用纳米粒度电位仪(Malvern Zetasizer Nano ZS90,UK)测定.测试时分散剂为水,并需要超声5min.由于反应器中的pH值维持在7.5~8.2,因此将测试的pH值设置为8.每个样品测试3次.
PET-MPs的比表面积采用全自动比表面积分析仪(麦克ASAP2460,US)测定.吸附气体为N2,脱气温度为120℃,脱气时间为6h.每个样品测试3次.
1.2 污泥接种以及废水配置
接种污泥采用本实验室UASB反应器中自主培养了2年的AnGS,其中Candidatus的相对丰度约为40%.混合液挥发性悬浮物(MLVSS)约6.0g/L,氮去除能力0.6kg-N/(m3×d).人工配水含有100mg/L NH4Cl,130mg/L NaNO2,20mg/L KH2PO4及微量元素(具体配比见表1).pH值维持在7.5±0.2.

表1 微量元素成分(mg/L)
1.3 实验步骤
采用5个有效容积为100mL的血清瓶.R0作为控制组不添加MPs,R1~R4作为实验组,分别投加粒径为75, 150, 300和500μm的PET- MPs,浓度均固定为0.5g/L.反应器运行周期为6h.每个瓶装填70mL的人工配水和30mL的AnGS.进水用99.99%的纯氮气吹脱20min,以保证厌氧环境.反应器放置在恒温振荡培养箱中,温度和转速分别设置为32℃和120r/min.整个实验连续运行30d.
1.4 化学分析
每个周期出水采用0.45μm的滤膜过滤后进行化学测定分析.NH4+-N使用哈希分光光度计测定(HACH DR1900,美国).NO2--N和NO3--N使用紫外分光光度计测定(UV-5500,上海元析). MLVSS采用重量法测定.pH值由便携式pH计(METTLER TOLERO FE20,德国)监测,溶解氧(DO)由便携式多参数水质分析仪(WTW Multi 3420,德国)监测.
1.5 SEM测试
在使用SEM观测之前需要对AnGS进行预处理,包括固定、冲洗、脱水、置换和干燥.在预处理结束后对样品进行喷金处理,随后采用SEM(Quattro S, Thermo Fisher Scientific,美国)进行观察.标尺参数分别为1和100μm.
1.6 EPS提取与测定
EPS采用离心法提取[7].蛋白质(PN)和多糖(PS)分别采用考马斯亮蓝法和硫酸-蒽酮比色法测定.
1.7 高通量测序
实验结束后,采集5个反应器中的AnGS样品分析微生物群落,使用Illumina Miseq高通量测序平台(上海生工)对样品进行测序分析.
1.8 厌氧氨氧化活性(SAA)计算
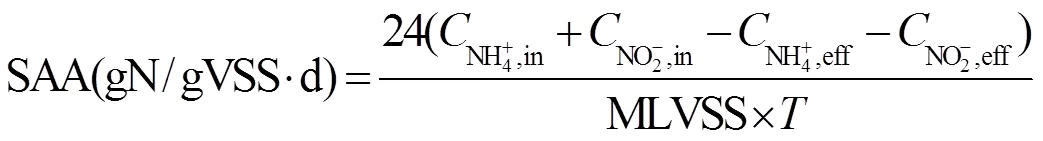
2 结果与分析
2.1 脱氮性能

图1 不同粒径PET-MPs暴露下的AnGS脱氮性能

图2 不同粒径PET-MPs暴露下的AnGS系统的SAA
从图1中可以看出,各反应器NH4+-N和NO2--N平均出水浓度的大小排序为:75μm>150μm>控制组> 300μm>500μm,这说明小粒径的PET-MPs对Anammox产生了抑制作用,而在大粒径300和500μm时,却出现Anammox的促进现象.投加75μm的PET-MPs后,NH4+-N和NO2--N的去除率相比于控制组分别下降了1.60%和1.46%,而500μm的PET-MPs使该值分别提高了4.23%和4.32%.如图2所示,投加500μm PET-MPs的SAA最高,为(128.6±18.4) mg-N/ (g-VSS·d),高于控制组的(118.21±12.5) mg-N/(g- VSS·d).而投加75μm PET-MPs,SAA值则为(109.8± 11.5) mg-N/(g-VSS·d),低于控制组,这与Anammox脱氮效率的变化趋势相一致.这些结果表明PET-MPs对于Anammox影响具有尺寸效应.大粒径MPs可能改变了AnGS的物理化学性质及内部结构,加快了Anammox的底物传质速率以及AnAOB的繁殖,进而提高了厌氧氨氧化代谢活性.
2.2 MPs物化性质分析
Zeta电位描述了MPs在溶剂中的稳定性,这决定了MPs对细胞的渗透性和相互作用[8].由图3.可知,PET-MPs的粒径越小,Zeta电位越低.由于活性污泥表面含有大量的负电荷,根据静电吸附原理, PET-MPs的Zeta电位(绝对值)越小,两者之间的静电斥力越小,相互接触的概率越大,这就解释了75μm对Anammox抑制程度最显著的现象[9].有研究报道,50nm的PS-NPs对硝化细菌的接触率比500nm要更强,并导致了硝化作用的减弱[10].另有研究报道,经-NH2修饰的PS-NPs比未修饰的PS-NPs产生对活性污泥更高的生物毒性指标(ROS和LDH)水平,而PS-COOH NPs却最低,因其Zeta电位的绝对值最高[11].这说明MPs的Zeta电位也是决定对细胞毒性程度大小的关键因素.小粒径的PET-MPs可能在细胞周围的存在造成了潜在生态毒性,引起细胞氧化应激,损害Anammox细胞结构.
由图4可知,PET-MPs的BET与粒径尺寸呈正相关,这与其他报道相一致[12].BET越大,颗粒的孔隙率越高,可供微生物附着的空间就越多.500 μm MPs具有最高的BET,能够为AnAOB提供更多的增殖空间.另一方面,较高的BET意味着具有更多的活性位点,能够吸附Anammox所必需的底物(NH4+-N以及NO2--N),增强AnAOB对底物的摄取速率.

图3 不同粒径PET-MPs的Zeta电位(pH=8)
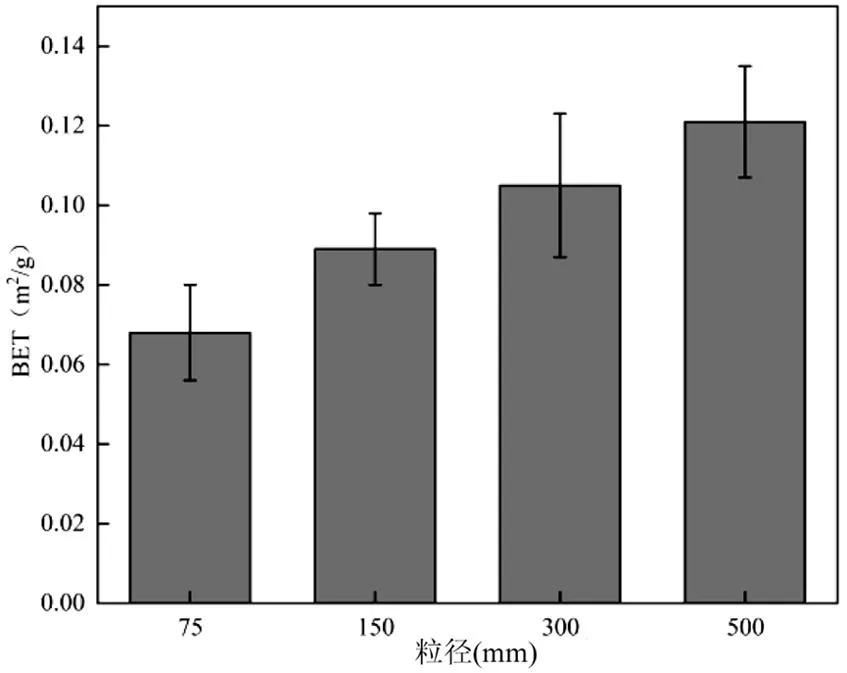
图4 不同粒径PET-MPs的BET
2.3 AnGS形貌分析
在运行结束后,利用SEM观察控制组与实验组的AnGS形态差异.从图5中可以看出,控制组的AnGS表面呈现光滑和完整,而暴露于75μm PET-MPs的AnGS表面充满了不规则和磨损痕迹.而暴露在500μm下的AnGS出现孔洞甚至解体的现象.这是由于反应器在振荡中,500μm的PET-MPs与AnGS之间产生强烈的冲击作用,从而导致AnGS结构发生物理性破坏.据报道,微曝气处理后的污泥表面出现了宽大的空隙和通道,增加了底物传递速率[13].这解释了500μm MPs组中最低的NH4+-N和NO2--N出水浓度[13].微生物相分析发现在控制组中球形细菌占主导地位.然而,随着PET-MPs的加入后,球状菌的比例下降,取而代之的是丝状菌和杆状菌,这表明PET-MPs改变了AnGS的微生物群落结构.

图5 AnGS在SEM观察下的表面特征
(a)控制组;(b)75μm;(c)500μm
2.4 EPS含量及特性
如图6所示,EPS在控制组中的含量为(24.27±2.55) mg/g-MLVSS,而在投加75μm的PET-MPs后,该值显著升高至(33.28±2.84) mg/g-MLVSS.EPS的含量升高说明PET-MPs的存在对AnGS造成了一定的环境胁迫,AnAOB通过自主地在胞外分泌EPS,以扩大“保护层”的厚度,减缓PET-MPs的扩散[11].然而,当PET-MPs粒径为500μm时,EPS的含量为(26.04±3.16) mg/g-MLVSS,它高于控制组但低于75μm组.因此,在同一浓度水平下,PET-MPs的粒径越小对AnGS细胞的渗透性越强,环境胁迫程度越高.随着PET粒径的增大,PN和PS的含量也呈现降低的趋势.PN/PS是衡量颗粒污泥结构完整性的重要指标,PN/PS数值越高,其完整性越低.当PET-MPs粒径为75μm时,PN/PS从控制组的(2.43±0.12)上升至(2.77±0.11),随后又降低至500μm的(2.43±0.15),这说明小粒径的PET-MPs改变了EPS的组分比例,促使AnGS朝着不利于结构稳定性的方向发展.

图6 暴露在不同粒径PET-MPs下的PN,PS和PN/PS
2.5 微生物群落特征
如表2所示,相比于控制组,75,150和300μm的PET-MPs降低了微生物群落的丰富度,但随着粒径尺寸的增加,丰富度持续上升,到500μm时Chao和ACE指数超过了控制组.Shannon和Simpson指数也呈现相同的趋势,这说明小粒径的PET-MPs会降低微生物群落的丰富度和多样性,而500μm则呈相反趋势.这可能是500μm PET-MPs与微生物的弱相互作用以及较大的BET,使得对微生物在定殖空间上的促进作用大于其抑制作用.
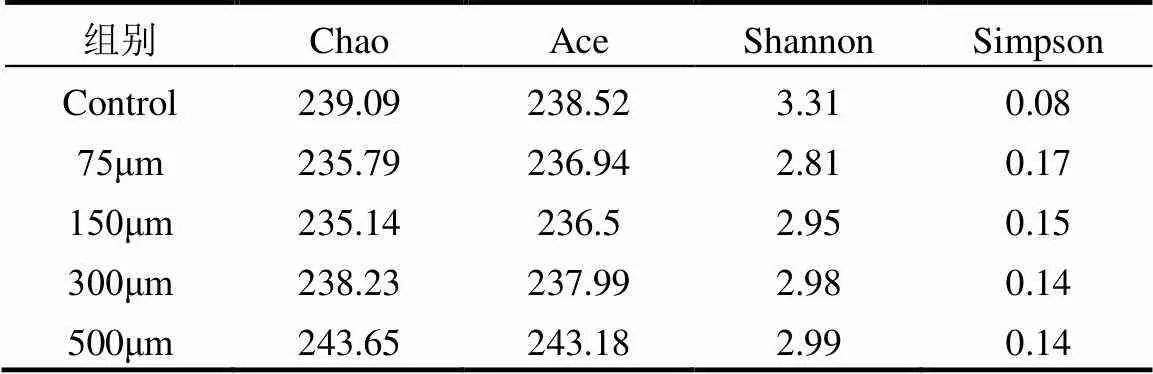
表2 控制组和实验组样品微生物群落Alpha分析
如图7所示, Planctomycetes, Proteobacteria, Ignavibacteriae, Chloroflexi, Acidobacteria, Bacteroidetes, Firmicutes为最主要的6种门,其相对丰度超过80%.作为最重要的门,Planctomycetes随着PET-MPs粒径的增大而减少,从控制组的41.37%降低至19.5%.AnAOB隶属于Planctomycetes,因此其数量变化说明PET-MPs的添加对AnAOB产生抑制[14].相反地,Proteobacteria与PET-MPs粒径呈现负相关性,该丰度在控制组中为28.9%,而在加入75μm PET-MPs时急剧增至43.25%.Proteobacteria已被证实为有机物污染物的降解者,同时具有对MPs的良好抵抗性[15-16].在投入PET-MPs后,Ignavibacteriae、Chloroflexi、Acidobacteria和Firmicutes的相对丰度均随着PET-MPs的投加而增加,表现了对MPs的较强适应性.
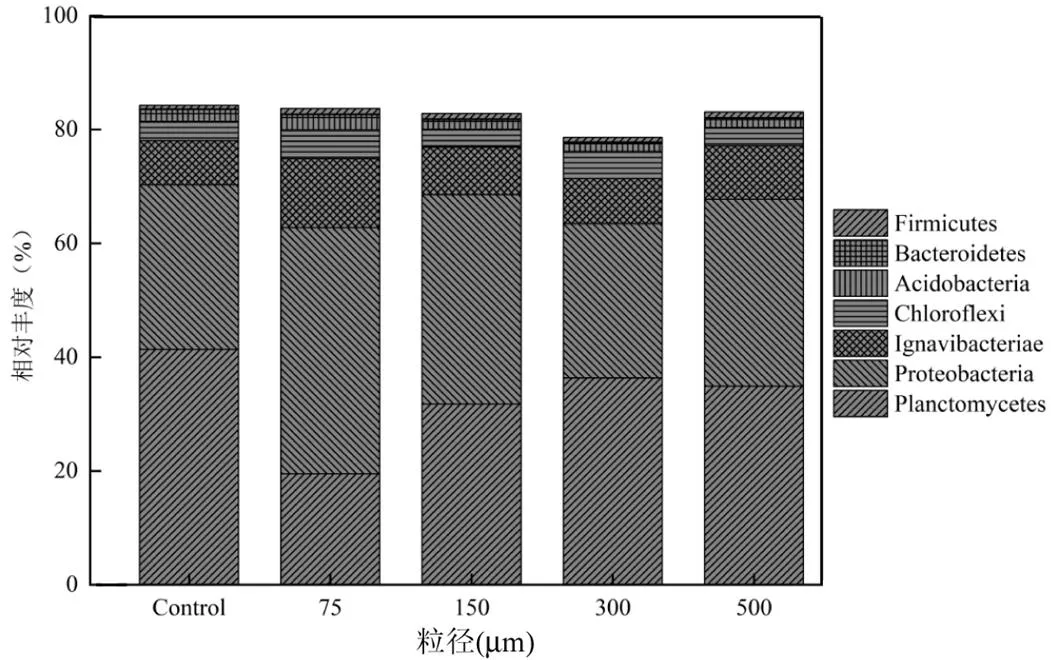
图7 暴露于不同粒径下的PET-MPs微生物群落组成(门水平)
如图8所示,在属水平上, 75,150,300,500μm的Candidatus相对丰度分别为37.73%, 17.48%,27.59%,31.72%,32.28%.可以看出,随着粒径尺度的减少,该值持续下降,其变化趋势与Planctomycetes基本保持一致.除了AnAOB之外,是最主要的菌属,其含量从控制组的6.60%升高至75μm的10.88%.而该值在500μm时为8.42%,意味着对相对丰度的促进效果与PET-MPs的粒径大小有关.被证实拥有异化还原为铵(DNRA)的能力,它常在Anammox耦合反硝化反应器中与AnAOB同时被检测到[17].是典型的异养反硝化菌,能够参与营养物质的运输[18].结果显示,控制组中的相对丰度为4.19%,而75μm组中为5.66%,这与75μm中最高含量的EPS相对应,即刺激细胞分泌的EPS能够被部分利用,并促进其繁殖.隶属于Acidobacteria的3、6和10的相对丰度随着PET-MPs的投加而上升[19].
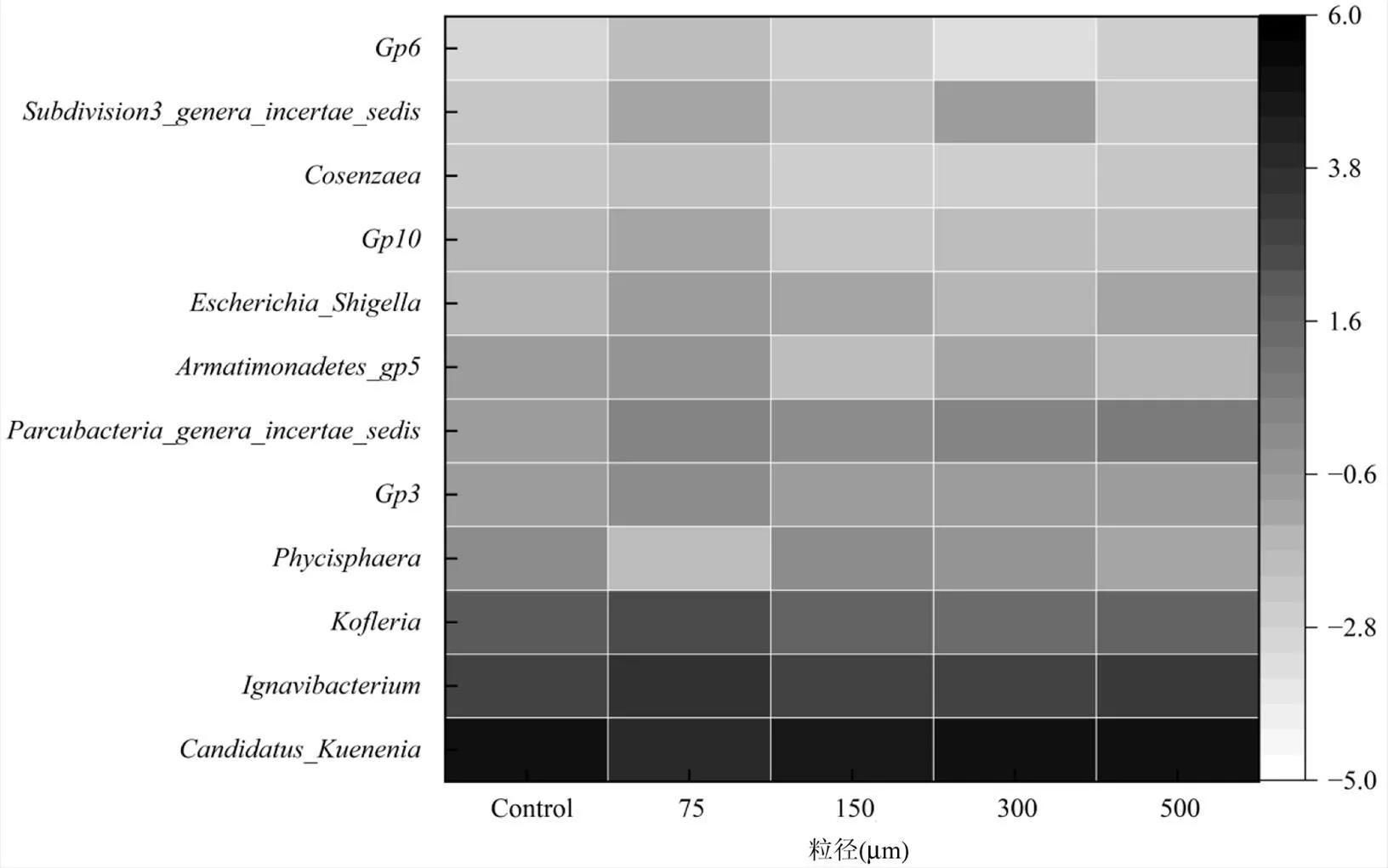
图8 暴露于不同粒径下的PET-MPs的相对丰度前15位的菌属
相对丰度进行log10的数值转换
3 结论
3.1 与控制组相比,小粒径(75μm,150μm)的PET-MPs抑制了Anammox反应,而大粒径(300μm, 500μm)的PET-MPs却表现为Anammox促进作用.
3.2 小粒径的PET-MPs对Anammox的抑制作用与其表面具有的较低的Zeta电位和较小的BET有关.SEM发现,大粒径下的PET-MPs所表现的Anammox促进作用是由于AnGS结构被改变,提高了底物传质速率.
3.3 AnGS在小粒径PET-MPs暴露时EPS分泌量和PN/PS更高,高通量测序结果发现小粒径的PET- MPs Candidatus的相对丰度更低.
[1] Thompson R C, Olsen Y, Mitchell R P, et al. Lost at Sea: Where is all the plastic? [J]. Science, 2004,304(5672):838–838.
[2] Blair R M, Waldron S, Gauchotte-Lindsay C. Average daily flow of microplastics through a tertiary wastewater treatment plant over a ten-month period [J]. Water Research, 2019,163:114909.
[3] Jiang J, Wang X, Ren H, et al. Investigation and fate of microplastics in wastewater and sludge filter cake from a wastewater treatment plant in China [J]. Science of the Total Environment, 2020,746:141378.
[4] Ma B, Wang S, Cao S, et al. Biological nitrogen removal from sewage via anammox: Recent advances [J]. Bioresource Technology, 2016,200:981–990.
[5] Sun X, Chen B, Li Q, et al. Toxicities of polystyrene nano- and microplastics toward marine bacterium Halomonas alkaliphila [J]. Science of the Total Environment, 2018,642:1378–1385.
[6] Zhou C, Wu J, Ma W, et al. Responses of nitrogen removal under microplastics versus nanoplastics stress in SBR: Toxicity, microbial community and functional genes [J]. Journal of Hazardous Materials, 2022,432:128715.
[7] 李金璞,张雯雯,杨新萍.活性污泥污水处理系统中胞外多聚物的作用及提取方法[J]. 生态学杂志, 2018,37(9):2825–2833.
Li J P, Zhang W W, Yang X P. The roles and extraction methods of extracellular polymeric substances in activated sludge wastewater treatment system [J]. Chinese Journal of Ecology, 2018,37(9):2825– 2833.
[8] Martin L M A, Gan N, Wang E, et al. Materials, surfaces, and interfacial phenomena in nanoplastics toxicology research [J]. Environmental Pollution, 2022,292:118442.
[9] Bos R. Physico-chemistry of initial microbial adhesive interactions – its mechanisms and methods for study [J]. FEMS Microbiology Reviews, 1999,23(2):179–229.
[10] Lee J, Jeong S, Long C, et al. Size dependent impacts of a model microplastic on nitrification induced by interaction with nitrifying bacteria [J]. Journal of Hazardous Materials, 2022,424:127363.
[11] Qian J, He X, Wang P, et al. Effects of polystyrene nanoplastics on extracellular polymeric substance composition of activated sludge: The role of surface functional groups [J]. Environmental Pollution, 2021,279:116904.
[12] 王天慧.微塑料对土壤中菲的水土界面行为及微生物群落的影响[D]. 马鞍山:安徽工业大学, 2022.
Wang T H. Effects of microplastics on soil and water interface behavior and soil microbial community in the Philippines [D]. Maanxhan: Anhui University of Technology, 2022.
[13] Wang C, Wei W, Zhang Y T, et al. Different sizes of polystyrene microplastics induced distinct microbial responses of anaerobic granular sludge [J]. Water Research, 2022,220:118607.
[14] Costa M C M S, Carvalho L, Leal C D, et al. Impact of inocula and operating conditions on the microbial community structure of two anammox reactors [J]. Environmental Technology, 2014,35(14): 1811–1822.
[15] Cui Y, Gao J, Zhang D, et al. Responses of performance, antibiotic resistance genes and bacterial communities of partial nitrification system to polyamide microplastics [J]. Bioresource Technology, 2021, 341:125767.
[16] Lin X, Su C, Deng X, et al. Influence of polyether sulfone microplastics and bisphenol A on anaerobic granular sludge: Performance evaluation and microbial community characterization [J]. Ecotoxicology and Environmental Safety, 2020,205:111318.
[17] Ahmad H A, Guo B, Zhuang X, et al. A twilight for the complete nitrogen removal via synergistic partial-denitrification, anammox, and DNRA process [J]. npj Clean Water, 2021,4(1):31.
[18] Zhang C, Tayyab M, Abubakar A Y, et al. Bacteria with different assemblages in the soil profile drive the diverse nutrient cycles in the sugarcane straw retention ecosystem [J]. Diversity, 2019,11(10):194.
[19] Liu C, Dong Y, Hou L, et al. Acidobacteria community responses to nitrogen dose and form in Chinese fir plantations in southern China [J]. Current Microbiology, 2017,74(3):396–403.
Size effect of polyethylene terephthalate microplastics on Anammox granular sludge.
HONG Xian-tao1,2, ZHOU Xin1,2*
(1.College of Environmental Science and Engineering, Taiyuan University of Technology, Jinzhong 030600, China;2.Shanxi Municipal Engineering Graduate Education Innovation Center, Jinzhong 030600, China)., 2023,43(12):6406~6412
To investigate the size-dependent effect of microplastics (MPs) on nitrogen removal performance of activated sludge, the effect of polyethylene terephthalate (PET) on anaerobic ammonia-oxidizing granular sludge (AnGS) at different particle sizes (75~500μm) was explored using the methods of water quality determination, activity test, physicochemical characterization and microbial community analysis in this study. Results showed that the nitrogen removal efficiency of Anammox was lower than that of the control group when 75 and 150μm PET-MPs were dosed, while the 300 and 500μm groups showed superiority over the control group. Anaerobic ammonia oxidation activity (SAA) tests showed similar results. Extracellular polymeric substances (EPS) analysis revealed that the smaller the particle size of PET-MPs, the higher the EPS secretion and PN/PS, and the more incomplete the AnGS structure. The inhibition of Anammox by PET at small particle size was mainly associated with the granular sludge's lower Zeta potential and smaller specific surface area. In contrast, large-size PET-MPs reduced the chance of contact with MPs and provided more active sites, facilitating Anammox substrates' delivery efficiency. High-throughput sequencing results showed that the particle size of PET-MPs determined the diversity and abundance of microbial community, especially the relative abundance of Candidatus.
microplastics;PET;anammox;biological nitrogen removal;microbial community;effect
X703
A
1000-6923(2023)12-6406-07
洪先韬,周 鑫.聚对苯二甲酸乙二醇酯微塑料对Anammox颗粒污泥的尺寸影响效应 [J]. 中国环境科学, 2023,43(12):6406-6412.
Hong X T, Zhou X.Size effect of polyethylene terephthalate microplastics on Anammox granular sludge [J]. China Environmental Science, 2023,43(12):6406-6412.
2023-05-15
国家自然科学基金资助项目(21607111);山西省基础研究计划项目(20210302123198)
* 责任作者, 教授, raymans2006@163.com
洪先韬(1998-),男,河南信阳人,太原理工大学硕士研究生,研究方向为微塑料对生物脱氮性能的影响机制.723839813@qq.com.
