超声波联合UV-LED对耐四环素大肠杆菌的灭活效能
2024-01-06李松蔚周晓琴赵美娟李子富夏德华
李松蔚,周晓琴*,赵美娟,李子富,夏德华
超声波联合UV-LED对耐四环素大肠杆菌的灭活效能
李松蔚1,周晓琴1*,赵美娟1,李子富1,夏德华2
(1.北京科技大学能源与环境工程学院,北京 100083;2.广东省环境污染控制与修复技术重点实验室(中山大学),广东 广州 510275)
采用超声波-UV-LED联合工艺以期实现对污水中抗生素耐药菌(ARB)的去除,通过逐一分析不同频率超声波(33, 120, 200kHz)、不同波长UV-LED(255, 275nm)对耐四环素大肠杆菌的灭活以及膜损伤效能,从而确定超声波联合UV的工艺参数.结果表明,单独超声波作用时,33kHz超声波效果最佳,在输入功率为50W、输入剂量为1080kJ/L时,大肠杆菌的灭活率为2.30log,细胞膜损伤百分比为61.09%;单独UV-LED作用下,辐照剂量为19.92mJ/cm2的255nm UV-LED对细菌的灭活率为5.32log,细胞膜的损伤百分比为2.52%;275nm UV-LED对细菌的灭活率为4.63log,膜损伤百分比为34.95%;但是二者联合使用未产生协同效应.超声波联合UV-LED可使消毒效能显著提升至7.45log, 细胞膜损伤提高至68.74%,且能够有效抑制大肠杆菌的复活,复活率降低至0.4%,超声波联合UV-LED在细菌耐药性控制方面显现出巨大的潜力.
抗性细菌;超声波;UV-LED;灭活效能;光复活
由于抗生素的滥用和过度使用,导致污水中抗生素耐药菌(ARB)及其相关的抗生素耐药基因(ARGs)数量剧增,目前已经成为全球重大公共安全问题[1-2].因此,研究污水中抗性细菌及抗性基因的控制技术具有重要意义.
紫外线(UV)是一种常规的消毒手段,具有非化学、占地面积小、灭活高效且消毒副产物少等优点[3].传统紫外汞灯含汞毒性,易造成二次污染且寿命较短[4].2013年联合国环境规划署要求缔约国自2020年起禁止生产及进出口含汞产品.因此,寻找传统紫外汞灯的替代品尤为重要.紫外发光二极管(UV-LED)是近年来新兴的紫外消毒装置,具有环境友好、启动速度快、波长多样性、可发射单一固定波长等优点,成为取代传统汞灯的新型、可靠的紫外光.有研究表明使用265nm的UV-LED可灭活4~ 5log浓度的大肠杆菌,使用组合波长如260nm/ 280nm、265nm/280nm、267nm/275nm,细菌的复活率显著降低[5-10].
超声波也是一种消毒手段,与氯、臭氧、紫外等组合消毒,可以增强消毒效能[11].有研究发现,使用超声波预处理的大肠杆菌相比未经处理的大肠杆菌,经过UV消毒浓度降低5log时,可以减少20%以上的紫外辐照剂量,且可以有效抑制细菌的光复活.使用输入声密度为2.2kW/L的超声波与UV-LED组合,作用150s后tet M和tet Q的基因去除率相比单独使用UV-LED提高了4倍[12-13].
基于此,本文以耐四环素大肠杆菌为研究对象,分别研究了超声波消毒(33, 120, 200kHz)、UV-LED消毒(255, 275nm)、UV-LED组合消毒、超声波联合UV-LED消毒对耐四环素大肠杆菌的去除特性,并借助流式细胞仪和光复活装置研究细菌细胞膜损伤、光复活规律,以期为污水中抗性细菌的控制提供新思路.
1 材料与方法
1.1 微生物
本研究所使用的大肠杆菌()筛选自北京某污水处理厂的二级出水.使用前将接种菌株的菌液置于37℃、200r/min摇床震荡培养12~14h,然后4000r/min、4℃离心15min,弃上清液收集菌体,用无菌去离子水重新悬浮,制得浓度约为109CFU/mL的抗性细菌悬液作为母液待用.实验时将上述悬液稀释至107CFU/mL.
1.2 超声波消毒
本研究使用的超声反应器由苏州工业园区海纳科技有限公司加工制造,功率在0~200W之间可调,频率分别为33, 120, 200kHz.超声波实际输入功率使用功率计(型号:LCDG-ZJ1-62010)测量.
将50mL菌悬液分别加入频率为33, 120, 200kHz的超声波反应器中,调节输入功率至50W,超声处理时间设置为18min,每3min取样一次.依据本研究团队前期的研究结果,采用超声波输入声密度(W/L)以及单位输入能量密度(kJ/L)作为评价超声波能耗的参数指标,根据式(1)和(2)计算获得[13].


基于此,试验进行0, 3, 6, 9, 12, 15, 18min对应的超声波单位输入能量密度则分别为0, 180, 360, 540, 720, 900及1080kJ/L,测定对应消毒时间的细菌灭活率以及细胞膜损伤情况,设置3组平行试验.
1.3 UV-LED消毒
本研究所使用的紫外光源为准平行UV-LED光束器(山东青岛杰森电气有限公司),该光源由6个直径为9mm的UV-LED灯珠按照两行三列形式排列,平行管高20cm,可发射波长为255和275nm光束,可独立控制,光强可通过电流调节(0~200mA).使用紫外光谱辐照计(HP350UV,杭州双色智能检测仪器有限公司)测试紫外线强度.测定时,将仪器放置在平行管下方,开启电源,待示数稳定后即可读出实际的紫外辐照强度.在试验前,使用上述辐照计对单一波长或双波长UV-LED辐照强度分别进行测定,得到单一波长或叠加波长的实际辐照强度.
将50mL菌悬液加入到直径90mm的石英培养皿中,将培养皿放置在磁力搅拌器上,以200r/min的转速进行搅拌,然后将UV-LED装置垂直放置在培养皿上方照射.UV-LED按照单波长、组合波长分别开展试验.本试验共设置6组试验条件,每组运行20min,每5min取样一次,设置3组重复试验,试验设置如表1所示.
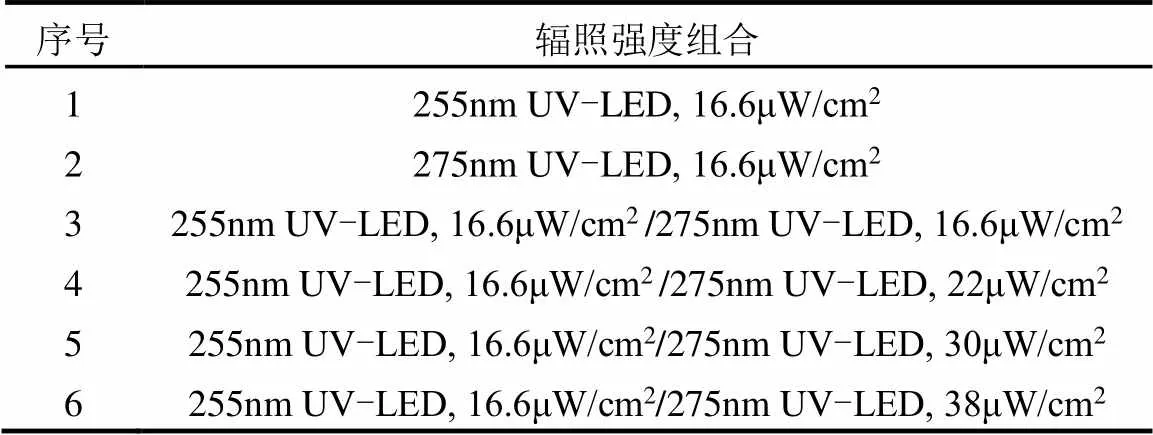
表1 UV-LED消毒试验条件
1.4 超声波联合UV-LED消毒
将50mL稀释后的菌样加入到33kHz超声波反应器中,调节输入功率为50W,将UV-LED装置垂直放置在超声波反应器上方,同时使用16.6μW/cm2255nm、38μW/cm2275nm UV-LED照射.试验时间设置为18min,每3min取一次样,取出的水样于4℃下保存,用于后续分析,设置3组平行试验.
1.5 光复活
光复活试验采用功率为8W,波长为365nm的UVA光源(CELWLAX500,CEAULIGHT有限公司),运行电流为0.2mA.光源预热20min,将经过灭活的菌样放入光复活反应器内,UVA照射的同时使用磁力搅拌子搅拌菌样.试验时间设置为24h,在0.5, 1, 2, 4, 8, 12和24h取样测定.所有试验均在室温(25±3)℃下进行(图1).

图1 超声联合UV-LED消毒试验流程
1.6 细菌计数过程
采用标准平板计数法测定细菌可培养性,使用无菌水将试验样品进行梯度稀释,使稀释后水样中细菌浓度处于可测浓度范围(30~300CFU/mL).将1mL菌样涂布于营养琼脂板上,然后37℃培养24h后进行菌落计数(CFU/mL).
1.7 细胞膜损伤研究
细胞膜损伤采用流式细胞仪(CytoFLEX,贝克曼,美国)测定,使用LIVE/DEAD BacLight试剂盒(L34856,赛默飞)染色,该试剂盒含有两种荧光染料,其中 SYTO 9能够穿透所有细胞的细胞膜与核酸结合并发出绿色荧光,PI只能穿透细胞膜损伤细胞与核酸结合并发出红色荧光.分别用1.5μL 3.34mmol/L SYTO 9和1.5μL 30mmol/L PI对菌样染色,25℃避光培养15min,将染色后的菌样通过流式细胞仪分析.
1.8 数据处理
细菌的灭活率采用式(3)计算.
灭活率=log
10
(
N
0
/N
) (3)
使用复活率来表征被灭活的大肠杆菌中复活的部分所占的比例,采用式(4)计算.
复活率= (
N
t
-
N
)/(
N
0
-
N
)×100% (4)
式中:t为光复活后的菌落计数,CFU/mL;0为照射前菌落计数,CFU/mL;为照射后菌落计数, CFU/mL.
所有数据通过origin 2021进行分析.
2 结果与讨论
2.1 超声波对耐四环素大肠杆菌的灭活
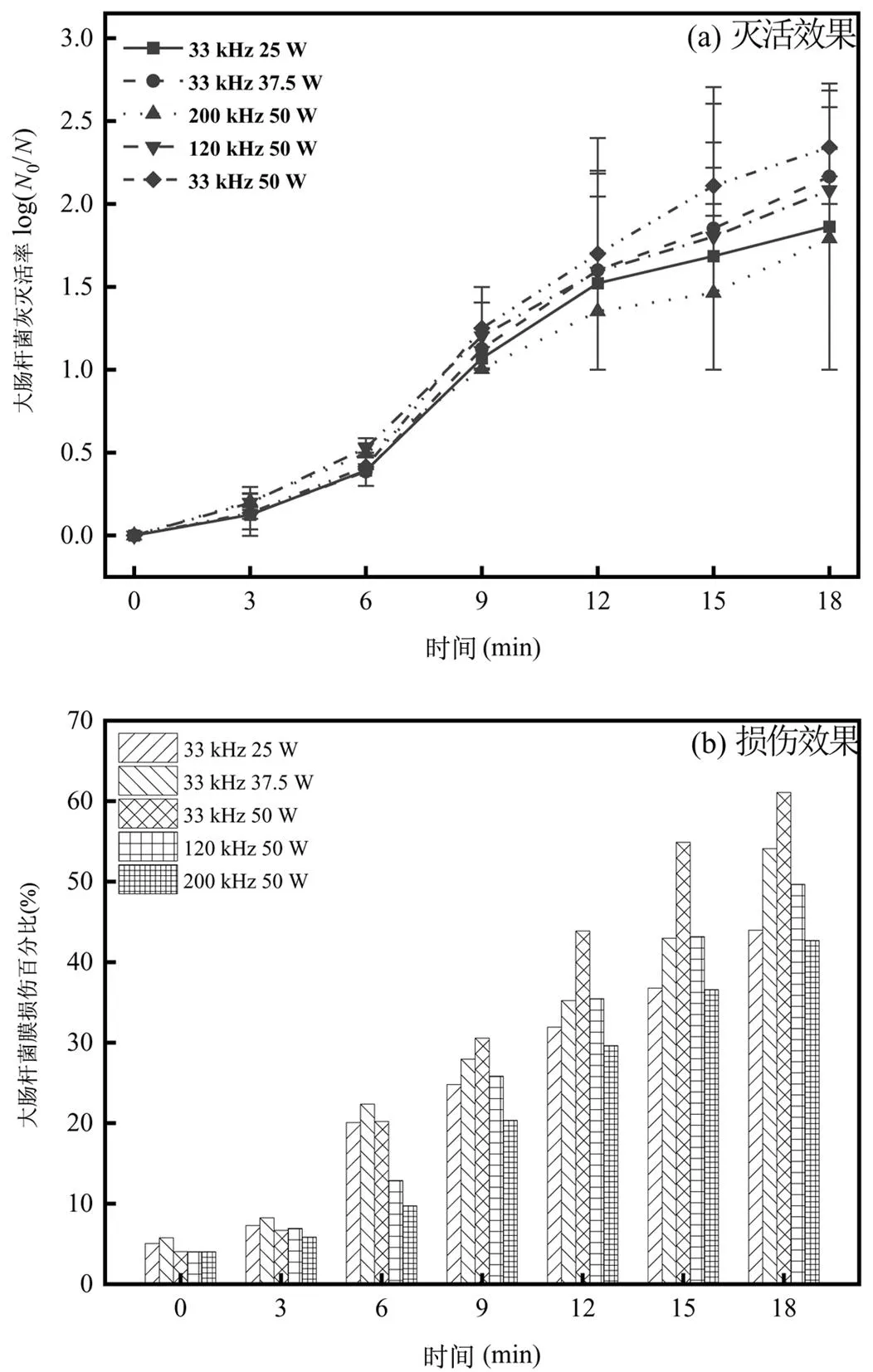
图2 超声波频率与功率对大肠杆菌灭活及膜损伤效果的影响
超声波对耐四环素大肠杆菌的灭活及膜损伤效果如图2所示.随着超声波处理时间增加,细菌灭活率、膜损伤程度均呈上升趋势.试验结束时,33, 120, 200kHz超声波对大肠杆菌的灭活率分别为2.30log、2.10log、1.80log,相比之下,低频超声对于细菌的灭活效果更佳[14].降低33kHz超声波的输入功率至37.5W和25W,试验结束时细菌的灭活率分别为2.17log、1.86log. 33kHz (25, 37.5, 50W)、120kHz 50W、200kHz 50W五种试验条件下,细胞膜损伤百分比分别为43.96%、54.11%、61.09%、45.64%、38.66%.由此可见,低频超声波(33kHz)展现出较好的消毒效果,灭活效能高且更易对细菌细胞膜造成损伤.这是因为低频超声波(低于100kHz)与高频率(高于100kHz)相比,可以产生更大的空化泡,释放更高的能量[15-16],这些能量可以破坏大肠杆菌的细胞膜,甚至导致 DNA、ATP和蛋白质泄漏,对细胞造成不可逆的损伤[17].
从图中可以看出,超声波处理3min,细胞膜损伤不显著,随着处理时间延长,细胞膜的损伤程度迅速上升,随后速率减缓.出现该现象可能是因为初期超声波的能量主要用于破碎菌胶团,效率较低,随后超声波能量绝大部分作用于大肠杆菌,其机械效应产生的剪切力将细菌的细胞膜“剪碎”,对细胞膜造成了不可逆的损伤,从而导致细菌失去可培养性.基于上述结果,选择频率为33kHz ,输入功率为50W的超声条件进行后续研究.
2.2 UV-LED对耐四环素大肠杆菌的灭活
2.2.1 单波长UV-LED的灭活 辐照强度为16.6μW/cm2的255nm与275nm UV-LED对耐四环素大肠杆菌的灭活及膜损伤效果如图3所示.试验结束时,255nm灭活率为5.32log,相比于275nm高出0.69log;在细胞膜损伤方面, 275nm UV-LED照射下,试验结束时大肠杆菌细胞膜损伤百分比为34.95%,而255nm仅为2.52%,对细胞膜的损伤效果甚微.类似的研究也表明,低剂量的255nm UV-LED (10mJ/ cm2)对大肠杆菌的膜损伤可以忽略不计[18-19],即使将剂量增加到4000mJ/cm2,膜损伤程度依然很小(最高12.9%)[18-20].原因可能是255nm UV-LED接近于DNA的吸收峰(260nm),能直接穿透细胞,被DNA吸收,使DNA中相邻的嘧啶分子形成嘧啶二聚体,从而阻止DNA的复制和蛋白质的合成,使其失去可培养性[21-23].相对而言,275nm UV-LED更接近蛋白质的吸收峰(280nm),因此,275nm的UV-LED主要作用于细菌的细胞膜,对类蛋白物质具有氧化作用,可以对细菌细胞膜造成损伤,有助于对细菌产生持续的灭活效果,但是对DNA的针对性不高,从而导致灭活效率相对较低[10].在本试验中,没有观察到“拖尾”现象,这与之前的研究结论不同[8],原因可能是本试验中采用的细菌具有抗生素耐药性且初始菌液浓度高, 同时紫外辐照强度较低所致.
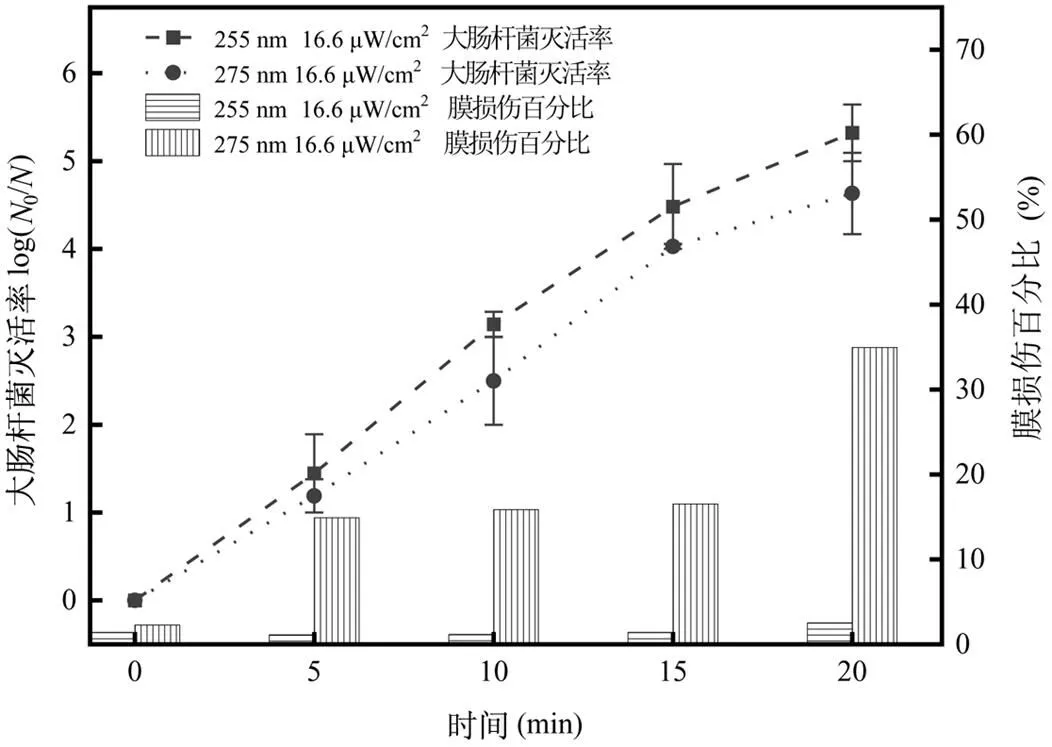
图3 255nm/275nm UV-LED对大肠杆菌的灭活和膜损伤效果
调整275nm UV-LED的辐照强度至22, 30, 38μW/cm2,得到细菌灭活及膜损伤情况如图4所示.试验结束时,三种试验条件下大肠杆菌的灭活率分别为4.63log、4.70log、4.99log,对应的细胞膜损伤百分比分别为26.76%、31.56%、34.17%.随着辐照强度的增加,细菌的灭活率逐渐增加,但是15min后大肠杆菌灭活速率开始减缓,产生类似“拖尾”现象,可能是由于该类细菌更易产生荚膜物质,可以促进微生物自聚体的形成,从而降低了灭活效率[24].
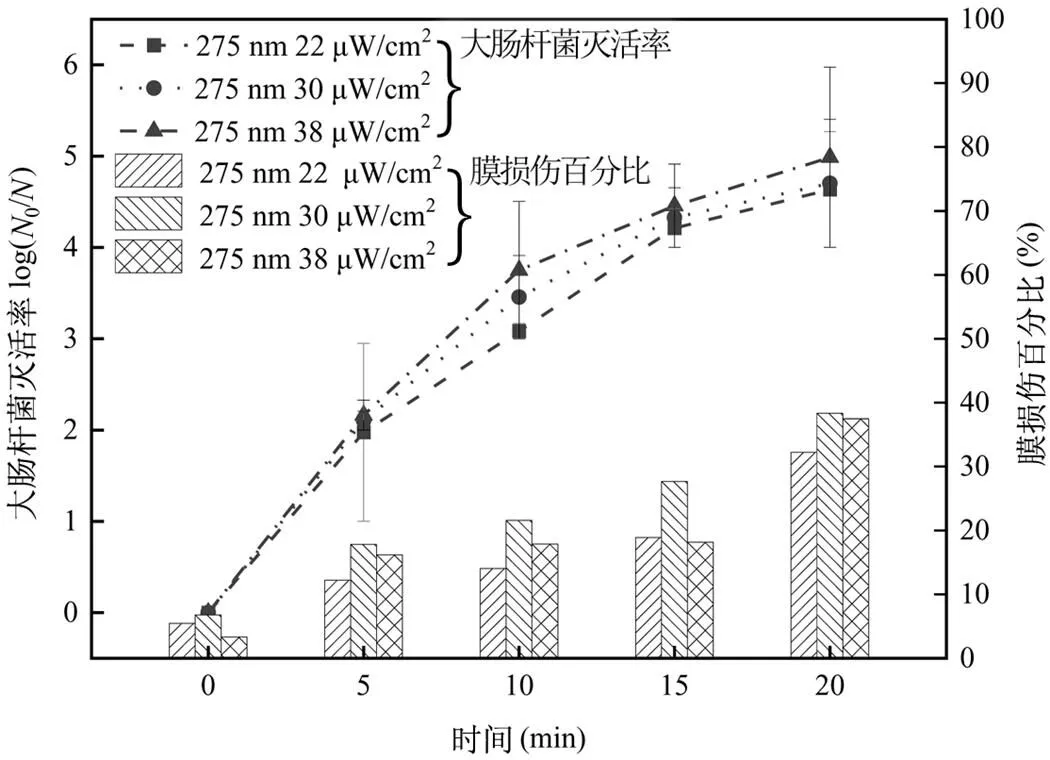
图4 辐照剂量对大肠杆菌灭活和膜损伤效果的影响
2.2.2 组合波长UV-LED的灭活 使用255nm (16.6μW/cm2)和275nm UV-LED (16.6, 22, 30, 38μW/cm2)组合消毒,得到灭活率和膜损伤效果如图5所示.
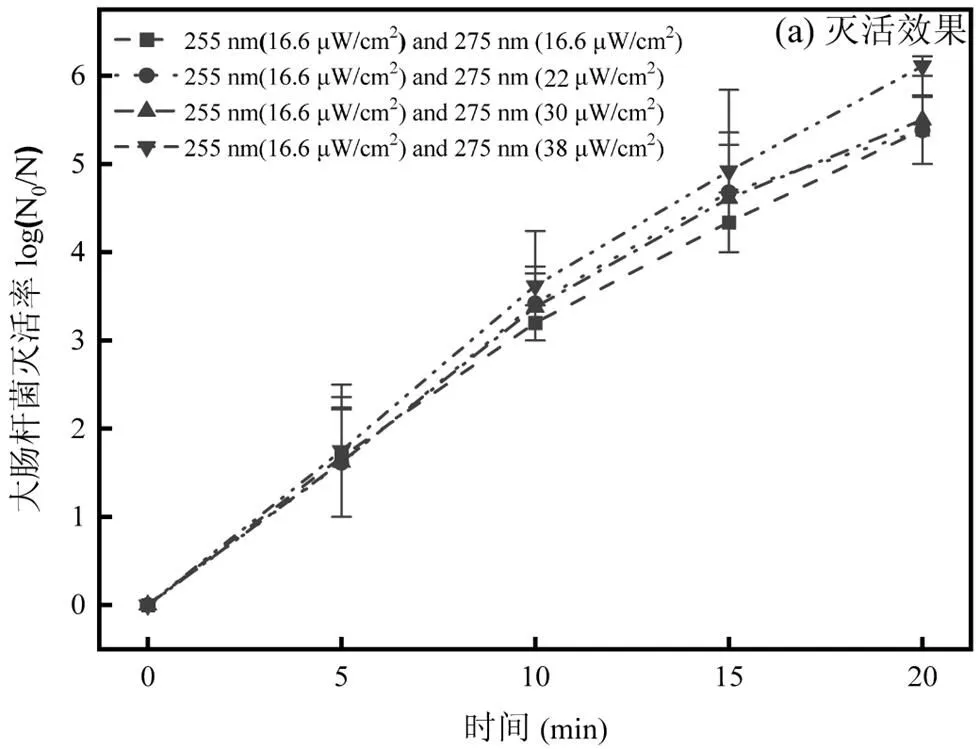
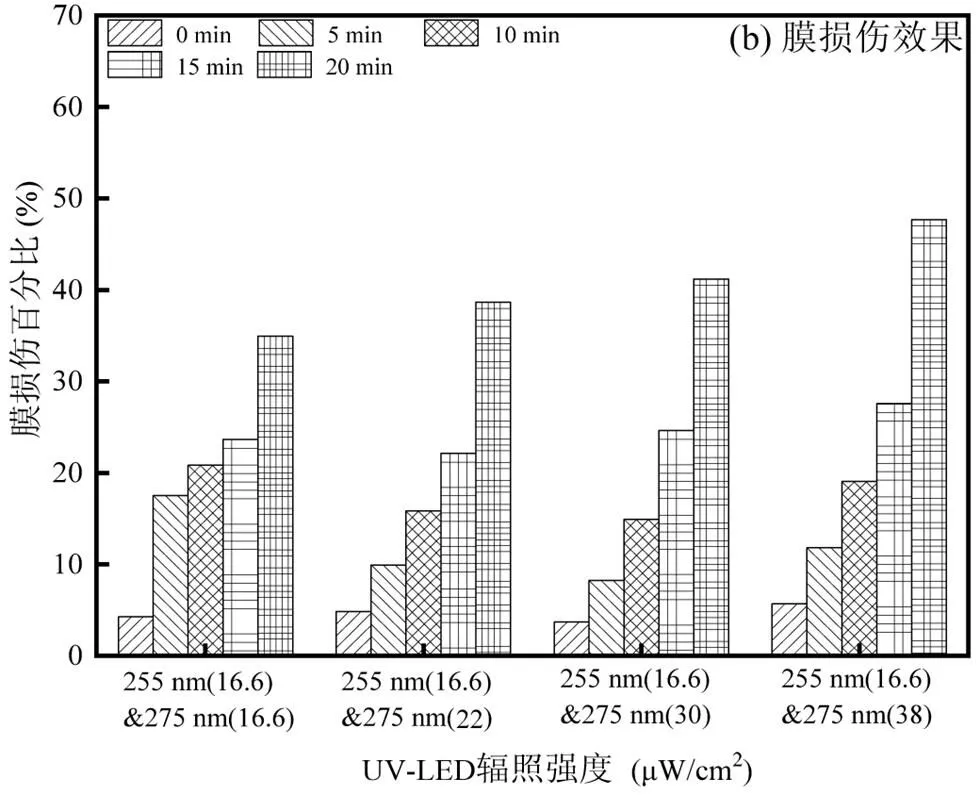
图5 双波长UV-LED对大肠杆菌的灭活及细胞膜损伤
四组实验条件中细菌灭活率最高的一组达到6.11log(255nm 16.6μW/cm2、275nm 38μW/cm2),其他三组分别为5.39log、5.38log、5.50log.相比于单波长,组合消毒未展现出“1+1>2”的效果. Nyangaresi等[8]采用267与275nm UV-LED组合灭活大肠杆菌同样未观察到协同效应.分析原因可能是275nm UV-LED对细菌造成的损伤主要作用于蛋白质相关成分, 而255nm主要作用于细胞内的DNA 和RNA,是降低细胞培养能力的主要因素,因此在275与255nm共同作用时未产生协同作用.在细胞膜损伤方面, UV-LED照射20min后,四种消毒条件下大肠杆菌细胞膜损伤均低于50%,细胞膜表现出较强的抗紫外线能力, 结合四种试验条件下细菌的灭活率,表明细菌在膜损伤前就失去了可培养能力,即膜未完全受损,细菌便失去培养能力[25].组合波长在细胞膜损伤上表现出叠加而非协同效应,即“1+1=2”.并且在Wan等[26]的研究中,使用30mJ/cm2265nm 和280nm UV-LED组合,相比于单波长消毒细菌细胞膜损伤百分比降低, UV-C波段组合消毒对于细菌细胞膜的损伤机理还需要进一步的研究.
2.3 超声波联合UV-LED对耐四环素大肠杆菌的灭活
基于上述试验结果,使用50W、33kHz超声波与组合波长(16.6μW/cm2255nm、38μW/cm2275nm) UV-LED联合灭活菌样,细菌灭活率及膜损伤如图6、7所示.联合消毒18min,细菌的灭活率达到7.45log,相比于组合波长UV-LED灭活率提高了1.34log,表明二者联合消毒产生了协同效应.
图7为流式细胞分析结果,从图中可以看出,随着消毒时间的增加,细胞膜损伤百分比有明显提升,消毒结束时细胞膜损伤百分比达到68.74%.高强度的超声波使大肠杆菌细胞膜出现多处损伤,且持续的超声波处理在破碎菌胶团的同时使细菌持续处于运动状态,使UV辐照效率变高从而使其灭活效能升高[27].此外,超声波通过空化作用在UV系统中引入活性氧,增强对DNA的损伤,消毒过程中形成的·OH氧化了含ARG的DNA,使其更好地吸收紫外光,从而提高灭活效率[12-22-28].
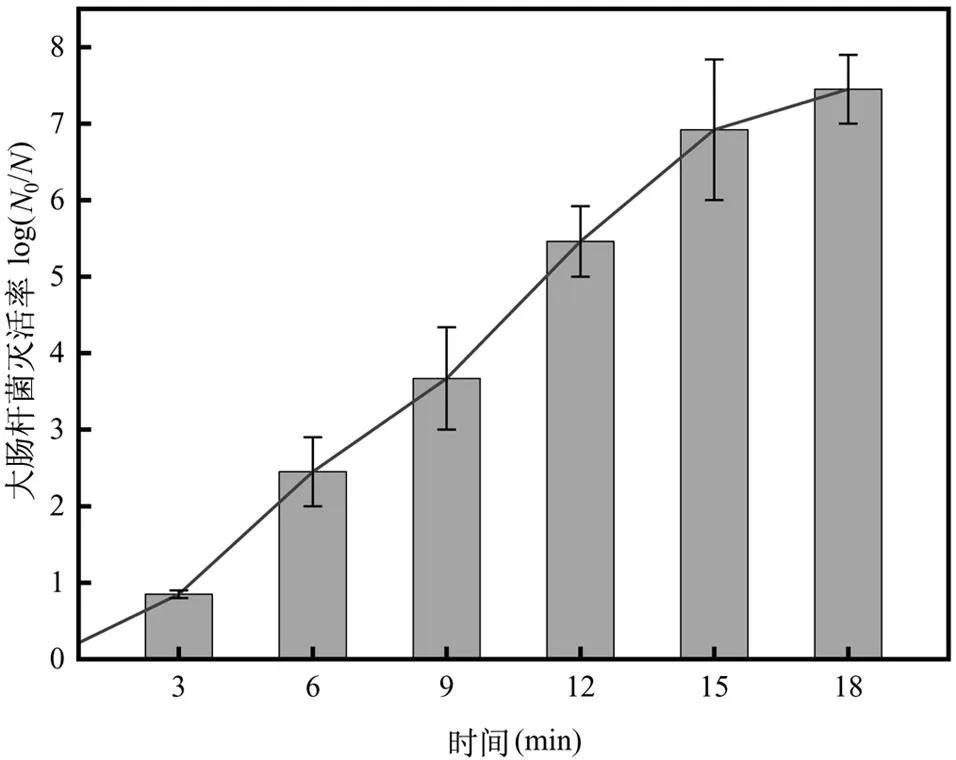
图6 超声联合双波长UV-LED对大肠杆菌的灭活
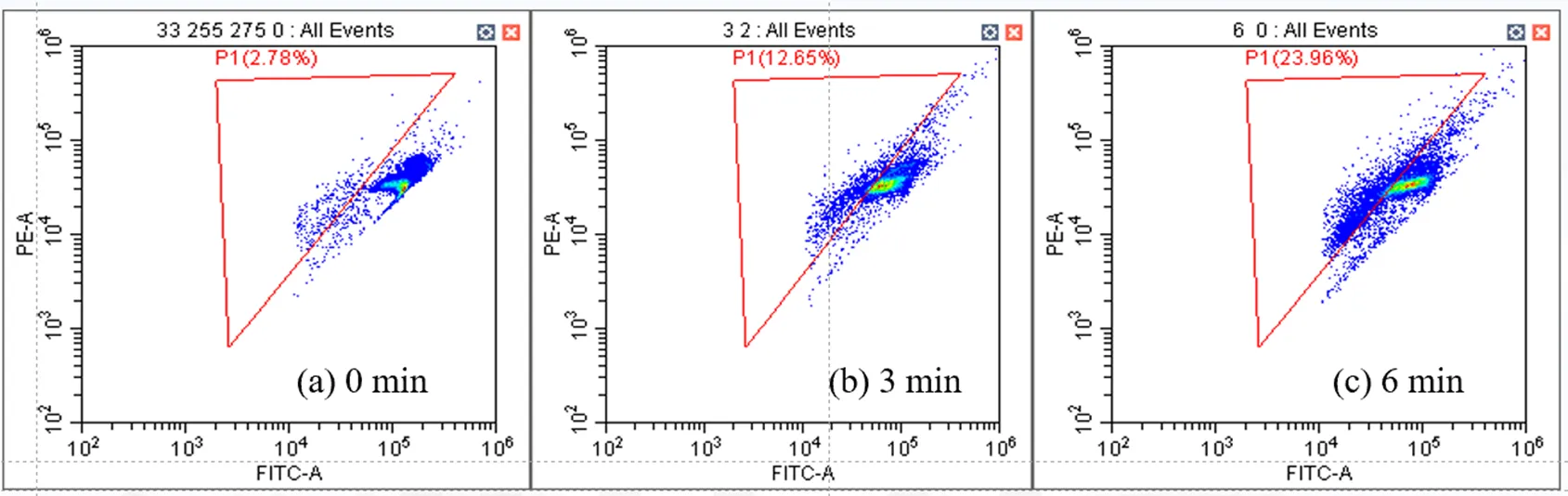
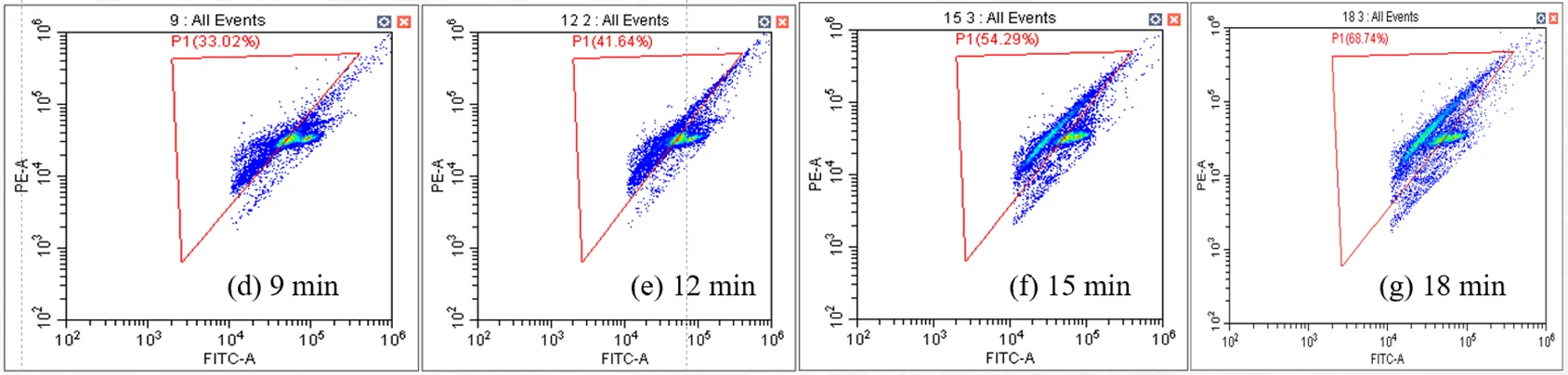
图7 超声联合双波长UV-LED消毒的流式细胞分析结果
P1区域代表细胞膜受损的细胞
2.4 光复活试验
为探究超声波联合UV-LED消毒是否可以抑制抗性大肠杆菌的光复活,对组合波长UV-LED以及超声波联合UV-LED消毒后的菌样进行光复活试验,结果如图8所示.使用组合波长UV-LED消毒后,大肠杆菌的浓度降低了6.11log,光复活8h内水样中大肠杆菌浓度迅速上升,细菌浓度增加了3.68log.8~24h,大肠杆菌浓度基本不变,表明细菌的可培养性基本恢复完全.由此可见,经过UV消毒后的大肠杆菌会在一定程度上光复活,这与UV的消毒原理有关.经过UV照射后,细菌细胞内的DNA双螺旋结构中相邻的嘧啶碱基形成二聚体,从而对DNA造成损伤,在光复活过程中,受损细胞的光解酶利用光子产生的能量直接将嘧啶二聚体分解为单体,从而实现损伤修复,进而使细菌恢复其可培养性[29].
使用超声波联合UV-LED消毒,大肠杆菌浓度降低了7.45log,光复活前0.5h内细菌浓度相比于消毒出水稍有降低,0.5~4h大肠杆菌浓度上升,可培养性恢复了1.28log.4~24h,细菌浓度逐渐降低至低于消毒出水中大肠杆菌的浓度.光复活结束时,大肠杆菌的浓度相比于消毒出水降低了0.94log.在0~0.5h细菌可培养性的降低说明在此期间仍有细菌丧失可培养性,引入超声降低了大肠杆菌的代谢活性.Kaur等[27]使用超声波消毒后4株大肠杆菌的代谢活性均接近于0,超声波的空化作用产生的机械作用、化学作用、热效应对细菌细胞膜的损伤具有延时作用,超声作用停止后,细菌细胞膜的损伤还在继续,造成细菌丧失其可培养性.相比于单独UV-LED消毒,超声波联合UV-LED消毒最大光复活浓度的出现提前了4h,且降低了2.4log.引入超声波联合消毒显著降低了抗性大肠杆菌的生长活力,且可以有效抑制光复活.
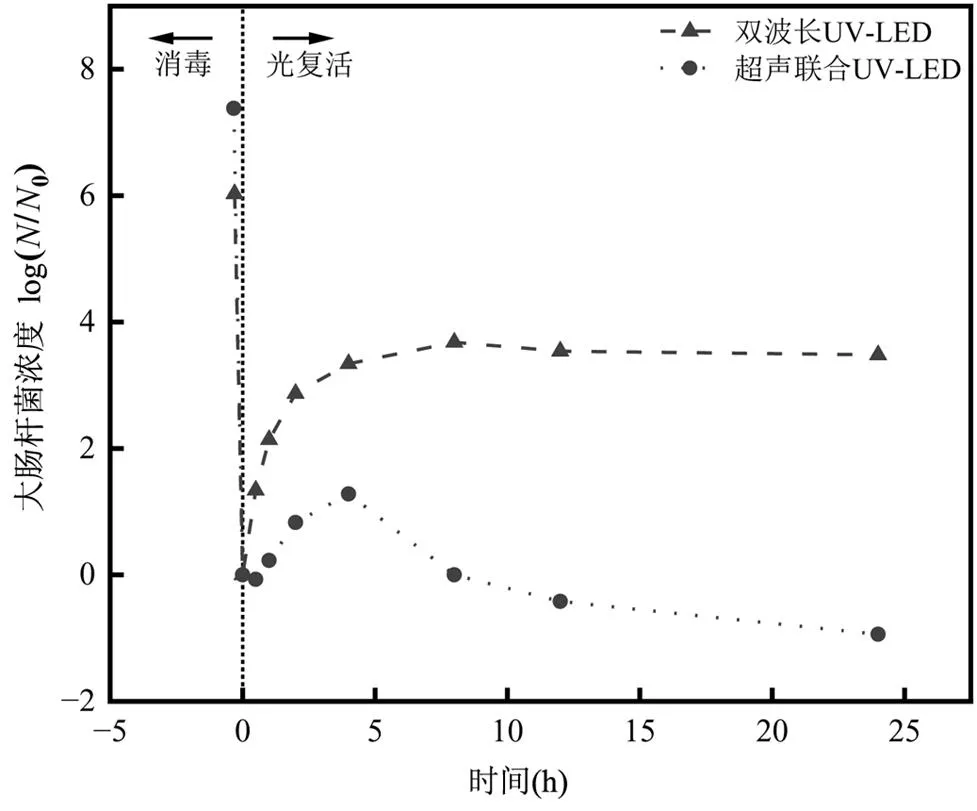
图8 超声联合双波长UV-LED消毒以及光复活24h内大肠杆菌的浓度变化
将本试验中得到的大肠杆菌光复活率与已有的研究结果进行比较,见表2.本试验得到的光复活率远低于已有文献中使用单波长或组合波长UV消毒后的光复活率.研究结果表明,采用超声波联合UV-LED在微生物消毒领域具有广泛的研究前景及应用价值.

表2 与文献中大肠杆菌光复活率比较
3 结论
3.1 超声波对于耐四环素大肠杆菌的灭活有一定效果,在膜损伤方面表现较好.低频超声波(33kHz)对于大肠杆菌的灭活及膜损伤效能优于高频超声波(120kHz、200kHz).
3.2 UV-LED可有效实现对耐四环素大肠杆菌的灭活,辐照剂量越高,细菌的灭活率越高.255nm UV-LED对耐四环素大肠杆菌的灭活效能更高,而275nm UV-LED对细胞膜的损伤效能更高.两种波长组合使用,未取得协同效应.经过组合UV-LED灭活后,部分细菌在UV-A照射条件下可实现复活,降低了ARB的总体灭活效率.
3.3 低频超声波(33kHz)与组合波长UV-LED (255nm/275nm)联合使用,提高大肠杆菌的灭活率,经过二者联合消毒后的细菌生长活力弱,二者联用很大程度抑制了抗性细菌的光复活,对于抗生素抗性细菌的灭活以及抑制光复活表现出较好的应用效果.
[1] Manaia C M, Rocha J, Scaccia N, et al. Antibiotic resistance in wastewater treatment plants: Tackling the black box [J]. Environment International, 2018,115:312-324.
[2] 马 奔,黄雅梦,王若楠,等.城市污水厂MCR-1基因及其携带菌的污染[J]. 中国环境科学, 2018,38(4):1433-1440.
Ma B, Huang Y M, Wang R N, et al. The pollution of MCR-1and MCR-1hosting bacteria in municipal wastewater treatment plants [J]. China Environmental Science, 2018,38(4):1433-1440.
[3] 张 悦,张广山,王 鹏.微波无极紫外方法对二沉池出水的消毒研究[J]. 中国环境科学, 2016,36(5):1463-1468.
Zhang Y, Zhang G S, Wang P. Disinfection for the municipal secondary effluents under microwave induced electrodeless ultraviolet irradiation [J]. China Environmental Science, 2016,36(5):1463-1468.
[4] Chen J, Loeb S, Kim J-H. LED revolution: fundamentals and prospects for UV disinfection applications [J]. Environmental Science: Water Research & Technology, 2017,3(2):188-202.
[5] Li X, Cai M, Wang L, et al. Evaluation survey of microbial disinfection methods in UV-LED water treatment systems [J]. Science of The Total Environment, 2019,659:1415-1427.
[6] Oguma K, Rattanakul S, Masaike M. Inactivation of health-related microorganisms in water using UV light-emitting diodes [J]. Water Supply, 2019,19(5):1507-1514.
[7] Friedberg E C, Walker G C, Siede W, et al. DNA repair and mutagenesis [M]. American Society for Microbiology Press, 2005.
[8] Nyangaresi P O, Qin Y, Chen G, et al. Effects of single and combined UV-LEDs on inactivation and subsequent reactivation ofin water disinfection [J]. Water Research, 2018,147:331-341.
[9] Beck S E, Ryu H, Boczek L A, et al. Evaluating UV-C LED disinfection performance and investigating potential dual-wavelength synergy [J]. Water Research, 2017,109:207-216.
[10] Li G-Q, Wang W-L, Huo Z-Y, et al. Comparison of UV-LED and low pressure UV for water disinfection: Photoreactivation and dark repair of Escherichia coli [J]. Water Research, 2017,126:134-143.
[11] M. Sango D, Abela D, Mcelhatton A, et al. Assisted ultrasound applications for the production of safe foods [J]. Journal of Applied Microbiology, 2014,116(5):1067-1083.
[12] Zhou X, Tian C, Zhao M, et al. Removal of tetracycline-resistant Escherichia coli and its genes through ultrasound treatment combined with ultraviolet light emitting diodes [J]. Environmental Research, 2021,197:111007.
[13] Zhou X, Guo H, Li Z, et al. Experimental study on the disinfection efficiencies of a continuous-flow ultrasound/ultraviolet baffled reactor [J]. Ultrasonics Sonochemistry, 2015,27:81-86.
[14] Joyce E, Al-Hashimi A, Mason T J. Assessing the effect of different ultrasonic frequencies on bacterial viability using flow cytometry [J]. Journal of Applied Microbiology, 2011,110(4):862-870.
[15] Ashokkumar M. The characterization of acoustic cavitation bubbles – An overview [J]. Ultrasonics Sonochemistry, 2011,18(4):864-872.
[16] Al Bsoul A, Magnin J-P, Commenges-Bernole N, et al. Effectiveness of ultrasound for the destruction of Mycobacterium sp. strain (6PY1) [J]. Ultrasonics Sonochemistry, 2010,17(1):106-110.
[17] Cui H Y, Wu J, Lin L. Inhibitory effect of liposome-entrapped lemongrass oil on the growth of Listeria monocytogenes in cheese [J]. Journal of Dairy Science, 2016,99(8):6097-6104.
[18] Xu L, Zhang C, Xu P, et al. Mechanisms of ultraviolet disinfection and chlorination of Escherichia coli: Culturability, membrane permeability, metabolism, and genetic damage [J]. Journal of Environmental Sciences, 2018,65:356-366.
[19] 徐丽梅,许鹏程,张崇淼,等.紫外线消毒对大肠杆菌的损伤及复苏的研究[J]. 中国环境科学, 2017,37(7):2639-2645.
Xu L M, Xu P C, Zhang C M, et al. Studies on the injury and reactivation of Escherichia coli under ultraviolet disinfection [J]. China Environmental Science, 2017,37(7):2639-2645.
[20] Wu J, Cheng S, Duan Y Z, et al. Kinetics and efficacy of membrane/ DNA damage to Bacillus subtilis and autochthonous bacteria during UV/chlorine treatment under different pH and irradiation wavelengths [J]. Chemical Engineering Journal, 2021,422:129885.
[21] Aoyagi Y, Takeuchi M, Yoshida K, et al. Inactivation of Bacterial Viruses in Water Using Deep Ultraviolet Semiconductor Light- Emitting Diode [J]. Journal of Environmental Engineering, 2011, 137(12):1215-1218.
[22] Liu N, Sijak S, Zheng M, et al. Aquatic photolysis of florfenicol and thiamphenicol under direct UV irradiation, UV/H2O2and UV/Fe(II) processes [J]. Chemical Engineering Journal, 2015,260:826-834.
[23] 李树铭,王 锦,王海潮,等.UV、O3及UV/O3削减耐药菌和抗性基因性能[J]. 中国环境科学, 2019,39(12):5145-5153.
Li S M, Wang J, Wang H C, et al. Reduction of ARB and ARGs by ultraviolet, ozone and combined disinfection technology [J]. China Environmental Science, 2019,39(12):5145-5153.
[24] Guo M, Huang J, Hu H, et al. Growth and Repair Potential of Three Species of Bacteria in Reclaimed Wastewater after UV Disinfection [J]. Biomedical and Environmental Sciences, 2011,24(4):400-407.
[25] Nocker A, Cheswick R, Dutheil De La Rochere P M, et al. When are bacteria dead? A step towards interpreting flow cytometry profiles after chlorine disinfection and membrane integrity staining [J]. Environmental Technology, 2017,38(7):891-900.
[26] Wan Q, Wen G, Cao R, et al. Simultaneously enhance the inactivation and inhibit the photoreactivation of fungal spores by the combination of UV-LEDs and chlorine: Kinetics and mechanisms [J]. Water Research, 2020,184:116143.
[27] Kaur J, Karthikeyan R, Pillai S D. Photoreactivation and dark repair of environmentalstrains following 24kHz continuous ultrasound and UV-C irradiation [J]. Journal of Environmental Science and Health, Part A, 2016,51(8):607-613.
[28] Rattanakul S, Oguma K. Analysis of Hydroxyl Radicals and Inactivation Mechanisms of Bacteriophage MS2 in Response to a Simultaneous Application of UV and Chlorine [J]. Environmental Science & Technology, 2017,51(1):455-462.
[29] 李培培,史 文,刘其根,等.千岛湖叶绿素a的时空分布及其与影响因子的相关分析[J]. 湖泊科学, 2011,23(4):568-574.
Li P P, Shi W, Liu Q G, et al. Spatial and temporal distribution patterns of chlorophyll-a and the correlation analysis with environmental factors in Lake Qiandao [J]. Journal of Lake Sciences, 2011,23(4): 568-574.
The inactivation efficiency of ultrasound combined with UV-LED on tetracycline-resistant Escherichia coli.
LI Song-wei1, ZHOU Xiao-qin1*, ZHAO Mei-juan1, LI Zi-fu1, XIA De-hua2
(1.School of Energy and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China;2.Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology(Sun Yat-sen University)), Guangzhou 510275, China)., 2023,43(12):6313~6320
In this study, the inactivation efficiency as well as membrane damage of tetracycline-resistantunder ultrasound at different frequencies (33, 120, 200kHz) and different UV-LED wavelengths (255, 275nm) were evaluated respectively, and furthermore, the optimized operation parameter were selected to form combined ultrasound and UV-LED process to control ARB in sewage effectively. The results showed that 33 kHz ultrasound alone was effective in ARB inactivation, and with an input power of 50 W accumulated to an input dose of 1080 KJ/L, the inactivation rate ofcan reach to 2.30 log, while the percentage of cell membrane damage was 61.09%. For UV-LED alone, when 255nm UV-LED irradiated at dosage of 19.92mJ/cm2, the inactivation rate of bacteria and the percentage of cell membrane damage were 5.32log and 2.52% respectively. While the inactivation rate and the percentage of cell membrane damage were 4.63 log and 34.95% respectively for 275nm UV-LED irradiation, but dual-wavelength UV-LED irradiation did not show synergistic effect in bacteria inactivation. However, ultrasound combined with UV-LED can obviously improve the disinfection efficiency, the inactivation rate increased to be 7.45log, the cell membrane damage increased to be 68.74%. Meanwhile, the photoreactivation rate of bacteria after disinfection was reduced to 0.4%. The combination of ultrasound and UV-LED shows great potential in ARB control during wastewater treatment.
resistant bacteria;ultrasound;UV-LED;inactivation efficiency;photoreactivation
X703.1
A
1000-6923(2023)12-6313-08
李松蔚,周晓琴,赵美娟,等.超声波联合UV-LED对耐四环素大肠杆菌的灭活效能 [J]. 中国环境科学, 2023,43(12):6313-6320.
Li S W, Zhou X Q, Zhao M J, et al. The inactivation efficiency of ultrasound combined with UV-LED on tetracycline-resistant Escherichia coli [J]. China Environmental Science, 2023,43(12):6313-6320.
2023-04-20
国家重点研发计划(2021YFC3201305);广东省环境污染控制与修复技术重点实验室开放基金资助项目(2020B1212060022)
* 责任作者, 副教授, zhouxiaoqin025@163.com
李松蔚(1999-),男,吉林省吉林市人,北京科技大学硕士研究生,主要研究方向为微污染物的生态效应.发表论文1篇. m202110177@xs.ustb.edu.cn.
