亚甲基蓝介导的电化学传感界面PCR鼠伤寒沙门氏菌检测方法
2024-01-06姚帮本徐建国
高 洁, 陈 伟, 洪 婷, 姚帮本, 姚 丽, 徐建国
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230601; 2.安徽省产品质量监督检验研究院,安徽 合肥 230051)
0 引 言
食源性致病菌污染是食品安全的一个重大问题,其中微生物性因素导致的食品不合格问题在国家食品安全抽检总体检测不合格项目中占比高达18.78%,是我国头号的食品安全问题[1]。
沙门氏菌(Salmonella)是最常见的食源性致病菌之一,70%~80%的细菌性食物中毒由沙门氏菌引起[2]。 我国每年有900多万人次因感染沙门氏菌患病,导致近800人死亡[3]。 沙门氏菌有2 650多种血清型,其中鼠伤寒沙门氏菌(Salmonellatyphimurium)感染发病率居沙门氏菌感染的首位,约占人源沙门氏菌感染的40%~80%,且对外界环境具有较强的抵抗力[4-5]。 感染者轻则表现为呕吐、脱水腹泻、肠胃炎,严重者可能发展为败血症以及全身性器官感染[6]。
目前,沙门氏菌的常规检测方法主要有传统的平板培养和生化鉴定法[7]、免疫学检测方法[8]等。 这些常规方法都需要复杂的前处理以及大型的专业仪器,且检测时间长达数天乃至一个星期,不能满足食品安全现场筛查需求[9]。 近年来开发出各种新型检测技术,如生物传感器技术[10]、微流控技术[11]、分子生物学检测方法[12-13]等。 该类型检测方法对检测仪器高度依赖,存在成本高、步骤多等缺点,因此急需开发一种快速、灵敏且微型化的检测方法,可以实现目标沙门氏菌的快速精准检测。 电化学方法具有快速、简便、灵敏的优点[14]。 丝网印刷电极与传统电极相比更易于操作,且能够大规模低成本制造,并具有广泛的修饰范围,具有极大的经济效益[15]。
本文提出在聚合酶链式反应(polymerase chain reaction,PCR)体系中加入电化学信号分子亚甲基蓝,利用丝网印刷电极对扩增产物进行快速、灵敏检测。 通过优化反应体系确保得到最佳的电化学信号。 在此基础上建立牛奶中鼠伤寒沙门氏菌的快速检测方法。
1 材料与方法
1.1 材料与试剂
实验所用菌种均来自于安徽省产品质量监督检验研究院食品化工所。 其中:阳性对照为鼠伤寒沙门氏菌ATCC14028;阴性对照为粪链球菌ATCC29212、大肠埃希氏菌O157 CICC10907、金黄色葡萄球菌ATCC6538、单增李斯特菌ATCC19111、副溶血性弧菌ATCC17802、铜绿假单胞菌ATCC15442。
所用的引物序列购于通用生物(安徽)股份有限公司,预期扩增片段大小为220 bp,上游引物序列:GTGGTTTTAAGCGTACTCTTCT;下游引物序列:CAAGTTGAGCTTTTTCCAGATC。
无水乙醇购于国药集团化学试剂有限公司;TE缓冲液、琼脂糖(低电渗)、4S Red Plus 核酸染料、ddH2O、PCR Mix均购于上海生工生物股份有限公司;亚甲基蓝购于百灵威科技有限公司;丝网印刷电极购于北京铭泰佳信科技有限公司。
1.2 仪器与设备
FA1104B型电子天平(上海精天电子仪器有限公司)、KQ218型超声仪(昆山市超声仪器有限公司)、Pico12高速冷冻离心机(赛默飞世尔科技(中国)有限公司)、MixTable微型涡旋混合仪(合肥艾本森科学仪器有限公司)、SW-CJ-2D型双人单面净化工作台(苏州净化设备有限公司)、DYY-6C型电泳仪(北京八一生物科技有限公司)、LG2020型凝胶成像仪(杭州朗基科学仪器有限公司)、LHP-160型生化培养箱(上海三发科学仪器有限公司)、Microcloth抛光布以及CHI650D电化学工作站(上海辰华仪器有限公司)。
1.3 方法
1.3.1 菌悬液的制备
菌液取出后充分涡旋混匀,5 000 r/min离心5 min后弃去上清液,加入等量无菌生理盐水重悬,重复2次即得到菌悬液。 取30 mL菌悬液加入270 mL无菌生理盐水后充分混匀,重复上述操作对菌悬液进行10倍浓度梯度稀释。
1.3.2 模板DNA的制备
取1 mL不同浓度鼠伤寒沙门氏菌8 000 r/min离心10 min,弃去上清液,向沉淀中加入500 μL SDS裂解液和60 μL蛋白酶K,涡旋混匀后室温放置30 min,100 ℃加热10 min后12 000 r/min离心10 min,所得的上清液即为DNA模板,4 ℃保存备用。
1.3.3 PCR扩增
PCR扩增体系包括PCR Mix 25 μL,上下游引物各0.8 μL(10 μmol/L),DNA模板2 μL,ddH2O11.4 μL,亚甲基蓝10 μL (10 μmol/L)。 PCR预扩增条件为:95 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃再延伸2 min。 反应结束后取5 μL扩增产物进行琼脂糖凝胶电泳中,观察扩增条带。 剩余PCR产物于4 ℃保存备用。
1.3.4 丝网印刷电极的预处理
在无水乙醇溶液中超声1 min后取出,纯水冲洗后,氮气吹干,在0.5 mol/L硫酸溶液中用循环伏安法(cyclic voltammerty,CV),(50 mV/s,-0.2 ~+1.2 V)扫描确认无杂峰后,纯水冲洗,氮气吹干,干燥密闭保存备用[16]。
1.3.5 电化学的检测
取30 μL反应后的PCR产物滴加到丝网印刷电极表面直接检测,差分脉冲伏安法(differential pulse voltammetry,DPV)工作参数如下:电压-0.1~-0.5 V,电位增量0.004 V,振幅 0.05 V,脉冲宽度0.05 s,采样间隔0.016 7 s,脉冲周期0.5 s,静置2 s。
1.3.6 实验参数的优化
在扩增过程中,加入不同体积(0.4、0.8、1.2、1.6、2.0 μL)的引物,确定引物最优量;设计不同的退火温度,确定最适退火温度;加入不同浓度的亚甲基蓝,确定指示剂最优量。
1.3.7 标准曲线的绘制
取10倍稀释的不同浓度的鼠伤寒沙门氏菌(3×101、3×102、3×103、3×104、3×105、3×106、3×107CFU/mL)进行扩增,取5 μL扩增产物电泳观察,取30 μL扩增产物电化学检测。 根据电化学信号值与细菌浓度关系确定线性范围,绘制标准曲线。
1.3.8 特异性验证
提取粪链球菌ATCC29212、大肠杆菌CICC10899、金黄色葡萄球菌ATCC6538、单增李斯特菌ATCC19111、副溶血性弧菌ATCC17802、铜绿假单胞菌ATCC15442、阪崎肠杆菌ATCC29544的DNA模板作为干扰组,验证本方法的特异性。
1.4 实际样本的制备
从当地超市购入预包装牛奶样品,在无菌环境中进行加标操作。 将1 mL各浓度的鼠伤寒沙门氏菌原液添加于9 mL牛奶样品中,涡旋震荡充分混匀后取1 mL样品用于提取DNA模板[17]。 将1 mL无菌水添加于9 mL牛奶样品中作为阴性对照。 采用本实验建立并优化的鼠伤寒沙门氏菌电化学检测方法对扩增产物进行检测,并对结果进行分析。
2 结果与分析
2.1 检测原理
检测原理如图1所示。

图1 实验原理
DNA是一条含磷酸酯键的长链聚阴离子,能够与很多电活性金属阳离子作用。 在扩增前加入的亚甲基蓝是嵌入式氧化/还原指示剂,随着PCR的进行,氧化/还原标记嵌入到生成的双链中,与DNA结合前后的电化学反应速率之间的差异导致扩增的阳性产物被检测到的电流变小[18]。 通过检测氧化/还原电流的变化,就能实现核酸扩增产物的电化学检测[19]。 阴性样本不含有DNA模板,不存在大量扩增的DNA,亚甲基蓝游离于溶液中,测得的电流值将明显大于阳性对照组。
2.2 可行性验证
可行性验证电泳结果如图2a所示,图2a中:泳道M为Marker(25~500 bp);泳道1为阴性对照;泳道2为220 bp的阳性扩增产物;泳道3为含10 μmol/L亚甲基蓝的阳性对照组,条带与泳道2相比均无区别;泳道4的亚甲基蓝浓度为100 μmol/L;泳道5的亚甲基蓝浓度为1 mmol/L,由图2a可知,亚甲基蓝浓度过高时抑制扩增。 可行性验证电化学检测结果如图2b所示。 由图2b可知,亚甲基蓝浓度为30 μmol/L时阳性对照组的电流值明显低于阴性对照组,可以实现电化学方法对扩增产物的检测。
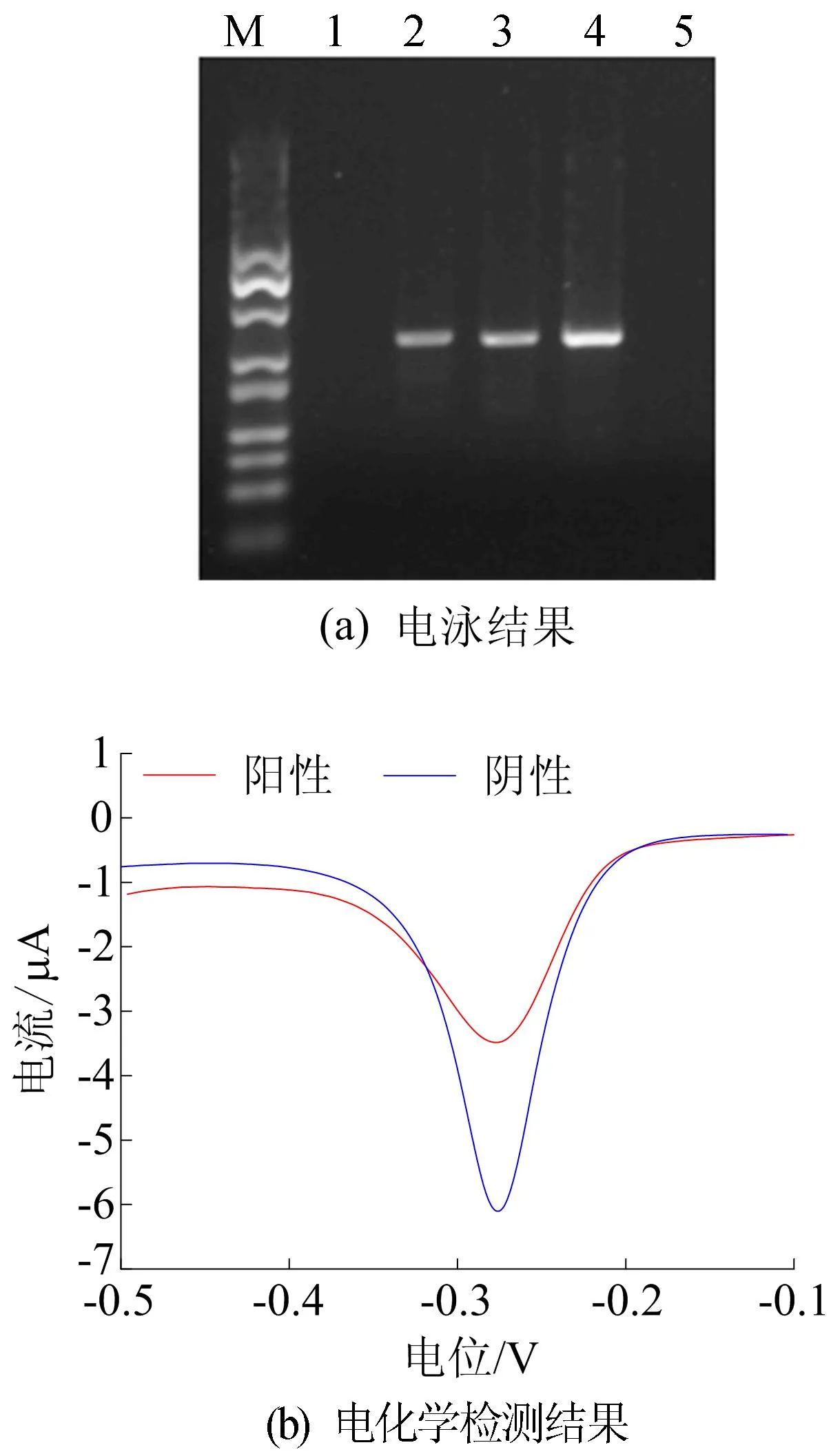
图2 可行性验证电泳和电化学检测结果
2.3 PCR扩增体系优化
引物量影响扩增效率。 引物量偏低时,扩增产物浓度低,会导致阴阳对照组电信号值区别不明显;引物量偏高时,可能会产生大量二聚体,亚甲基蓝也可以嵌入二聚体条带中,不利于检测扩增产物。 因此要选取合适的引物量,引物量优化结果如图3a所示。 泳道1~泳道5引物量分别为0.4、0.8、1.2、1.6、2.0 μL,泳道6为阴性对照组。 由图3a可知,当引物量为0.8~1.2 μL时扩增既不明显,二聚扩增产物也较多;当引物量大于1.2 μL时,电泳条带亮度不再增加,表明引物量为1.2 μL时扩增及检测结果较好。 从经济性结果考虑,选择1.2 μL为引物最佳添加量。
退火温度是影响PCR扩增特异性的重要参数,优化退火温度可以保证引物同目的序列有效退火,减少非特异性结合,退火温度优化结果如图3b所示。 泳道1~泳道7退火温度为62.0、61.5、60.5、59.0、57.2、55.9、54.8 ℃,泳道8为阴性对照。 当退火温度低于59.0 ℃时,扩增产物条带明显较暗,因此选择59 ℃为最佳退火温度。
亚甲基蓝浓度过高或过低时都会导致阴阳对照组电信号值差别较小,不利于检测。 亚甲基蓝浓度优化结果如图3c所示,当亚甲基蓝浓度为30 μmol/L时,阳性对照组电信号下降值最大,因此选择30 μmol/L为亚甲基蓝的最佳浓度。
2.4 标准曲线绘制分析
电泳结果和根据最佳反应条件所得的标准曲线如图4所示。 图4a中,泳道1~泳道8为3×107、3×106、3×105、3×104、3×103、3×102、3×101CFU/mL,泳道8为阴性对照。 由图4a可知,随着沙门氏菌浓度降低,扩增产物条带逐渐减弱。 由图4b可知,相应的电化学检测结果表明随着沙门氏菌浓度降低,电信号的减弱也越来越少。 沙门氏菌浓度在3×101~ 3×107CFU/mL之间时,电化学检测结果有良好的线性关系。

图4 电泳结果和标准曲线
2.5 特异性验证结果分析
特异性验证结果如图5所示。

图5 特异性实验结果
图5中:1为阴性;2为阳性;3为粪链球菌;4为大肠埃希氏菌;5为金黄色葡萄球菌;6为单增李斯特菌;7为副溶血性弧菌;8为铜绿假单胞菌;9为对照菌种混合组。 结果表明只有在存在目标物时电信号才会明显降低,特异性良好。
2.6 牛奶样品的检测结果
牛奶样品中的标准曲线如图6所示,由图6可知,沙门氏菌浓度在3×101~3×107CFU/mL之间时,其检测结果有良好的线性关系。 表明该方法适用于复杂基质的实际样品,有望实现实际应用。

图6 实际样品实验结果
3 结 论
本文通过在扩增体系中加入电化学信标分子亚甲基蓝实现了对扩增产物的电化学检测。 所提出的模板提取方法快捷、可行,结合PCR扩增可在120 min内实现对鼠伤寒沙门氏菌快速灵敏的检测,适用于牛奶样品的快速检测。
本文所建立的电化学检测方法快速、灵敏,有望应用于现场快速检测。 在此基础上开发细菌快速裂解办法和等温扩增技术并结合微流控芯片等设备,可以将检测用时缩短1/2且集成到便携式设备中,有望在未来实现电化学分子扩增实时监测,可以使食品安全预警前移,扩大食品安全控制范围,为现场快速检测奠定了良好的基础。
