婴儿鼻软骨间叶性错构瘤1例
2024-01-04李文斌
李文斌
浙江大学医学院附属儿童医院放射科,浙江 杭州 310000
1 资 料
患儿,男性,3个月8天,睡时张口呼吸1个月。实验室检查未见明显异常。查体:双侧鼻腔黏膜充血,右侧鼻道狭窄,下鼻甲肥大肿胀,嗅裂及鼻中道未见涕。行纤维喉镜鼻咽镜检查示右侧鼻腔肿物,鼻中隔受压明显左偏。患儿既往体健,无外伤及手术史,无恶性肿瘤家族史。
计算机体层成像(computed tomography,CT)平扫及增强扫描:右鼻腔内见类圆形混杂密度肿块,病灶内可见斑片状及中心向四周放射状钙化影,病灶边界尚清,大小约2.1 cm×2.8 cm×2.7 cm,平扫实性部分平均CT值约43 HU,增强扫描实质部分呈不均匀强化,动脉期、静脉期及延迟期平均CT值分别为54、71及79 HU,邻近右侧筛窦及上颌窦部分骨质破坏,右侧眼眶内下壁受压内陷,鼻中隔受压左偏,右侧鼻道部分不通畅(图1)。
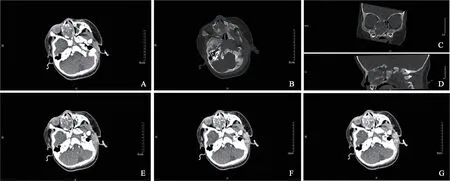
图1 鼻腔鼻软骨间叶性错构瘤CT图像
患儿行鼻内镜下右侧鼻腔肿物切除术,术中见右侧鼻腔肿物,表面光滑,压迫鼻中隔及鼻腔外侧壁。镜下所见:黏膜软骨成片分布,散在梭形细胞及板层骨组织(图2)。免疫组织化学及癌基因检测:CDK4(细胞质+),c-myc(-),RB(+),P53(+),S-100(+),Vimentin(+),β-catenin(细胞质+),ALK(-),Desmin(细胞质+),H3K27me3(+),H3K27M(-),INI1(+),Ki-67增殖指数(约2%+),BRG1(+),SMA(-)。病理学诊断为婴儿鼻软骨间叶性错构瘤。
患儿术后5个月电话回访,家长口述患儿恢复良好,无明显不适症状。
2 讨 论
鼻腔鼻窦错构瘤是一种罕见的良性病变,根据组织学及细胞学特征将其进一步分为呼吸道上皮腺瘤样错构瘤(respiratory epithelial adenomatoid hamartoma,REAH)、浆液黏液腺错构瘤(seromucinous hamartoma,SH)、软骨-骨呼吸上皮性腺瘤样错构瘤(chondro-osseous and respiratory epithelial hamartoma,CORE)、鼻软骨间叶性错构瘤(nasal chondromesenchymal hamartoma,NCMH);REAH和SH由呼吸道上皮和浆液腺组成,CORE与REAH相近,但具有软骨和/或骨组织的特征;NCMH由软骨和间质成分组成,但不含上皮成分。这4种病变都可以表现为鼻腔鼻窦肿块,并伴有相关的梗阻症状,如鼻塞、鼻出血、鼻窦炎等[1]。
NCMH多见于新生儿及儿童,在成人中极罕见,由不规则软骨岛、梭形细胞、钙化结构、黏液基质等构成,无明显恶性增生特征,其初始表现为良性状态、生长缓慢,但常常伴随局部组织坏死甚至骨侵蚀,根据肿物的大小及位置,可有不同的临床特征,表现为鼻塞、鼻出血、流涕、视觉障碍、中耳炎、喂养困难、甚至面部畸形,若肿物侵及眼眶或颅底,可导致上睑下垂、斜视、眼球突出或内陷、眼球运动障碍和神经功能障碍等[2]。
在CT图像中,NCMH可表现为密度不均匀的软组织肿块,以实性或囊性成分为主,伴或不伴钙化,肿瘤的实性成分常明显强化,可伴邻近骨质重塑、变薄、侵蚀,磁共振成像(magnetic resonance imaging,MRI)表现为混杂信号肿块,T1加权成像(T1-weighted imaging,T1WI)呈不均匀低信号,T2加权成像(T2-weighted imaging,T2WI)呈高信号,增强后肿块强化不均匀[3-4]。CT能更好地显示骨质增生、破坏、重塑及钙化的存在,MRI软组织分辨率高,能更好地显示肿瘤组织成分及对邻近结构的侵犯范围。对于筛板不完全骨化的婴幼儿,MRI具有分辨率高、无辐射、无创等优点,对评估肿瘤颅内侵犯特别有帮助,当眼眶有侵犯时,MRI在评估眶内容物,包括眼外肌、视神经和眼球受累方面优于CT[5]。
本研究患儿CT表现为混杂密度肿块伴其内放射状钙化,邻近骨质破坏,增强后强化不均匀,与文献[3]报道基本相符。NCMH需与以下病变相鉴别:① 鼻软骨肉瘤,成年人常见,平均中位年龄约40岁,典型CT表现为软组织肿块内散在钙化,增强后呈低或中度强化,常伴周围结构侵犯或骨质破坏,MRI T1WI上多为低或等信号,T2WI上多为不均匀高信号,典型表现为增强后呈边缘及间隔明显强化[6];影像学表现上鼻软骨肉瘤与NCMH鉴别较为困难,两者发病年龄的不同可作为鉴别参考依据;② 非霍奇金淋巴瘤(non-Hodgkins lymphoma,NHL),通常密度均匀,少见坏死,增强后呈轻度均匀强化,多为浸润性生长[3,7],与NCMH影像学表现不一致。③ 嗅神经母细胞瘤(olfactory neuroblastoma,ONB),肿瘤较大时病灶中央可有点状坏死和钙化,增强后病灶呈明显强化,囊性成分不强化;MRI表现为T1WI稍低或等信号,T2WI稍高或等于脑实质信号;ONB骨质改变的特征性表现为以鼻腔顶部中线为中心的边缘光整的骨质破坏或磨玻璃样骨质增生硬化[8],颅内病灶内囊肿的存在高度提示嗅神经母细胞瘤[9]。④ 脑膜脑膨出,CT可清晰显示骨质缺损,膨出的包块通过颅骨缺损处与颅内相连,MRI信号混杂,脑组织呈T1WI、T2WI等信号,脑脊液呈T1WI低信号,T2WI等信号,增强后脑组织与正常脑组织强化相似[10]。脑膜脑膨出影像学表现较典型,较好鉴别。
临床上多采取手术完全切除病变,并且能够取得良好的效果,但对于侵犯颅底的肿物,能否将其彻底切除是影响手术复发与否的关键因素。无论病变组织大小及在鼻腔的具体位置,鼻内镜手术仍是该病的一线治疗手段。
近年来有研究[11]证明,NCMH的病因与DICER1突变相关,DICER1基因位于染色体14q32.13上,是mRNA表达的关键调控因子。2009年Hill等[12]报道了包括家族性胸膜肺母细胞瘤在内的一种特殊的人类疾病综合征与DICER1胚系突变的关系。随着时间的推移,与DICER1相关的肿瘤范围扩大到包括卵巢性索-间质细胞瘤、囊性肾瘤、肾肉瘤、肾母细胞瘤、甲状腺结节增生和甲状腺癌、鼻软骨间叶性错构瘤、胚胎性横纹肌肉、睫状体髓上皮瘤、垂体母细胞瘤和松果体母细胞瘤[13]。大多数DICER1相关肿瘤的风险在儿童早期最高,成年后下降,对患者个人和其看护者的教育以及基于成像的监测是主要监测策略。遗憾的是,本例患儿未行基因检测,无法确定其有无DICER1突变。Kim等[14]报道了1例确诊DICER1综合征的患儿疾病发展情况,该患儿8岁时确诊左侧肾母细胞瘤,随后发现多发性结节性甲状腺肿、右肾囊性肾瘤,16岁时确诊鼻软骨间叶性错构瘤。根据有关专家共识[13],建议患有NCMH的患者行DICER1基因检测,若为突变,后期建议对肺、肾、妇科、甲状腺、眼、耳鼻喉等进行多学科联合监测,追踪其术后情况。
