肺炎型浸润性黏液腺癌的影像学表现并文献回顾
2024-01-04何晓宁杨秀芹单裕清
王 超,夏 天,何晓宁,杨秀芹,安 静,单裕清
1.日照市人民医院影像科,山东 日照276800;
2.日照市中医医院影像科,山东 日照276800;
3.日照市人民医院病理科,山东 日照276800
肺浸润性黏液腺癌(invasive mucinous adenocarcinoma,IMA)是一种较为罕见的肺恶性肿瘤[1]。早期的肺肿瘤分类中将支气管肺泡癌分为黏液型、非黏液型和混合型,2011年,肺腺癌国际多学科分类新标准,将原来的黏液型细支气管肺泡癌单独列出,也就是将肺黏液腺癌列为一种特殊的肺腺癌类型[2]。2015年,世界卫生组织(World Health Organization,WHO)肺肿瘤分类更是将IMA作为一种单独类别的肺肿瘤[3],IMA根据其计算机体层成像(computed tomography,CT)影像学表现可分为结节肿块型和肺炎型,肺炎型IMA已被证实生存率低于结节肿块型[4]。以往对于肺炎型IMA的影像学表现没有充分的认识,往往误诊为普通肺炎而延误病情,所以及时、准确地诊断该病极为重要。与结节肿块型相比,肺炎型IMA更为少见,国内相关影像学研究报道较少、样本量较小,对该病的认识仍处在一个不断发现、不断完善的过程中[5-7]。针对肺炎型IMA对临床诊疗带来的巨大挑战,本文回顾并分析经病理学检查证实的23例肺炎型IMA的临床与影像学资料,分析该病的影像学征象,并与病理学检查结果对照,旨在提高对肺炎型IMA早期诊断的准确度,为临床诊疗提供帮助。
1 资料和方法
1.1 研究对象
收集2013年10月—2022年6月日照市人民医院经病理学检查确诊的23例肺炎型IMA患者的临床、影像学及病理学资料。23例患者中,男性13例,女性10例,年龄28~76岁,平均年龄(55.35±8.55)岁。其中16例行CT引导下经皮肺穿刺活检证实为肺炎型IMA,4例经支气管镜活检证实,3例经外科手术后病理学检查证实。
1.2 仪器与方法
采用德国Siemens公司的Sensation 16及SOMATOM Definition Flash CT机对所有患者行胸部平扫及增强扫描。患者取仰卧位,扫描范围自肺尖至肺底。扫描参数:管电压120 kV,管电流自动调整(80~200 mA),薄层重建(层厚1 mm,层间距1 mm)。增强扫描采用非离子型碘对比剂碘比醇(含碘350 mg/mL)、经肘前静脉进行注射,注射速率为3.0 mL/s,注射用量1.5~2.0 mL/kg,动脉期25~30 s,静脉期55~60 s。然后利用多平面重建(multiplanar reconstruction,MPR)功能,对病变形态及与周围血管、胸膜的关系等进行多方位观察。
1.3 影像学分析
由2名高年资主治以上影像科医师对23例肺炎型IMA患者的胸部CT进行征象分析,包括病变位置、数目、形态、密度、边界、强化幅度、纵隔肺门淋巴结、胸腔积液及远处转移,意见不一致时经讨论达成一致。
2 结 果
2.1 临床诊断过程
23例患者中以咳嗽为症状发现13例,其中典型的咳白色黏液痰6例,伴低热5例;其他原因查体发现10例。实验室检查:23例患者肿瘤标志物均未见明显升高。CT首诊误诊为普通肺炎9例,干酪性肺炎1例,机化性肺炎1例,其中1例经抗炎治疗5 d咳嗽症状消失,CT复查病灶范围缩小(图1),8个月后再次入院,病变范围再次明显增大。16例行CT引导下经皮肺穿刺活检证实,其中2例首次CT引导下穿刺活检病理学报告为炎症,1例经支气管镜肺组织活检结果示(隆突前)少许支气管软骨组织,后经抗炎治疗,CT复查病灶增大,行CT引导下穿刺活检证实;4例经支气管镜肺组织活检证实;3例行外科手术切除病理学检查证实,其中2例手术后1年内出现双肺多发性转移。

图1 典型病例1(患者,男性,64岁)肺炎型IMA CT图像
2.2 影像学表现
23例肺炎型IMA患者中多发病灶9例,单发14例;以肺外周分布为主16例,中心性分布2例,弥漫性分布5例;上叶3例,中叶3例,下叶为主17例(73.9%)。病灶实性成分较少,表现为斑片状实变影伴周边磨玻璃密度影(groundglass opacity,GGO)23例(100.0%,图2A、B),病灶内见“充气支气管”征17例(73.9%,图2C)(包括“枯树枝”征11例),叶间裂膨隆征6例(26.1%,图2F);病灶内可见囊腔或空洞影15例(65.2%,图2D、E),双肺或单肺伴发不规则结节7例(30.4%,图2B、D);23例增强扫描均见范围不一轻中度强化区,CT血管造影征19例(82.6%,图2F)。23例患者均未见胸腔积液、淋巴结肿大及远处转移。23例患者影像学表现详见表1。
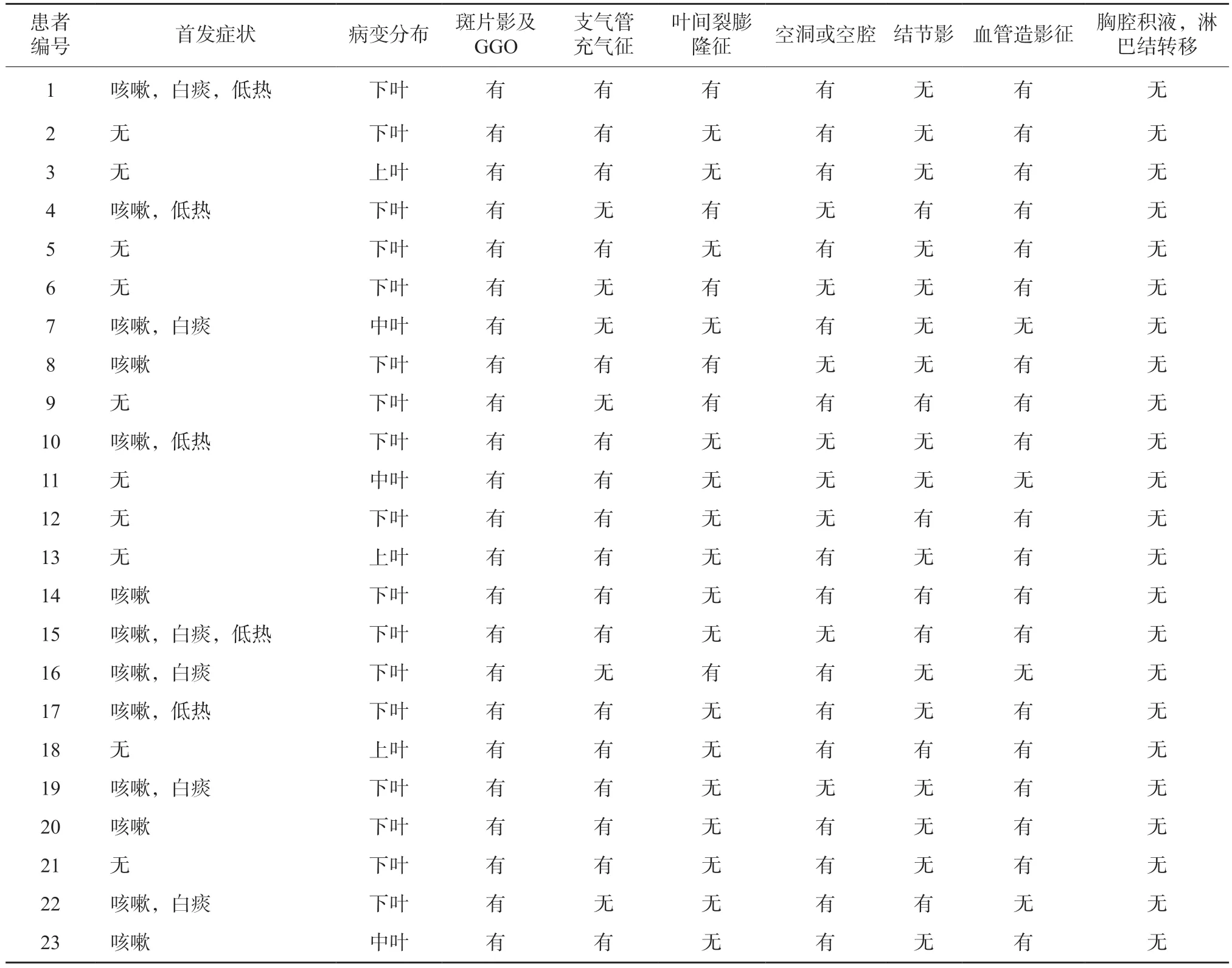
表1 23例肺炎型IMA影像学表现
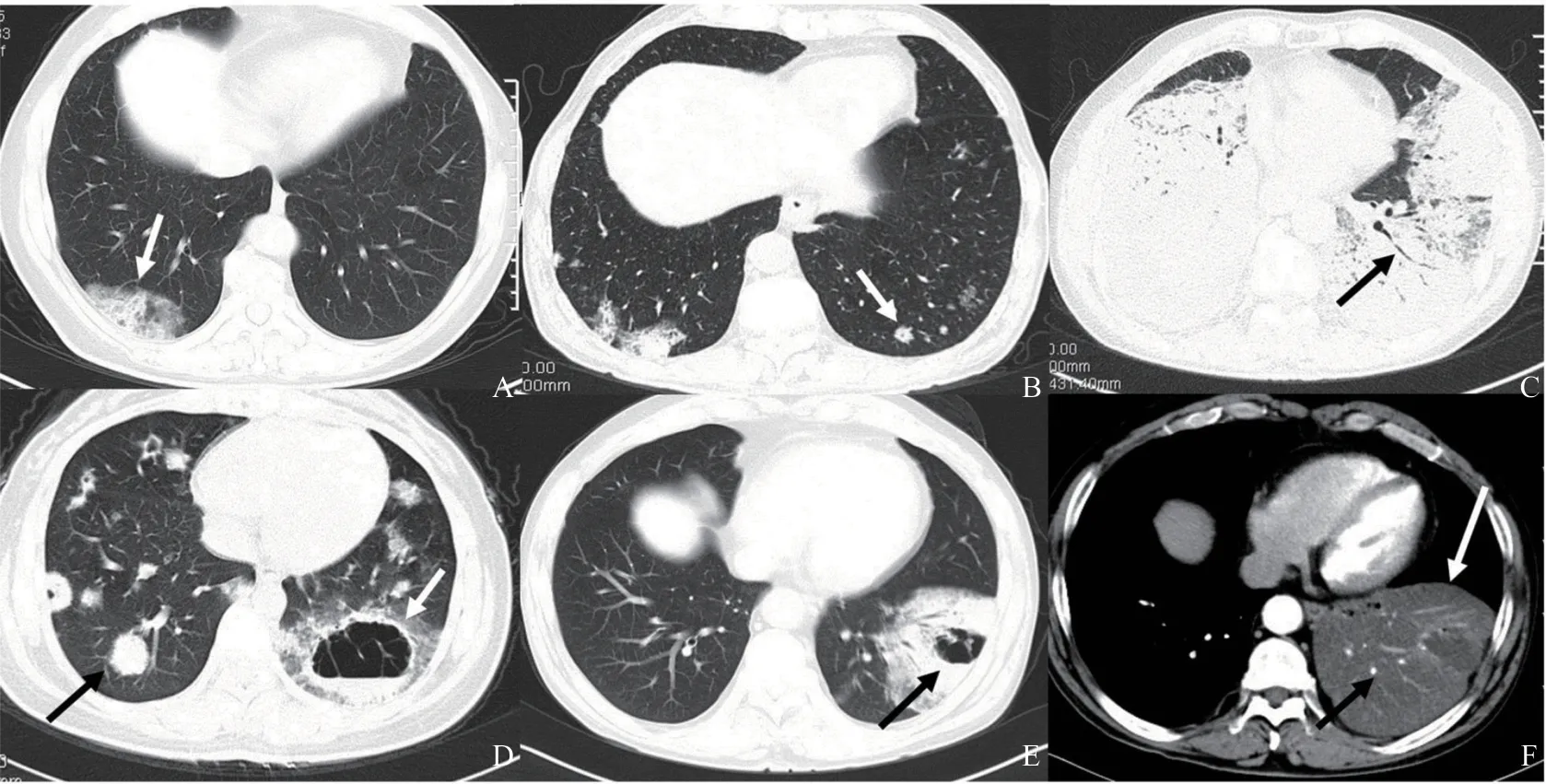
图2 多个典型肺炎型IMA病例CT图像
2.3 病理学表现
镜下可见沿肺泡壁排列的高柱状细胞,胞质嗜酸性,富有黏液,肺泡腔扩大并可见大量黏液(黏液湖),细胞核具有轻度异型性,肺泡壁基本完整(图3),部分免疫组织化学检查可见TTF-1阳性、CK-7阳性,支持黏液腺癌的诊断。

图3 肺炎型IMA病理学表现
3 讨 论
肺炎型IMA以肺实变为主要表现,因其容易发生气道播散,与结节型IMA相比,患者预后较差[8-9],且与肺炎的表现相似,在CT图像上很难鉴别,这给临床诊疗带来了极大的挑战。
3.1 临床诊疗
肺炎型IMA可发生于任何年龄段,本研究中,患者平均年龄为(55.35±8.55)岁,男女性别比为1.3∶1.0,显示患者以中老年为主,且男女性别差异并不明显,与既往研究[7,10]一致。23例患者中以咳嗽为症状发现13例,其中咳白色黏液痰6例,有研究[11]已证实,咳白色黏液痰是该病的一个典型症状,但在本研究中仅占部分,可见该临床表现并无特异性,肺炎型IMA发病十分隐秘,其中首诊CT误诊肺炎11例,其中1例经抗炎治疗后出现病变范围缩小,但其后又出现范围增大,表现为病情反复(图1)。在穿刺活检证实的患者中,有2例首次穿刺活检示炎性病变,由此可见作为诊断重要手段之一的CT引导下穿刺活检,并不能100.0%命中肿瘤组织,这可能与肺炎型IMA合并感染,以及病变沿支气管播散、跳跃式生长有关,利用黏液及炎性细胞作“掩护”,逃避穿刺针的捕捉。
3.2 影像学表现
3.2.1 GGO、结节影及实变影
许多肺部疾病都可以表现出GGO及实变影,GGO可以是一种反应性的炎性改变过程,本文中所有的病灶都表现为斑片状实变影伴GGO,边界清晰或不清晰。黏液腺癌会产生黏液,肿瘤细胞随着黏液沿肺泡间隔生长,对气腔和肺泡不完全填充,造成受累区域气体减少,肺内结构尚完整,即形成GGO[12-13],这也是肿瘤浸润性生长的表现,当肺泡被完全填充,GGO可能会相互融合而形成小结节,本文中部分患者(30.4%)出现结节影,结节的存在往往预示着肿瘤的多中心生长和气道转移。有研究[14]表明,肺炎型IMA中出现孤立小结节影是影响预后的重要因素。多个小结节融合,加之黏液的扩散,将逐渐形成肺实变影,此过程也是肺炎型IMA肿瘤细胞的扩散过程。有研究[7]认为,肺炎型IMA的GGO边缘较清晰,与普通炎症模糊的渗出不同,这与肿瘤细胞沿支气管、肺泡生长有关。与之不同的是,本组中存在边缘模糊的GGO,由于肺炎型IMA的GGO通常不会单纯仅有肿瘤细胞,当合并感染时,GGO的边界将会变得模糊。在本文中,部分患者在抗炎治疗后症状消失,CT上病变范围缩小,可以看到小气道内病变及GGO消散,较为罕见,外国学者[15]将其称为SRA,国内尚未有明确的中文名称,我们暂且称之为气道病灶自发消散,并指出存在SRA现象的患者处于较高的疾病阶段,有较高的死亡率[16],但这是由于炎性细胞的减少还是肿瘤细胞的减少尚有待进一步研究。Saito等[17]报道,在病理学观察下,黏液蛋白扩散范围与影像学表现范围差异无统计学意义,而肿瘤细胞浸润范围明显小于影像上的范围。因此,本文认为,漂浮在黏液中的肿瘤细胞可以随着时间而移动,以及合并感染的发生,使得SRA的出现是合理的,但其对临床诊断会造成病情好转的错觉,需引起重视。这可能也是CT引导下穿刺活检出现阴性的原因。
3.2.2 “充气支气管”征包括“枯树枝”征
本文中有17例(73.9%)出现“充气支气管”征,“充气支气管”征即在肺实变的背景下,充满空气的支气管显得尤为突出的现象,这种征象在大叶性肺炎中非常常见。对于肺炎型IMA来说,肿瘤细胞沿支气管壁、肺泡壁生长以及黏液的填充,当支气管破坏较轻、结构完整时,表现为光滑的“充气支气管”征[18],此时很难与炎性病变相区分;如果大量黏液阻塞了细小支气管,造成支气管分支减少,或者肿瘤细胞侵犯支气管,造成支气管变得扭曲、僵直,此时支气管就会变的像枯树枝一样[19],“枯树枝”征常被看作一种恶性征象。许多研究[20-21]已表明“充气支气管”征和“枯树枝”征对肺炎型IMA的诊断有一定的提示意义。
3.2.3 叶间裂膨隆
本组所示的病变以肺下叶为主(73.9%),部分患者表现为“叶间裂膨隆”征。肺炎型IMA的肿瘤细胞分泌大量黏液,细胞内外黏液较多,因重力作用,黏液聚集在了肺下叶及叶间裂处,叶间裂受压造成了膨隆样变。除此之外,大量黏液导致的胶样实变使得受累肺组织体积增大,也是叶间裂膨隆的原因之一[22]。同样的征象也经常出现在肺炎链球菌、肺炎克雷伯杆菌的感染中。
3.2.4 空腔与假空洞
本文中空腔及空洞影出现率为65.2%,略高于一些结节肿块型的研究[23-24]报道,可能与样本量有关。空腔影即黏液填充支气管及肺泡,造成气道阻塞,形成活瓣作用,使生理腔隙气体增多而扩大。而空洞的形成可能与肿瘤区域缺氧坏死或肺泡破裂细胞脱落经通畅的支气管咳出有关[25-27],这也是患者咳白色黏液痰的原因。但是空腔与假空洞有时在影像上较难区分。
3.2.5 强化方式与其他表现
所有患者增强扫描均见范围不一的轻中度强化区以及无强化区,这与普通肺腺癌及肺炎是完全不同的,这可以作为肺炎型IMA特征性的影像学征象,部分可见“血管造影”征(82.6%),这与以往的报道[28-29]相符。这种强化方式是由黏液分布的不均匀所决定的,黏液较多、肿瘤细胞较少的区域可呈轻度强化,黏液少的区域可呈中度强化,而完全的黏液区可无强化;“血管造影”征是较为常见的,因肿瘤的破坏力小,对血管的侵犯较少,使得显影血管在大量低强化黏液的背景下显得尤为突出。除此之外,本文所有患者均未见胸腔积液、淋巴结肿大及远处转移,推测这可能与肿瘤主要沿气道播散有关,较少侵犯胸膜及经淋巴道转移。
3.3 病理学特征与影像学表现的联系
镜下可见沿肺泡壁排列的能够分泌大量黏液的高柱状细胞,肺泡腔扩大并可见大量黏液,形成“黏液湖”,细胞核具有轻度异型性,这些都是肿瘤恶性程度较低、对气道破坏力较小、沿气道生长的表现,与影像学表现相符;免疫组织化学TTF-1阳性、CK-7阳性,则符合肺腺癌的诊断,与王庆宜等[26]的研究一致。
综上所述,肺炎型IMA虽然较难诊断,但其仍有一定特异性的影像学表现。该病发病隐匿,常以肺炎表现或查体发现,好发于肺下叶及外周,实性成分较少,表现为肺实变影伴磨玻璃影、结节影,内部可见“充气支气管”征及“枯树枝”征,可伴空腔及空洞,邻近叶间裂边缘膨隆;增强扫描呈轻中度强化及“血管造影”征;短期复查可能会出现SRA现象。出现以上表现,应警惕肺炎型IMA的可能,动态CT结合穿刺活检能够提供更多的诊断信息。
本研究存在一定的局限性。首先,本研究为回顾性研究,可能存在选择性偏倚;其次,样本量较小,需要大样本量进一步研究证实;除此之外,没有对所有患者进行随访,缺乏CT征象与预后相关性的研究。目前,影像人工智能对肺癌疗效的评估已取得一定进展[30],随着对肺炎型IMA认识的不断深入,以及人工智能的辅助,相信未来对该病的早期诊断及治疗将会更加准确、完善。
