常规超声和超声造影对高级别乳腺导管原位癌预测价值的研究
2024-01-04施佳楠杜联芳蔡应娱牛庆华
施佳楠,李 凡,杜联芳,贾 超,李 刚,蔡应娱,赵 磊,牛庆华
1.上海交通大学医学院附属第一人民医院超声科,上海 201600;
2.上海交通大学医学院附属国际和平妇幼保健院超声科,上海 200030
乳腺导管原位癌(ductal carcinoma in situ,DCIS)是一种非浸润性癌,肿瘤细胞沿乳腺导管生长增殖,但不破坏基底膜[1]。随着乳腺X线摄影技术的广泛应用,DCIS的发现率逐年提升,占乳腺癌的20%~30%[2-3]。虽然乳腺X线摄影是检出DCIS常用的影像学手段,但其对于不伴发钙化或致密型乳腺的患者的检查能力有限,且对肿块型病变显示效果不佳。常规超声检查具有操作便捷、无辐射、且不受乳腺致密质地影响。研究[4]证实,超声能显示出乳腺X线摄影探查不到的DCIS病变,被推荐作为DCIS检出的补充检查手段。
DCIS患者整体预后较好,高级别DCIS较中、低级别DCIS具有更高的术后局部复发率[5],因此,预测DCIS的病理学分级对制订治疗方案及预后评估具有重要意义。DCIS超声图像特征与病理学级别有一定相关性[4]。但常规超声基于解剖形态显像,而乳腺恶性肿瘤高度依赖新生血管生长,因此,评价新生血管对肿瘤检出、判定性质及预测风险尤为重要[6]。超声造影(contrast-enhanced ultrasound,CEUS)在多个脏器肿瘤性病变中的应用价值已得到认可[7-9],对于浸润性乳腺癌亦有相关研究[10-11],但对DCIS的研究极少[12-13]。本研究拟回顾并分析常规超声和CEUS上DCIS的声像图表现,以期探索对高级别DCIS有价值的预测因素。
1 资料和方法
1.1 患者纳入标准
回顾并分析2018年1月—2021年12月收治于上海交通大学医学院附属第一人民医院的乳腺癌患者的临床及影像学资料。纳入标准:① 经术后病理学检查证实为DCIS,不伴发微浸润;② 术后病理学检查有明确的核仁分级结果;③ 患者术前具备常规超声及CEUS的检查资料,超声检查距离手术时间不超过1个月;④ 超声检查前患者未行穿刺活检及新辅助化疗;⑤ 超声图像质量良好,CEUS图像上可显示出病灶灌注和消退的整个过程;⑥ 患者签署CEUS检查知情同意书,无检查禁忌证。不符合以上标准的则予以剔除。
1.2 检查仪器与方法
采用日本Canon公司的Aplio 500及Aplio i900彩色多普勒超声诊断仪,14-5L及14-8L探头频率分别为5~14及8~14 MHz。检查前患者取仰卧位,上肢高举,充分暴露双乳,平静呼吸。对双乳行全面超声扫查,发现病灶并存图。灰阶图像上显示病变长轴切面和短轴切面;利用彩色多普勒血流成像(color Doppler flow imaging,CDFI)测量病变内血流信号的阻力指数。随后,选择病变最大径线切面固定探头进行CEUS模式。CEUS机械指数为0.07,深度调节在5 cm以内,采用机器一键优化设置,使背景图像上仅显示乳腺组织为黑色,胸膜处可有线状亮带为造影前CEUS图像。造影剂使用意大利Bracco公司生产的声诺维(SonoVue),按照厂家推荐方式进行配制,肘静脉团注4.8 mL,同时启动机器自带计时器,并存贮CEUS图像,存贮时间为1 min,期间探头保持固定,嘱患者平静呼吸。超声操作由2名具备CEUS操作经验10年以上的医师完成。
1.3 超声图像分析
根据Watanabe等[14]研究将病变形态分为肿块样及非肿块样,其中非肿块样指的是低回声区、导管异常改变、结构扭曲、微囊样改变及强回声点不伴低回声区5种表现。按Park等[15]的研究,将非肿块样DCIS进行BI-RADS的亚分类分析;参考Jales等[16]的研究,进行BI-RADS 4a、4b及4c亚分类判定。
CEUS图像分析指标:病变增强时间,病变早于、等于或晚于周围正常乳腺组织增强;病变增强强度,与周围乳腺组织相比呈高或等、低增强;病变增强形态,包括规则或不规则;病变增强边界,分为清晰或不清晰(即>50%的病变区域无确切边界);造影剂增强顺序,包括向心性、离心性或非特异;增强均匀性,包括均匀和不均匀,不均匀指的是病变内存在不规则的低或无增强区;病变边缘有无放射状血管;病变内有无灌注缺损区,病变内是否存在明显片状无增强区;病变增强后范围与常规超声相比是否增大;病变在静脉期有无造影剂滞留现象,即病变在注射造影剂后40 s增强程度是否仍明显高于周围正常乳腺组织。由2名具备16年超声造影操作经验的超声科医师对超声图像进行分析评估。
1.4 病理学检查
纳入研究的病变均行手术切除后病理学检查。大体组织病理学上记录肿瘤最大径线。根据核特征,包括核的大小、极化、核仁的存在和大小以及核分裂象,记录低级别、中级别和高级别[17],中、低级别归为一类,高级别归为一类。如病理学上存在两种级别,以占比居多的进行归类。
1.5 统计学处理
2 结 果
2.1 患者临床信息
最终纳入94例DCIS患者的94个DCIS病变,纳入流程见图1。患者年龄33~83岁,平均年龄(54.7±12.1)岁。有症状者82例,包括触及肿块者70例,乳头溢血者2例,疼痛者1例,其中9例患者合并2项及以上主诉;余12例患者无明显症状。病理学上低级别23例,中级别41例,高级别30例;仅1例高级别DCIS患者出现淋巴结转移。患者年龄、病灶最大径、症状及淋巴结转移情况组间差异无统计学意义(表1)。
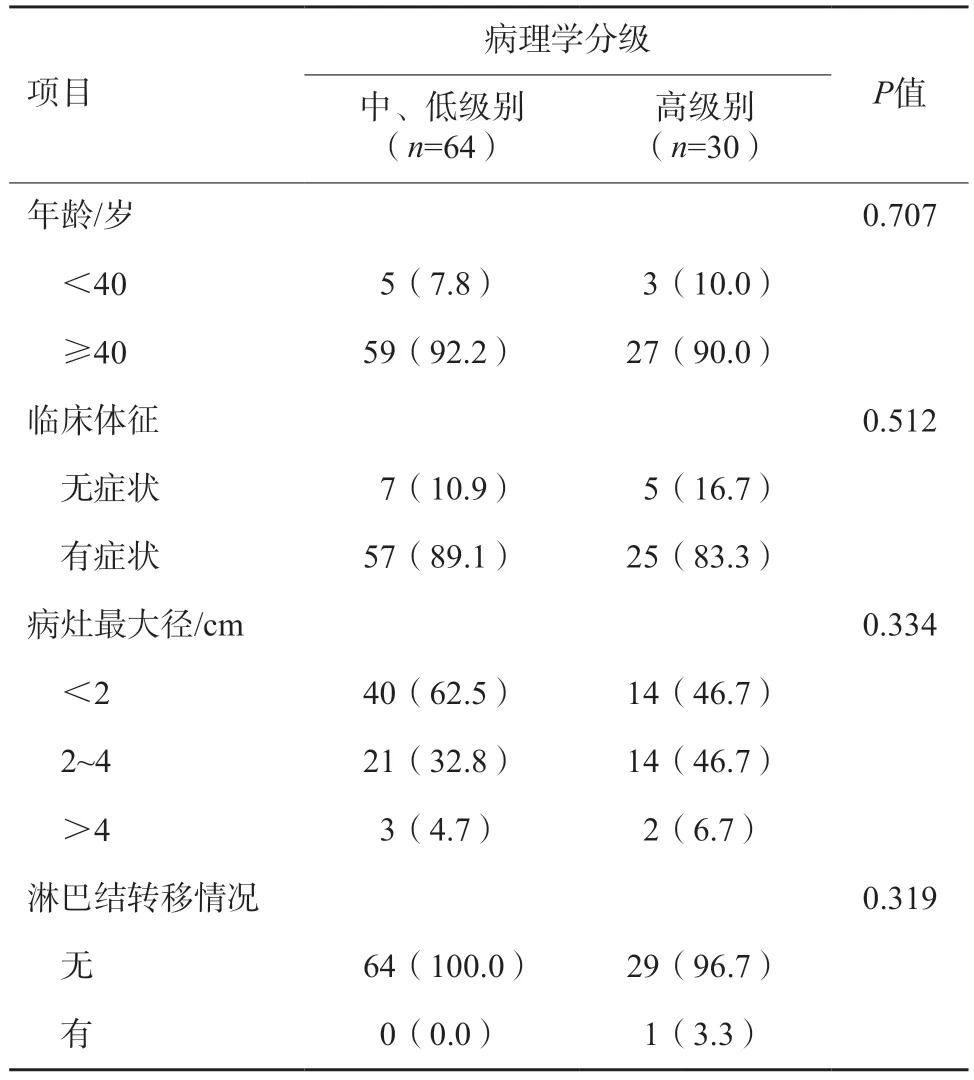
表1 纳入94例DCIS患者的临床信息n(%)
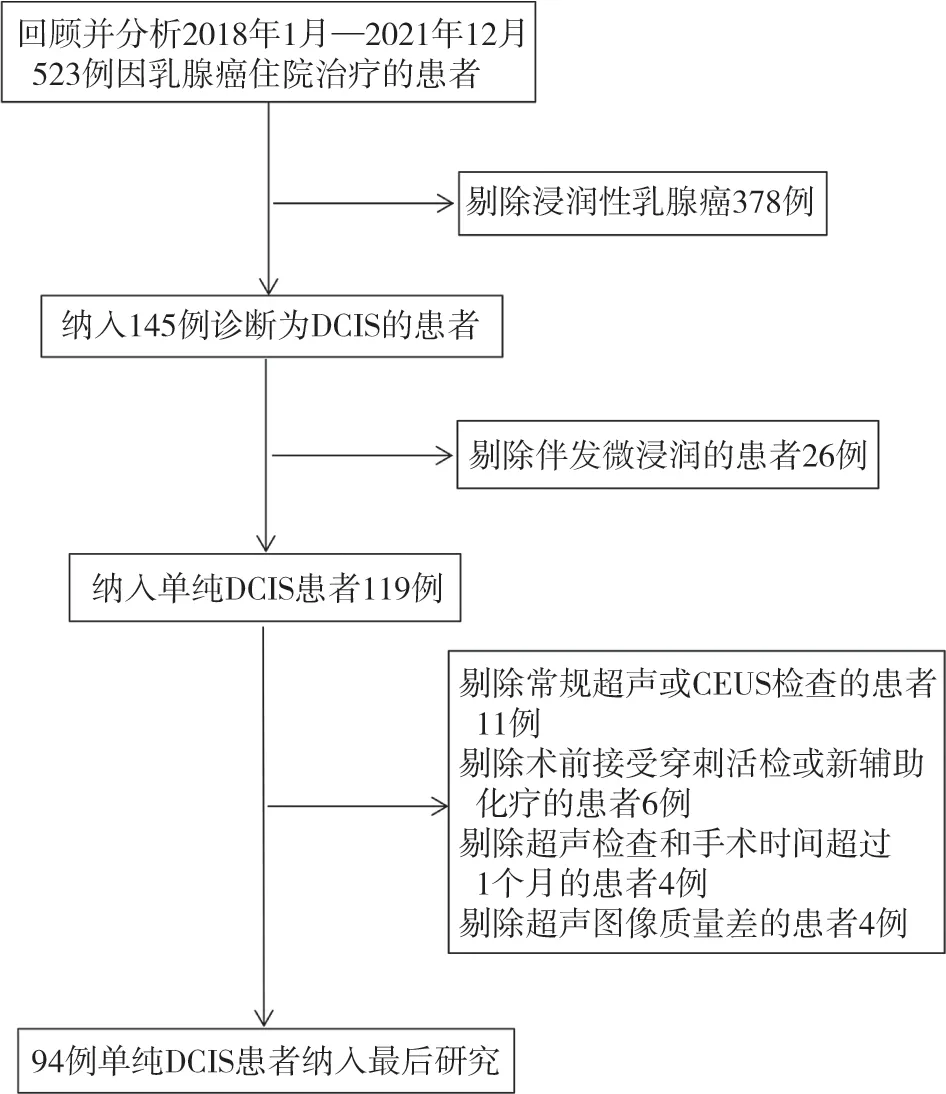
图1 患者纳入流程图
2.2 DCIS常规超声和CEUS的特征分析
94个DCIS病灶在常规超声上表现为肿块样35个(37.2%),非肿块样59个(62.8%,表2),微钙化在中、低级别及高级别组间差异有统计学意义(P=0.013)。在CEUS图像上,增强均匀性、病变周围放射状血管及增强后范围在中、低级别及高级别组间差异均有统计学意义(P<0.05,图2、3,表3)。
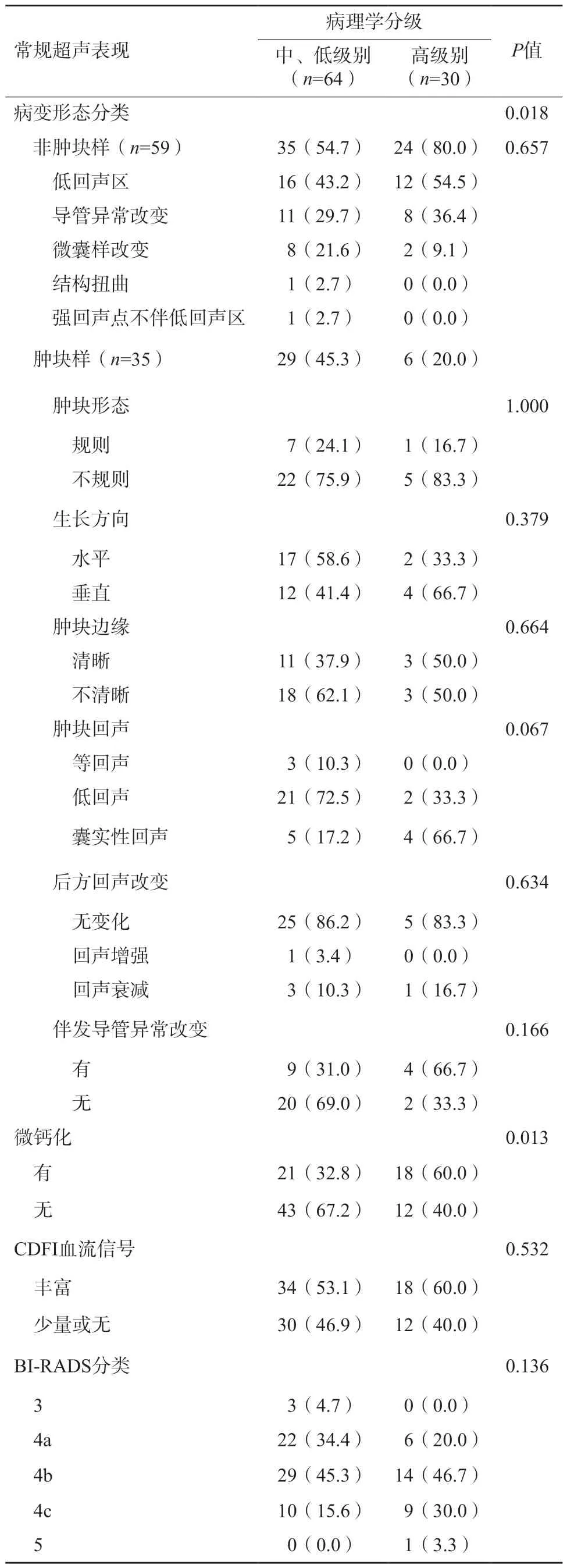
表2 高级别与非高级别DCIS的常规超声表现n(%)
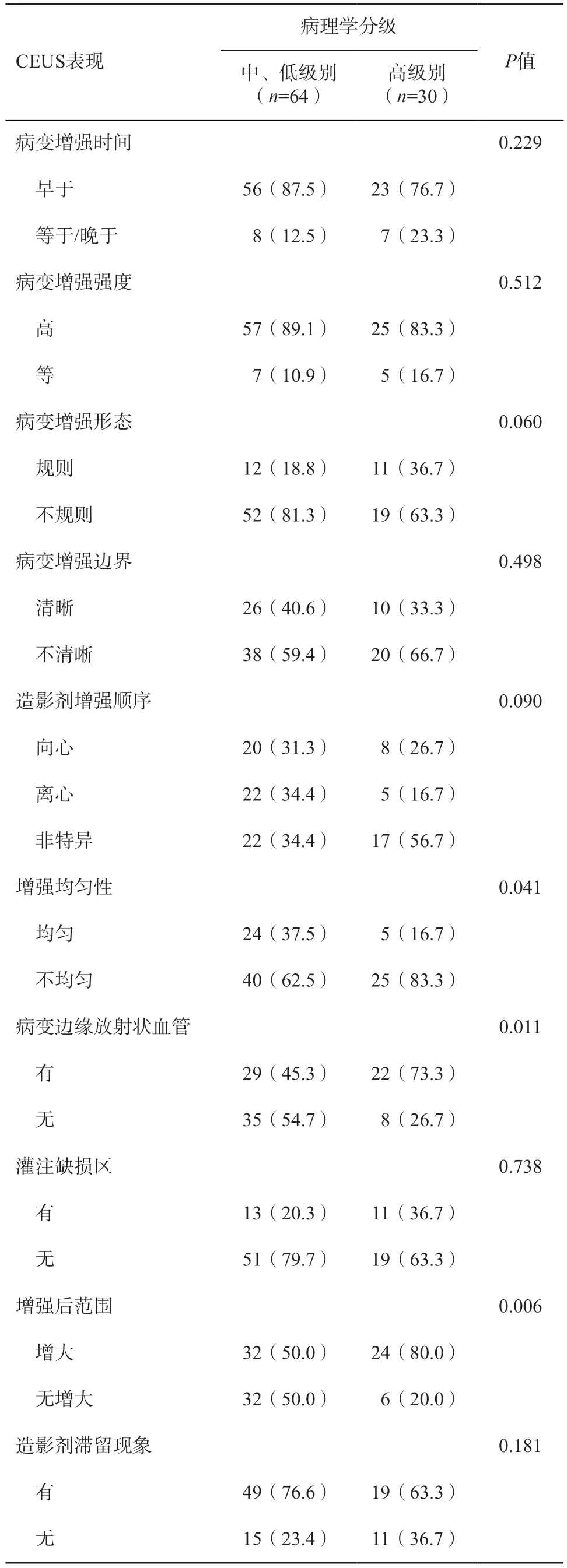
表3 高级别与非高级别DCIS的CEUS表现n(%)
2.3 常规超声和CEUS对高级别DCIS的独立预测因素及预测效能
单因素logistic回归分析后,在中、低级别及高级别DCIS组间差异有统计学意义的常规超声和CEUS的征象见表4。经多元logistic回归分析后,常规超声中的微钙化及CEUS中的病灶边缘放射样血管为独立预测因素。将常规超声和CEUS的独立预测因素指标联合,其诊断特异度较单独常规超声或CEUS显著提高(90.6%,P=0.000)。

表4 不同超声特征预测高级别DCIS的单因素及多因素logistic回归分析结果
3 讨 论
DCIS的病理学级别直接关系患者后续的治疗决策和复发风险,对DCIS病理学级别的影像学预测一直以来都是研究的热点。既往研究[4]表明,超声声像图上的表现与DCIS预后因素相关。CEUS技术能灵敏地显示病变微血管,但迄今未见利用CEUS预测DCIS病理学分级的相关研究报道。本研究结果表明,常规超声及CEUS表现均有助于预测高级别DCIS,其中,常规超声的微钙化及CEUS上的病变边缘放射状血管为独立预测因素,两者联合能提高预测特异度。
DCIS的病理学特点是肿瘤细胞沿乳腺导管生长增殖,可分布于终末端乳腺导管,或以节段性、叶状形式分布,因此其在灰阶超声图像上变异度较大。随着对此病变研究的深入,DCIS在常规超声上病变形态大体分为肿块样和非肿块样。截至目前,对非肿块样病变的常规诊断尚未有国际统一的读图标准。Watanabe等[14]进行的一项大样本量多中心研究指出,将低回声区、导管改变、结构扭曲、微囊样改变及强回声点不伴低回声区表现的病灶统称为非肿块样病灶,后续研究多有沿用。本研究按以上标准进行读图分析,结果发现,非肿块样病灶占比62.8%(59/94),与既往研究[18-19]结果近似。不仅如此,非肿块样病灶在高级别DCIS患者中较中、低级别更为多见(80.0% vs 54.7%)。除了非肿块样形态特征外,微钙化征象更多地出现于高级别DCIS(60.0% vs 32.8%)。经多元logistic回归分析后发现,仅有微钙化征象为常规超声图像上预测高级别DCIS的独立风险因素。微钙化形成在病理学上与肿瘤组织发生退行性变、肿瘤细胞坏死产生粉刺状物质或细胞活性增加致使分泌增加等相关,其存在提示肿瘤侵袭性加大。利用微钙化预测高级别DCIS的AUC为0.636。
研究[20]表明,DCIS是一种血供丰富的肿瘤。Yao等[21]发现伴发微浸润的DCIS较单纯DCIS更多表现出此特征。但对于单纯DCIS的血流信号表现鲜有研究。本研究纳入94例DCIS均为单纯DCIS即不伴发微浸润,结果发现,仅55.3%(52/94)的单纯DCIS表现为血流丰富的征象。基于CEUS对微血管显示的高度灵敏性,在CEUS上,87.2%(82/94)的DCIS表现出高增强即富血供,由此说明CDFI无法准确反映DCIS内血流灌注情况。不仅如此,本研究结果发现,高级别DCIS较中、低级别DCIS更多地表现为不均匀增强、边缘放射状血管及增强后范围增大。不均匀增强与恶性肿瘤的异质性相关,且由于DCIS多伴粉刺样坏死,由此在CEUS上表现为不均匀的增强模式。在CEUS上出现范围增大征象是乳腺恶性病变的特异性表现,其病理学基础与肿瘤边缘新生血管丰富、DCIS肿瘤细胞沿导管延展样生长、以及肿瘤边缘常伴发不典型增生有关,这些病理学特点不一定反映在灰阶超声上回声改变,但CEUS能更敏感地捕捉新生血管的异常分布特征[22-23]。乳腺癌是一种高度依赖新生血管生长的恶性肿瘤,且这些新生血管多发育不成熟,常表现为管壁薄、结构扭曲紊乱的架构特征,在CEUS上表现为由病变边缘向内部的放射状血管[11,24]。尽管DCIS肿瘤细胞不突破基底膜,但从CEUS的表现可以看出,随着级别的提高,肿瘤对周围组织新生血管的依赖性增强,出现特异性的放射状血管征象。经多元回归分析后发现,仅肿瘤边缘放射状血管征象为高级别DCIS的独立预测因素,预测效能AUC为0.640。将常规超声及CEUS模态联合,可进一步提升对高级别DCIS预测的诊断特异度。
综上所述,常规超声上非肿块样病变及微钙化征象,以及CEUS上不均匀增强、增强后范围增大及肿瘤边缘放射状血管征象与DCIS的病理学级别有一定的相关性,且微钙化和肿瘤边缘放射状血管征象为预测高级别DCIS的独立风险因素,两者联合有助于提高对高级别DCIS的预测特异度。
