瘤周超声影像组学对乳腺结节良恶性的鉴别诊断价值
2024-01-04钟李长谷丽萍
师 琳,钟李长,马 方,谷丽萍
上海交通大学医学院附属第六人民医院超声医学科,上海 200233
乳腺癌作为女性主要的恶性肿瘤之一[1],已向年轻化趋势发展[2],成为20~59岁女性癌症死亡的首要原因[3]。目前超声是乳腺癌早期筛查的主要方法之一[4-5],早期诊断与治疗对提高乳腺癌患者生存率与生活质量至关重要[6]。美国放射学会(American College of Radiology,ACR)超声乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)可帮助临床医师制订乳腺结节治疗方案,但对于部分乳腺结节来说,尤其是BI-RADS 4类,其恶性可能的范围较广,造成一定的鉴别诊断困难,导致了不必要的手术或穿刺活检[7]。乳腺肿瘤组织通常由肿瘤细胞及基质细胞组成,这些基质细胞能够引起瘤周基质的显著变化[8]。影像组学能够通过高通量的方法提取医学影像中肉眼无法识别到的细微特征,这些细微特征可能与肿瘤的异质性和肿瘤细胞的某些生物学行为密切相关[9]。因此,本研究旨在探讨瘤内瘤周超声影像组学特征对乳腺结节良恶性鉴别诊断的价值。
1 资料和方法
1.1 数据收集
回顾并收集2017年1月—2021年12月于上海交通大学医学院附属第六人民医院行超声检查并诊断为乳腺结节的共300例患者的临床及影像学资料。患者年龄14~86岁,平均年龄(46.01±15.41)岁。纳入标准:常规超声检查提示为BI-RADS 3~5类乳腺结节并且具有完整的检查资料;所有乳腺结节均经术后病理学检查或穿刺活检证实。排除标准:超声图像质量不符合标准。
1.2 超声检查及感兴趣区(region of interest,ROI)勾画
采用德国Siemens公司的S2000超声诊断仪,探头检测频率4~9 MHz。所有患者在术前1周内进行乳腺常规超声检查,取仰卧位,扫查到可疑结节后多个切面观察结节情况,在结节二维超声图像质量较好的基础上,存储结节最大切面,图像以DICOM格式储存于硬盘中。
挑选出符合纳入标准的乳腺结节超声图像,按照计算机产生的随机数进行简单随机化分组,随机选择70%(210例)的患者组成训练组,剩余30%(90例)的患者为验证组。由1名具有5年以上乳腺超声诊断经验的医师在未知病理学检查结果的前提下应用软件ITK-SNAP 3.8版在二维超声图像上沿乳腺结节的大致轮廓手动勾画ROI(图1);瘤周ROI是指根据瘤内ROI勾画的边界自动适形向外扩展2 mm得到的区域(图1)。
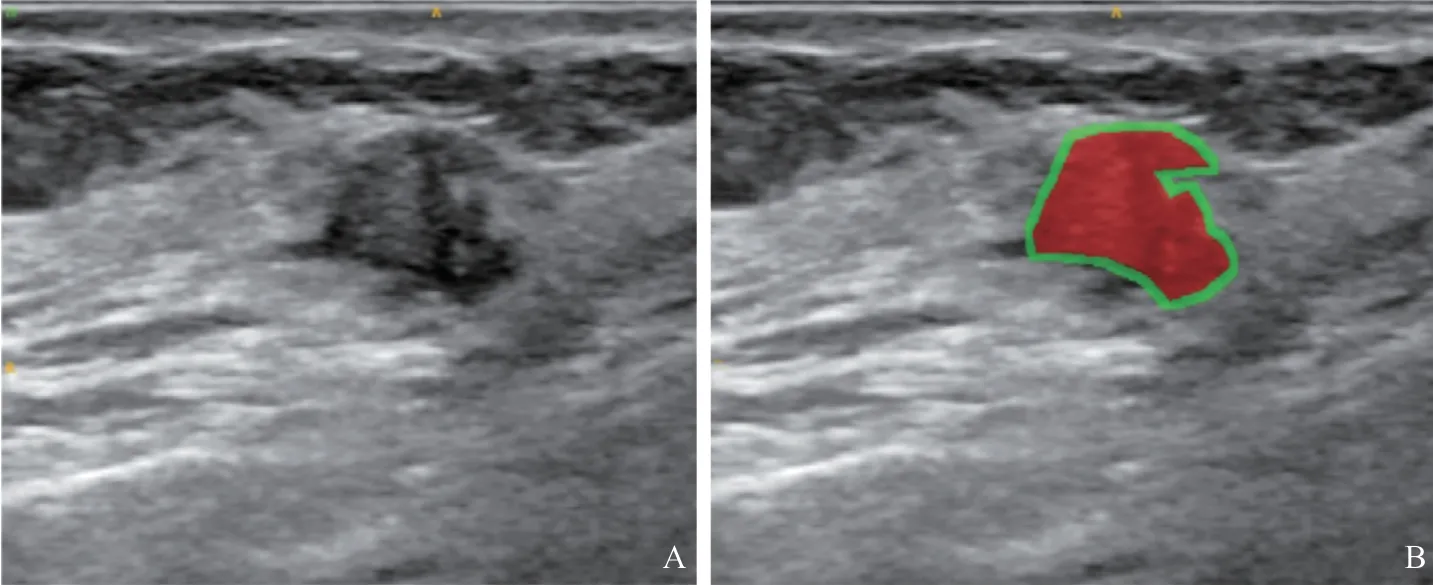
图1 乳腺结节瘤内(红色)及瘤周2 mm(绿色)ROI勾画示意图
1.3 影像组学的特征提取、筛选及模型构建
对勾画完成的ROI区域应用Pyradiomics软件进行影像组学特征提取,主要包含形态特征、一阶直方图特征、纹理特征及小波特征共4种特征。纹理特征主要包括灰度游程矩阵(gray level run length matrix,GLRLM)、灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度依赖矩阵(gray level dependence matrix,GLDM)、灰度级带矩阵(gray level size zone matrix,GLSZM)和邻域灰度差分矩阵(neighborhood gray-tone difference matrix,NGTDM)。
采用Z-score方法对提取出来的超声影像组学特征进行归一化处理,再进行t检验、Pearson相关性分析以及最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)筛选特征,将筛选出系数非零的超声影像组学特征使用10折交叉验证超参数,筛选出最优特征后构建影像组学支持向量机(support vector machine,SVM)模型,根据影像组学评分运算公式Rad-Score=X0+X1Y1+X2Y2+X3Y3+…+XnYn计算每个乳腺结节的Rad-Score评分,其中,Yn表示经筛选后的超声影像组学特征,X0为Rad-Score的常量,Xn为相应特征在回归模型中的回归系数。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估超声影像组学模型的诊断效能,并在验证组中验证模型,最后绘制验证组的影像组学模型ROC曲线。
1.4 统计学处理
采用R软件及SPSS 26.0对数据进行统计学分析,并以病理学检查结果为金标准,对计量资料进行正态分布及方差齐性检验,符合正态分布进行两样本独立t检验,采用Mann-Whitney U检验比较非正态分布的连续性变量;采用χ2检验比较分类变量;利用logistic回归构建预测模型并绘制ROC曲线,得出模型的准确度、灵敏度、特异度、精确度、F1值、曲线下面积(area under curve,AUC)。P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料特征
在纳入研究的300例乳腺结节患者中,最终术后病理学检查诊断为良性199例,其中纤维腺瘤125例,乳腺腺病55例,导管内乳头状瘤16例,良性叶状肿瘤2例,肉芽肿性小叶性乳腺炎1例;诊断为恶性101例,其中小叶原位癌16例,导管内原位癌53例,乳头状癌11例,浸润性小叶癌21例。经随机化选择7∶3分为训练集(210例)及验证组(90例)。经过单因素及多因素分析患者的肿块直径、BI-RADS评分与乳腺结节的良恶性差异均有统计学意义(P<0.001,表1),被视为乳腺恶性肿瘤的独立风险因子。临床变量模型在训练组的AUC为0.746(95% CI 0.678~0.814),验证组的AUC为0.823(95% CI 0.720~0.926)(图2),其在训练组的准确度、灵敏度、特异度、F1值、精确度分别为0.698、0.733、0.679、0.629、0.550,验证组的准确度、灵敏度、特异度、F1值、精确度分别为0.800、0.846、0.780、0.721、0.629。

表1 训练集和验证组临床特征资料n(%)

图2 各诊断模型的ROC曲线及校准曲线
2.2 影像组学特征提取、筛选与建模
采用Pyradiomics软件对每个乳腺结节超声图像已勾画的ROI进行瘤内超声影像组学特征提取,共提取1 560个瘤内影像组学特征,然后通过t检验、LASSO、Pearson相关检验进行特征筛选,最后筛选出18个系数非零的影像组学特征,将筛选出18个瘤内最优特征用于构建瘤内超声影像组学SVM模型,瘤内超声影像组学模型在训练组的AUC为0.927(95% CI 0.889~0.965),验证组的AUC为0.808(95% CI 0.710~0.905)(图2),其在训练组的准确度、灵敏度、特异度、F1值、精确度分别为0.887、0.933、0.843、0.838、0.761,验证组的准确度、灵敏度、特异度、F1值、精确度分别为0.753、0.731、0.763、0.644、0.576。
采用同样的方法提取乳腺结节瘤周2 mm超声影像组学特征,共提取1 560个瘤周影像组学特征,经过t检验、LASSO、Pearson相关性检验进行特征筛选,最后筛选出19个系数非零的影像组学特征,将筛选出19个瘤周最优特征用于构建瘤周超声影像组学SVM模型。瘤周超声影像组学模型在训练组的AUC为0.930(95% CI 0.891~0.969),验证组的AUC为0.857(95% CI 0.763~0.949)(图2),其在训练组的准确度、灵敏度、特异度、F1值、精确度分别为0.865、0.893、0.850、0.822、0.761,验证组的准确度、灵敏度、特异度、F1值、精确度分别为0.812、0.846、0.797、0.733、0.647。
在瘤内联合瘤周的超声影像组学特征模型中,共纳入18个系数非零的影像组学特征,其中包括1个瘤内特征和17个瘤周特征,瘤内联合瘤周超声影像组学特征在训练组SVM模型的AUC为0.941(95% CI 0.843~0.967),验证组的AUC为0.865(95% CI 0.781~0.949)(图2),该模型训练组的准确度、灵敏度、特异度、F1值、精确度分别为0.884、0.92、0.864、0.847、0.784,验证组的准确度、灵敏度、特异度、F1值、精确度分别为0.824、0.692、0.881、0.706、0.720。
瘤内瘤周联合临床变量组模型中,训练组SVM模型的AUC为0.952(95% CI 0.924~0.979),验证组的AUC为0.873(95%CI 0.788~0.956)(图2),该模型训练组的准确度、灵敏度、特异度、F1值、精确度分别为0.879、0.933、0.850、0.843、0.769,验证组的准确度、灵敏度、特异度、F1值、精确度分别为0.859、0.692、0.932、0.75、0.818,校准曲线显示三者联合模型的预测曲线与理想曲线有良好的一致性(图2)。
3 讨 论
目前,乳腺癌的主要筛查手段有超声、乳腺X线摄影、磁共振成像(magnetic resonance imaging,MRI)、计算机体层成像(computed tomography,CT)等,但各项筛查方法都存在一定的缺陷,如乳腺X线摄影无法有效地检出致密型乳腺的结节[6],而国内女性一半以上都属于致密型乳腺;CT检查存在辐射,MRI检查费用昂贵且有一定禁忌证[10]。超声已成为乳腺检查的主要方式,但是对检查医师的诊断能力依赖性较高,且良恶性乳腺肿瘤超声表现往往存在一定的重叠性[11-12]。影像组学是一门基于传统成像检查和人工智能的新兴学科,影像组学特征提供了一种稳定的、非侵入性的方法,通过深度揭示纹理特征来反映病变的异质性,提供对肿瘤诊断及治疗有价值的信息[13]。
Hong等[14]的研究中,其提取的影像组学特征模型诊断BI-RADS 4~5类乳腺结节的AUC在验证组、训练集中分别为0.886、0.868;在Romeo等[15]的研究中其将影像组学与机器学习相结合,AUC为0.82。本研究从瘤内超声影像组学特征中筛选出18个瘤内最优特征构建瘤内超声影像组学SVM模型,瘤内超声影像组学模型在训练组的AUC为0.927(95% CI 0.889~0.965)(图2A~D),验证组的AUC为0.808(95% CI 0.71~0.905),与既往研究[14-15]一致。在米拉·也尔兰等[16]的研究中,从BI-RADS 4a类不规则乳腺结节中提取包括1个直方图特征、2个纹理特征和16个小波特征共19个系数非零的影像组学特征,用于诊断BI-RADS 4a类不规则乳腺结节的良恶性,训练组影像组学模型AUC为0.927(95% CI 0.900~0.950),验证组影像组学模型AUC为0.946(95% CI 0.908~0.976)。Luo等[17]将瘤内超声影像组学联合BI-RADS分类用于预测乳腺良恶性病变,结果显示,结合影像组学评分和BI-RADS分类的模型表现出更好的乳腺恶性和良性病变鉴别能力(AUC=0.928),优于单独应用影像组学评分模型(AUC=0.857)和BI-RADS分类模型(AUC=0.864)。Hong等[14]的研究将提取的瘤内超声影像组学特征联合患者年龄、BI-RADS分类和病灶最大径建立的诊断模型,其研究结果显示出良好的鉴别乳腺良恶性病变能力(AUC=0.937)。
然而,既往的乳腺肿瘤超声影像组学研究多集中在瘤内,对瘤周影像组学特征关注较少,而乳腺癌瘤周区域可能存在一些重要的生物学信息,如间质反应、血管生成以及淋巴管和血管的瘤周浸润[18-19]。我们尝试提取乳腺结节的瘤周影像组学特征,并最终筛选出19个系数非零的影像组学特征用于建立瘤周影像组学模型,与瘤内组学模型相比较,验证组的AUC也从0.808提高到0.857,差异有统计学意义(P<0.05)。本研究的瘤内联合瘤周超声影像组学特征模型在训练组和验证组SVM模型的AUC显著高于瘤内组学模型(P<0.05),也高于瘤周影像组学模型,但差异无统计学意义。Klimonda等[20]发现,瘤内联合瘤周的定量超声特征鉴别乳腺良恶性病变的AUC为0.94,而单独使用瘤内的定量超声特征的AUC为0.83。本研究通过瘤内联合瘤周特征建立的诊断模型优于单独以瘤内特征建立的影像组学模型,可能的原因是瘤内影像组学模型难以鉴别的良性与恶性乳腺结节能够通过瘤周影像组学模型明确鉴别。
本研究发现,许多临床因素与乳腺病变的良恶性相关,包括肿块直径、BI-RADS分类。因此,我们开发了一个包含瘤内瘤周影像组学特征和临床特征的预测模型,对乳腺结节的良恶性鉴别诊断表现出良好的诊断能力,AUC达0.873,在保持灵敏度的同时,精确度从0.720提高到了0.818,有效减少了假阴性、假阳性的出现。Luo等[17]将瘤内超声影像组学联合BI-RADS分类用于预测乳腺良恶性病变,结果显示,结合影像组学评分和BI-RADS分类的模型表现出更好的乳腺良恶性病变鉴别能力(AUC=0.928),优于影像组学评分模型(AUC=0.857)和BI-RADS分类模型(AUC=0.864)。在Hong等[14]的研究中,将提取的瘤内超声影像组学特征联合患者年龄、BI-RADS分类和最大病灶直径建立的诊断模型,其研究结果显示良好的鉴别乳腺良恶性病变能力(AUC=0.937)。Luo等[17]、Hong等[14]以及本研究的联合模型的诊断效能均显示出联合诊断模型的优势。
此外,有研究发现基于X线及增强X线、MRI及增强MRI的瘤内瘤周的影像组学特征与淋巴结转移[21-23]、雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)表达水平[24]、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达水平和Ki-67增殖指数[25]、新辅助化疗效果[26]、乳腺癌分子亚型[27]相关。
本研究存在一些局限性:首先,本研究为单中心研究,且样本量较小,可能导致模型稳定性降低;第二,所有ROI区域的勾画均在二维超声图像的基础上进行,忽略了肿瘤的三维特征;第三,瘤周ROI仅选择了瘤周2 mm区域,未提取瘤内ROI 2 mm之外的瘤周特征,可能导致部分瘤周影像组学特征的遗失。
综上所述,基于瘤内和瘤周影像组学特征联合临床、影像学特征建立联合诊断模型能够较为准确地鉴别乳腺结节的良恶性,为临床医师的决策提供指导,进而降低漏诊率,避免不必要的活检。
