铁死亡及其在膀胱癌中的研究进展△
2024-01-04黄龙港徐保才张惠白杨
黄龙港,徐保才,张惠,白杨#
1济宁医学院临床医学院,山东济宁 272000
2济宁市第一人民医院泌尿外科,山东济宁 27200003济宁医学院免疫学与分子医学研究所,山东济宁 272067
哺乳动物发生细胞死亡最常见的形式是细胞凋亡和坏死[1],细胞的死亡维持着生物体的健康和稳态[2]。2012 年Dixon 等[3]发现了一种特殊的细胞死亡方式并命名为铁死亡,铁死亡有赖于细胞内的铁离子,而不是其他金属离子,其在形态学、生化和遗传学上区分于传统细胞凋亡、坏死和自噬。研究表明,肿瘤细胞发生铁死亡与肿瘤的发生发展相关。肿瘤抑制基因p53、核因子E2 相关因子2(nuclear factor erythroid 2-related factor 2,NRF2)通路、T细胞衍生的干扰素γ都已被证实与铁死亡相关[4-6]。探究铁死亡与膀胱癌的相关性,可能对寻找膀胱癌新型治疗靶点并提高膀胱癌综合治疗效果有重大意义。本文就铁死亡的相关机制及其在膀胱癌中的研究进展展开综述,希望对膀胱癌的综合治疗有所帮助。
1 铁死亡的发现
小GTP 酶的RAS 家族[Harvey 鼠肉瘤病毒癌基因同源物(Harvey rat sarcoma viral oncogene homolog,HRAS)、神经母细胞瘤RAS 病毒癌基因同源物(neuroblastoma RAS viral oncogene homolog,NRAS)和Kirsten 鼠肉瘤病毒癌基因同源物(Kirsten rat sarcoma viral oncogene homolog,KRAS)]在30%的肿瘤中会发生突变[7],为了解决这个问题,2003 年Dolma 等[8]通过研究发现了两种对致癌RAS突变的细胞系具有选择性致死作用的诱导剂,并命名为Erastin 与RSL3,通过化学蛋白组学方法确定了RSL3 的直接药物靶点是谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)[9],为后续寻找靶向铁死亡的药物奠定了基础。2007年,Yagoda等[10]通过研究发现,使用Erastin 处理过的肿瘤细胞的线粒体出现形态改变,如体积减小、脊减少、膜密度增加等,区别于细胞凋亡与细胞坏死的形态学特征。对比之下,抗氧化剂和铁螯合剂可阻断RSL诱导的细胞死亡[9]。铁死亡发生过程中细胞内活性氧(reactive oxygen species,ROS)出现过量堆积,并与细胞膜上的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)发生过氧化毒性反应,导致细胞膜结构受到破坏[11]。
2 铁死亡相关机制
2.1 铁代谢
细胞内铁离子代谢与各种导致脂质过氧化结局的生化过程是铁死亡发生中的重点调控过程[12]。过量的铁离子通过芬顿反应产生大量ROS 导致铁死亡。循环中的铁以三价铁(Fe3+)与转铁蛋白结合的形式存在,随后经细胞膜上的转铁蛋白受体1(transferrin receptor 1,TFR1)识别后进入细胞,并定位于内体中。随后,Fe3+通过与金属还原酶发生氧化还原反应,接受一个电子被还原为亚铁(Fe2+)状态,而后由二价金属转运体1(divalent metal transporter 1,DMT1)转导Fe2+从内体释放到细胞质中的不稳定铁池,还原型铁离子参与ROS 形成。过量的Fe3+储存在一种铁储存蛋白复合物中,这种复合物由铁蛋白轻链(ferritin light chain,FTL)和铁蛋白重链1(ferritin heavy chain 1,FTH1)构成。部分铁由膜上的一种铁外排泵蛋白1(ferroportin 1,FPN1)转导输出,FPN1 可将Fe2+氧化成Fe3+形式。与抵抗铁死亡细胞相比较,具有RAS突变的易发生铁死亡的细胞增加了TFR1 的表达并降低了铁蛋白(FTL 和FTH1)的表达[9]。这表明细胞发生铁死亡期间,铁摄取的增加以及铁储存的减少可能导致铁过载。外源性的铁源(例如柠檬酸铁铵、柠檬酸铁、六水合氯化铁)可增强Erastin 诱导的铁死亡[3,9-12]。因此,参与铁吸收及利用的代谢过程是诱导铁死亡必不可少的。
2.2 氨基酸与脂质代谢
铁死亡发生脂质过氧化反应有多种机制,胱氨酸-谷氨酸反向转运体(System xc-)与GPX4是目前研究铁死亡通路中常涉及的两种蛋白质。System xc-系统在结构上由溶质载体家族7 成员11(solute carrier family 7 member 11,SLC7A11)和溶质载体家族3 成员2(solute carrier family 3 member 2,SLC3A2)组成,作用是将细胞外的胱氨酸转运入细胞内,并通过生化反应合成半胱氨酸,作为原料合成谷胱甘肽(glutathione,GSH)[13]。GPX4 是细胞抗氧化屏障的关键酶,其在细胞内有3 处定位,分别为线粒体、细胞质、细胞核[14],对铁死亡发生都有重要作用。硒是含硒半胱氨酸蛋白质(包括但不限于GPX4)的重要组成部分,其作用是在细胞发生铁死亡期间增加细胞的抗氧化能力[15]。GSH 具有辅助GPX4 稳定细胞膜抗氧化系统的作用,GPX4 以GSH 为还原剂,将过氧化物转变为类脂醇,使其失去氧化活性进而抑制铁死亡。脂质过氧化可能是诱导各种调节性细胞凋亡(regulated cell death,RCD)的共同信号[16]。抑制System xc-会导致GSH合成减少,进而导致细胞氧化还原失衡,造成细胞内ROS 过载发生铁死亡。为了验证这一观点,2012 年,Dixon 等[3]发现用柳氮磺吡啶抑制System xc-可诱发铁死亡,并发现了RSL3 诱导的铁死亡与System xc-关系不大。2014 年,Dixon 等[17]发现p53是某些肿瘤中铁死亡的正性调控因子,通过抑制SLC7A11 表达,可抑制System xc-活性,进而促进肿瘤细胞发生铁死亡,以上为铁死亡发生过程中的重点调控过程。
2.3 潜在途径
还有许多潜在的铁死亡发生途径,如相关研究表明,电离辐射(ionizing radiation,IR)具有促进肿瘤细胞ROS 生成,诱导长链脂酰辅酶A 合成酶4(acyl-CoA synthetase long chain family member 4,ACSL4)、GPX4、SLC7A11 表达的作用[18],充分理解IR 引起肿瘤细胞发生铁死亡的机制可能对肿瘤的治疗是一种新的策略。肿瘤抑制基因乳腺癌易感基因1 相关蛋白1(breast cancer susceptibility gene l associated protein 1,BAP1)通过降低组蛋白2A 泛素化(histone 2A ubquitination,H2Aub)在SLC7A11启动子上的占用,抑制SLC7A11 的表达,减少胱氨酸摄取,导致脂质过氧化和铁死亡发生[19]。OTU脱泛素酶,泛素醛结合蛋白1(OTU deubiquitinase,ubiquitin aldehyde binding 1,OTUB1)是一种去泛素化酶,通过稳定SLC7A11 进而诱导细胞铁死亡发生,表明OTUB1 是肿瘤治疗的潜在靶点[20]。NRF2 是细胞抗氧化保护屏障的关键因子,细胞的抗氧化剂、铁和中间代谢状态都可以由NRF2 靶基因介导,已经证实System xc-与GPX4 是NRF2 发挥作用的两个重要靶点[21]。铁死亡存在许多复杂机制,对其机制的深入了解对未来将铁死亡应用于疾病诊治有重要意义(图1)。
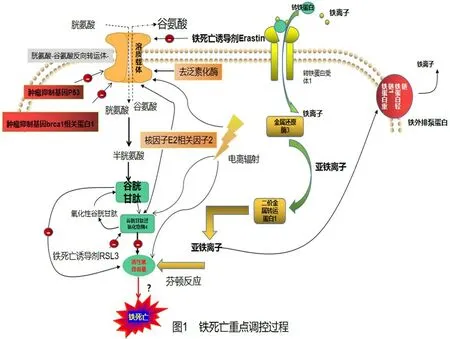
图1 铁死亡重点调控过程
3 铁死亡与膀胱癌
3.1 铁死亡与膀胱癌的关系
膀胱癌是全世界第九大常见肿瘤,每年确诊例数约为430 000 例,病死率在各类肿瘤中居第13 位[22]。膀胱癌在男性中的发病率较女性高,为全球男性第七大常见肿瘤[23]。膀胱癌的传统治疗方式依赖于手术治疗及化疗,不耐受化疗的患者生存时间较短,对于肌层浸润性膀胱癌患者,使用以铂类为基础的辅助化疗结合根治性手术为目前常用的治疗手段,而晚期膀胱癌患者通常以铂类联合化疗为主,大部分晚期膀胱癌患者不耐受化疗[24]。发现膀胱癌的新型治疗方法很有必要。肿瘤细胞具有无限增殖的特性,靶向诱导肿瘤细胞发生铁死亡具有理论基础,可为肿瘤综合治疗提供新思路。铁死亡在抗肿瘤方面具有重大潜力,这对于寻找精准诱导膀胱癌细胞发生铁死亡的方法给予了有力支持[25-26]。
3.2 基础与临床研究
铁代谢、脂质过氧化是铁死亡发生发展中的重要过程,目前已有大量研究表明铁死亡与膀胱癌之间存在密切联系。文献报道,丝氨酸代谢的重要分子磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase,PHGDH)在细胞发生铁死亡过程中具有重要的调控作用。该研究通过对90 例膀胱癌患者的膀胱癌组织进行一系列基础研究,探究PHGDH的生物学功能,发现其在膀胱癌患者中高表达,敲除PHGDH或者使用PHGDH 靶向抑制剂NCT-502均可促进铁死亡,降低膀胱癌细胞的增殖能力。结果表明,NCT-502 可用于治疗膀胱癌[27]。circ-ST6GALNAC6 在膀胱癌中是一种抑癌因子,有研究表明,过表达circST6GALNAC6 可促进膀胱癌细胞发生铁死亡[28]。有临床研究显示,当镓离子与转铁蛋白结合时,膀胱癌细胞中的游离铁水平升高,抑制肿瘤细胞增殖[29],其通过检测对比了51 例膀胱癌患者和58 例对照组患者的血清铁水平发现,膀胱癌患者的血清铁水平低于对照组,膀胱癌患者血清铁和游离铁的水平可能与其发病有关,但还需要前瞻性研究进一步验证[30]。
3.3 相关靶点
富含丝氨酸和精氨酸的剪接因子9(serine and arginine rich splicing factor 9,SFRS9)被认为是膀胱癌的原癌基因,有研究发现,SFRS9 过表达可明显提高结直肠癌细胞的活力,促进细胞周期进程和集落形成,SFRS9 过表达抑制了由Erastin 和索拉非尼诱导的细胞死亡和脂质过氧化,通过生物信息学分析表明,SFRS9 可以与GPX4的mRNA 结合,而GPX4 是铁死亡的中心调节因子,进一步实验验证敲低SFRS9会抑制GPX4 的表达,抑制体外裸鼠肿瘤生长,表明敲低SFRS9可能是未来治疗结直肠癌的一种方法[31]。而SFRS9是膀胱癌的原癌基因,敲低SFRS9也许是未来膀胱癌治疗的一种手段。
在膀胱癌中长链非编码RNA(long non-coding RNA,lncRNA)起着重要的调控肿瘤发生发展的作用,但其具体机制尚未明确。有研究发现一种新型lncRNA 标记——RP11-89,通过实验进一步发现RP11-89 是一种新型的致瘤性调控因子,通过miRNA-129-5p/PROM2 轴促进细胞增殖、迁移,并抑制细胞周期。RP11-89 通过上调PROM2(最初是从人类、小鼠和大鼠肾中通过分子克隆获得)的表达抑制铁死亡的发生[32]。RP11-89 可能成为膀胱癌靶向治疗的潜在靶点。
3.4 药物研究
3.4.1 传统抗肿瘤药物 有研究人员对分子靶向药物索拉非尼进行结构修饰,并合成一系列喹唑啉基芳基脲类衍生物,验证了其中一种喹唑啉基芳基脲类衍生物——7j 的抑制肿瘤增殖的特点。化合物7j 引起肿瘤细胞死亡的形式由其浓度和孵育时间决定,肿瘤细胞在较高浓度并延长孵育时间的情况下发生铁死亡和自噬,这与其能诱导细胞内ROS 的产生及线粒体膜电位的下降有关。7j可以很好地结合相应受体GPX4 的活性位点[33]。化合物7j 有望成为抗膀胱癌分子靶向药物。Fin56是一种3 型铁死亡诱导剂,其可能通过一种未了解的机制促进GPX4 的降解来诱导铁死亡发生。有研究通过Fin56 联合一种雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)抑制剂Torin2,用于激活细胞自噬对膀胱癌细胞的影响,发现二者对膀胱癌细胞有协同细胞毒作用,提示铁死亡诱导物和MTOR 抑制剂的联合应用是一种有希望的治疗方法,对膀胱癌的治疗选择有帮助[34]。
3.4.2 新型药物 近年来由于铁死亡研究的兴起,关于铁死亡通路的纳米材料技术也有所进展。有研究发现,氧化铁纳米颗粒是一种多功能材料,并提出了一种三层输送策略,通过黏附水凝胶平台输送。注入时,水凝胶平台首先黏附在肿瘤表面界面上,持续释放透明质酸涂层的离子。随后,光热治疗降低肿瘤硬度和间质流体压力,促进这种离子向膀胱肿瘤深部组织扩散。由于膀胱肿瘤组织表达高水平的CD44,最后的传递层通过抗体介导的内吞作用来增加不稳定铁池内的铁含量,最终诱导铁死亡[35]。这种三层策略从解剖到细胞水平输入氧化铁纳米颗粒,并增加铁含量高达50 倍的系统给药,是一种潜在的治疗化疗耐药膀胱癌的方案。纳米材料的应用可以提高肿瘤的靶向精准性,有助于克服多药耐药的困难。如今已制造出不同的纳米铁诱导剂并与基因治疗、免疫治疗及其他疗法联合应用,表现出显著增强的抗肿瘤效果和较高的安全性,但仍需要更丰富的临床试验和疗效评价来揭示靶向治疗的安全性和实际疗效。
4 小结与展望
铁死亡是近年来新出现的一种细胞死亡形式,与铁代谢、脂质代谢密切相关,目前的研究表明其在肿瘤治疗方面具有重大意义。研究铁死亡诱导剂与其他免疫治疗药物、抗肿瘤药物联合应用,可能会成为未来肿瘤综合治疗的新战略。在未来,有希望使用药物靶向诱导膀胱癌细胞发生铁死亡,对晚期化疗不耐受的膀胱癌患者的治疗和延缓膀胱癌进展可能有所帮助。对于铁死亡通路的研究及其在肿瘤治疗方面的应用,仍然有许多未解决的难题,在肿瘤治疗方面的应用仍然道阻且长。
