不同凋落叶和磷添加对亚热带马尾松土壤有机碳氮组分的影响
2024-01-03吴晓霞元晓春梅孔灿刘苑苑陈文伟陈岳民
吴晓霞 元晓春 梅孔灿 刘苑苑 陈文伟 陈岳民
摘要[目的]探究凋落葉、P添加及其交互作用对有机碳(SOC)和有机氮(SON)组分的影响。[方法]以马尾松土壤为研究对象,通过为期125 d的室内培养试验,探究了3种凋落叶添加(马尾松、火力楠和枫香)和P添加(KH2PO4)对土壤SOC和SON组分的影响。[结果]凋落叶添加和P添加均显著降低了惰性碳(RP-C)组分的含量,两者共同添加时表现出较强的交互作用。凋落叶对SOC和SON的影响受土壤P有效性的影响,P添加加速了凋落叶添加下土壤微生物对原有RP-C的分解。冗余分析显示,氨态氮(NH+4-N)和有效磷(AP)是SOC组分重要的影响因子,而SON组分重要的预测因子是可溶性有机氮(DON)和微生物生物量磷(MBP)。[结论]P添加会促进凋落叶在土壤的分解和转化,且凋落叶的输入增加了对RP-C的分解,这将进一步加速SOC的周转。
关键词凋落叶;P添加;两步酸水解;土壤有机碳、氮组分;酶活性
中图分类号S 714文献标识码A文章编号0517-6611(2023)24-0104-07
doi:10.3969/j.issn.0517-6611.2023.24.023
Effects of Different Litter Leaves and Phosphorus Addition on Soil Organic Carbon and Nitrogen Components of Pinus massoniana Soil in Subtropics
WU Xiaoxia1,2, YUAN Xiaochun1,2,3, MEI Kongcan1,2 et al
(1. College of Geographical Science, Fujian Normal University, Fuzhou, Fujian 350007;2. Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology, Fuzhou, Fujian 35000;3.College of Tourism, Wuyi University, Wuyishan, Fujian 354300)
Abstract[Objective] To investigate the effects of leaf litter, P addition, and their interactions on changes in SOC and SON components.[Method]The effects of three kinds of withered leaf additions (Michelia macclurei, Pinus masson and Liquidam fortiana) and P addition (KH2PO4) on SOC and SON components were investigated through a 125day indoor culture experiment with the soil of Pinus massoniana as the research object. [Result]The results showed that both leaf litter addition and P addition significantly reduced the content of recalcitrant C (RPC) component, and they showed a strong interaction. The effects of leaf litter on SOC and SON were influenced by soil P availability, and P addition accelerated the decomposition of original recalcitrant C by soil microorganisms under leaf litter addition.Redundancy analysis showed that ammonia nitrogen (NH+4N) and available phosphorus (AP) were the most important influencing factors of SOC fraction, while dissolved organic carbon (DON) and microbial biomass phosphorus (MBP) were the most important predictors of SON fraction. [Conclusion]P addition can promote the decomposition and transformation of leaf litter in soil, and the input of leaf litter increases the decomposition of recalcitrant C, which will further accelerate the turnover of SOC. This study will provide a scientific basis for the study of carbon and nitrogen cycling in subtropical soil with increased litter input and P limitation and forest soil management in Daiyunshan Nature Reserve.
Key wordsLeaf litter;Phosphorus addition;Twostep acid hydrolysis;Carbon and nitrogen components;Enzyme activity
土壤有机碳(SOC)和土壤有机氮(SON)对维持生态系统功能具有重要作用,尤其在提高土壤和生态系统的可持续性和生产力方面至关重要[1]。土壤碳库是陆地生态系统中最大的碳库,其碳储量约为1 550 Gt(深可达 1 m),是大气或植被碳库的2.5~3.0倍[2]。作为生态系统碳循环的关键因子,SOC微小的动态变化会对外界CO2的排放产生重大影响,最终导致气候的正反馈[3];而SON是矿质氮的源和库,占全氮 90% 以上,是土壤供氮潜力的主要贡献者。因此,识别和控制SOC和SON 的动态变化对于评估陆地生态系统碳、氮通量及全球碳氮模型的预测至关重要。
SOC和SON成分复杂多样,目前对其不同成分动态的单独研究仍存在技术挑战。通常,活性组分是植物和微生物所需养分的直接供应库;而顽固性组分更多地表现为土壤碳、氮的长期储存状态[4]。根据难易降解程度及分解速率,两步酸水解法可以将SOC和SON划分为活性组分和顽固性组分(包括慢性、惰性组分)[5]。这将为探究SOC和SON不同组分动态变化,厘清SOC和SON组分对环境变化的响应及其关键影响因素提供可能。
全球气候变暖情境下,植物光合作用的加强将促进植物生物量增长,引起植物生命周期过程中凋落物增加。通常而言,由于不同森林类型的凋落叶数量和质量不同,其SOC和SON的含量会存在差异。现有研究表明,凋落物增加会显著降低SOC和SON中的活性组分,增加惰性组分,从而增强土壤碳、氮稳定性[6]。其可能原因在于凋落叶输入会改变土壤-凋落叶层的理化性质和生物特性,如有效氮的含量、微生物群落和酶活性[7-8],但对其具体影响过程还缺乏系统认识。此外,近20年亚洲和欧洲大气磷(P)沉降呈显著上升趋势[9],也增加了森林土壤P元素的供应。P元素是植物生长不可或缺的重要养分,P供应增加可以提供有效的P源,减少微生物为获取P而对SOC的利用,从而减少SOC的分解[8]。有研究表明,P添加对SOC的贡献可能是由于通过增加残体分解酶的活性来改变土壤微生物生物量[10-11]。Fang等[12]研究发现,P添加会通过改变微生物群落和纤维生物苷酶活性增加SOC积累。刘仁[13]研究表明,NH+4-N、N∶P、全P等理化性质是调控土壤微生物群落的主导因子。但目前对P添加如何调控SOC和SON组分变化还不够深入。由此可见,凋落叶添加和P添加对SOC和SON组分均存在重要影响,但其作用机制仍有待进一步探索,特别是对两者共同添加如何影响SOC和SON组分还知之甚少。
马尾松(Pinus massoniana,PM)是我国重要的乡土树种之一,具有分布面积广,经济价值高,用途广,适应性强等特点,广泛分布于我国亚热带地区,并延至北热带[14]。前期试验发现,针叶树种马尾松、阔叶树种火力楠(Michelia macclurei,MM)和阔叶树种枫香(Liquidambar formosana,LF)的凋落叶因C∶N不同而质量差异较大[14]。因此,笔者采用双因素试验设计,在亚热带马尾松林土壤中单独或共同添加不同质量凋落物和P,通过125 d的室内培养试验,探究马尾松、火力楠和枫香3种凋落叶和P添加对SOC和SON的影响过程及机制,并阐明影响有机碳氮组分的关键因子,以期预测环境变化对亚热带土壤SOC、SON循环过程的影响,为亚热带森林土壤碳氮循环过程及机制研究提供科学依据。
1材料与方法
1.1研究区域与样地概况
试验土壤样品采集于福建戴云山国家级自然保护区(25°38′07″~25°43′40″N,118°05′22″~118°20′15″E),该区属于典型的亚热带海洋性季风气候,海拔为700~1 500 m。年均溫为19.5 ℃,年降水量为1 700~2 000 mm(主要集中在3—9月),年雾日达220 d[15],土壤以花岗岩风化发育而成的红壤为主。2019年5月在马尾松林下去除表面凋落叶后随机选点取样,多点混合成1个土壤样品,研磨过2 mm土壤筛,混匀后4 ℃保存备用。
1.2试验设计与培养
采用双因素试验设计,选择马尾松、火力楠和枫香3个树种进行凋落叶添加,同时分别做施P和不施P处理。试验共8个处理,包括对照(CT),P单独添加(P),马尾松凋落叶单独添加(PM),火力楠凋落叶单独添加(MM),枫香凋落叶单独添加(LF),马尾松凋落叶+P共同添加(PM+P),火力楠凋落叶+P共同添加(MM+P),枫香凋落叶+P共同添加(LF+P),每处理3次重复。具体操作如下:每个处理称取经含水率换算后含100 g干土重的鲜土于500 mL培养瓶中,将不同树种叶片风干磨碎后按照原有SOC 2%的比例进行凋落叶C的添加(20 mg/g SOC),能刺激微生物活性[16]。P添加形式为KH2PO4,依据田间管理方式施P量为30 mg/kg[17]。每处理3次重复,将培养瓶置于25 ℃培养箱中培养,调节土壤含水率到田间最大持水量的60%。培养125 d后测定各项指标数据。
1.3测定项目与方法
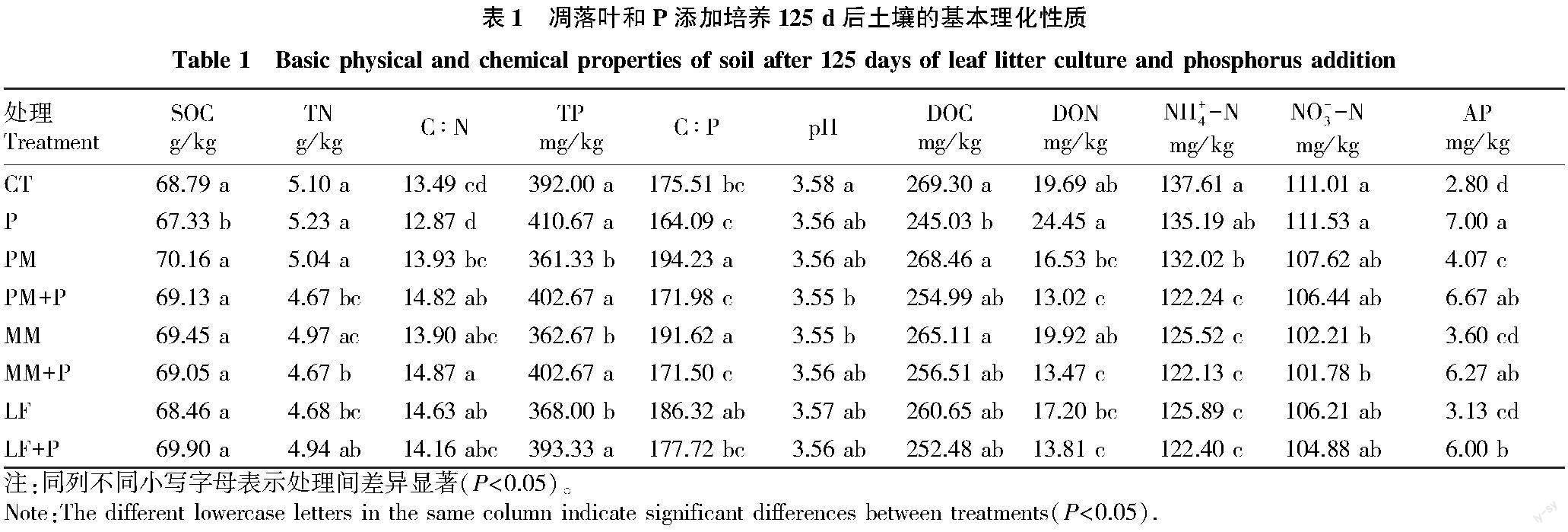
土壤基本理化性质的测定:pH采用电位法,以土∶水为1∶2.5进行混合,振荡静置后用pH计(PHS-3B)测定;可溶性有机碳(DOC)用去离子水以土∶水为1∶4浸提,振荡离心,上清液用0.45 μm滤膜过滤后,用总有机碳分析仪(TOC-VCPH/CPN,Japan)测定;氨态氮(NH+4)和硝态氮(NO-3)用KCl溶液浸提后,经振荡、离心、过滤,于24 h内使用连续流动分析仪(SKALAR San++,Netherlands)测定[18];总磷(TP)采用凯式消煮法提取后用连续流动分析仪(SKALAR San++,Netherlands)测定;土壤有机碳(SOC)和总氮(TN)等采用碳氮元素分析仪(Elementar Vario MAX,Germany)测定[19];有效磷(AP)用0.5 mol/L NaHCO3提取[20],采用连续流动分析仪(SKALAR San++,Netherlands)测定。
土壤SOC、SON的测定:采用2步酸水解法酸解SOC、SON组分[21],即在 1 g通过 0.149 mm 筛的风干土样中加入20 mL 5 mol/L H2SO4,在密封的消煮管中用105 ℃水解30 min,离心、过滤回收水解产物。用20 mL去离子水洗涤残渣,并将洗涤物加入水解液中。将水解产物作为不稳定库I(LPI),分析不稳定库I的C(活性碳,LPI-C)和N(活性氮,LPI-N)。剩下的残渣用2 mL 26 mol/L H2SO4在室温下连续摇动水解过夜。然后用去离子水稀释酸的浓度到2 mol/L,在105 ℃下水解3 h,多次振荡。水解产物的回收方式与LPI相同。将第2个水解产物作为不稳定库II(LPII),分析其C(慢性碳,LPII-C)和N(慢性氮,LPII-N)。不稳定库I主要含有植物来源的多糖(如半纤维素和淀粉)和微生物来源的多糖(主要是微生物细胞壁),而不稳定库II主要由纤维素组成[22-23]。顽固性C(RP-C)和N(RP-N)库计算为总SOC、SON库(即SOC或TN)与不稳定库(LPI和LPII之和)的差值。
土壤微生物生物量的测定:微生物生物量碳(MBC)用氯仿熏蒸-浸提法[24]提取,用总有机碳分析仪(TOC-VCPH/CPN,Japan)测定。微生物生物量氮(MBN)提取方法同MBC,采用连续流动分析仪(SKALAR San++,Netherlands)测定。微生物生物量磷(MBP)采用氯仿熏蒸-NaHCO3浸提法[25]提取,测定仪器同MBN。土壤 MBC、MBN及MBP的计算见梅孔灿等[14]的文献。
土壤微生物酶活性的測定:测定4种水解酶[纤维素水解酶(CBH)、β-葡萄糖苷酶(βG)、β-N-乙酰氨基葡萄糖苷酶(NAG)和酸性P酸酶(ACP)]活性和2种氧化酶[酚氧化酶(PHO)和过氧化物酶(PEO)]活性。测定方法参考Saiya-Cork[26-27]的文献。
1.4数据分析
数据处理和统计分析采用Excel 2019和SPSS 25.0软件,冗余分析(RDA)采用Canoco 5软件,作图采用Origin 9.0软件。不同处理间各指标的差异显著性采用单因素方差分析(One-way ANOVA)和邓肯方差分析法(Duncan)计算。凋落叶、P添加以及两者交互作用对土壤理化性质、SOC、SON组分、土壤微生物生物量和土壤酶活性等指标的影响采用双因素方差分析(Two-way ANOVA)进行分析处理。RDA以不同凋落叶和P添加处理的SOC组分和SON组分为响应变量,以基本理化性质、土壤微生物生物量和酶活性为解释变量进行分析。
2结果与分析
2.1土壤基本理化性质
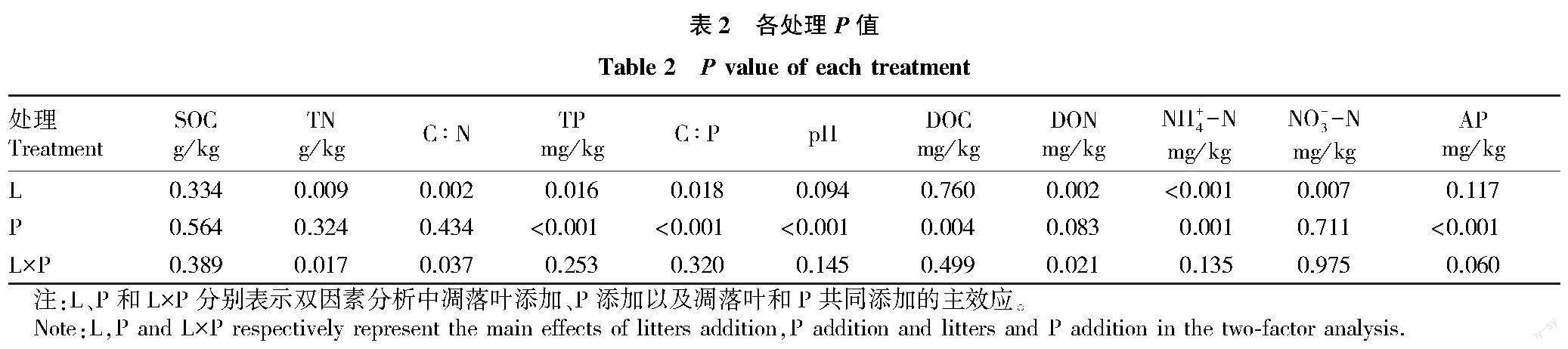
培养结束时,凋落叶添加对N有效性的影响显著,凋落叶添加显著降低了DON(P=0.002)、NH+4-N(P<0.001)和NO-3-N(P=0.007)的含量,凋落叶和P共同添加时,进一步降低了土壤中DON和NH+4-N的含量。P添加处理对TN和C∶N无影响,但当凋落叶添加TN和C∶N极显著降低(P<0.01),且凋落叶和P添加交互作用显著(P<0.05)。凋落叶添加对TP和C∶P的影响与TN和C∶N一致(P<0.05),但P添加整体上提高了土壤TP的含量和AP含量(P<0.001),降低了C∶P的含量(P<0.001),且极显著降低了DOC的含量(P<0.01)(表1、2)。
2.2不同处理对SOC和SON的影响
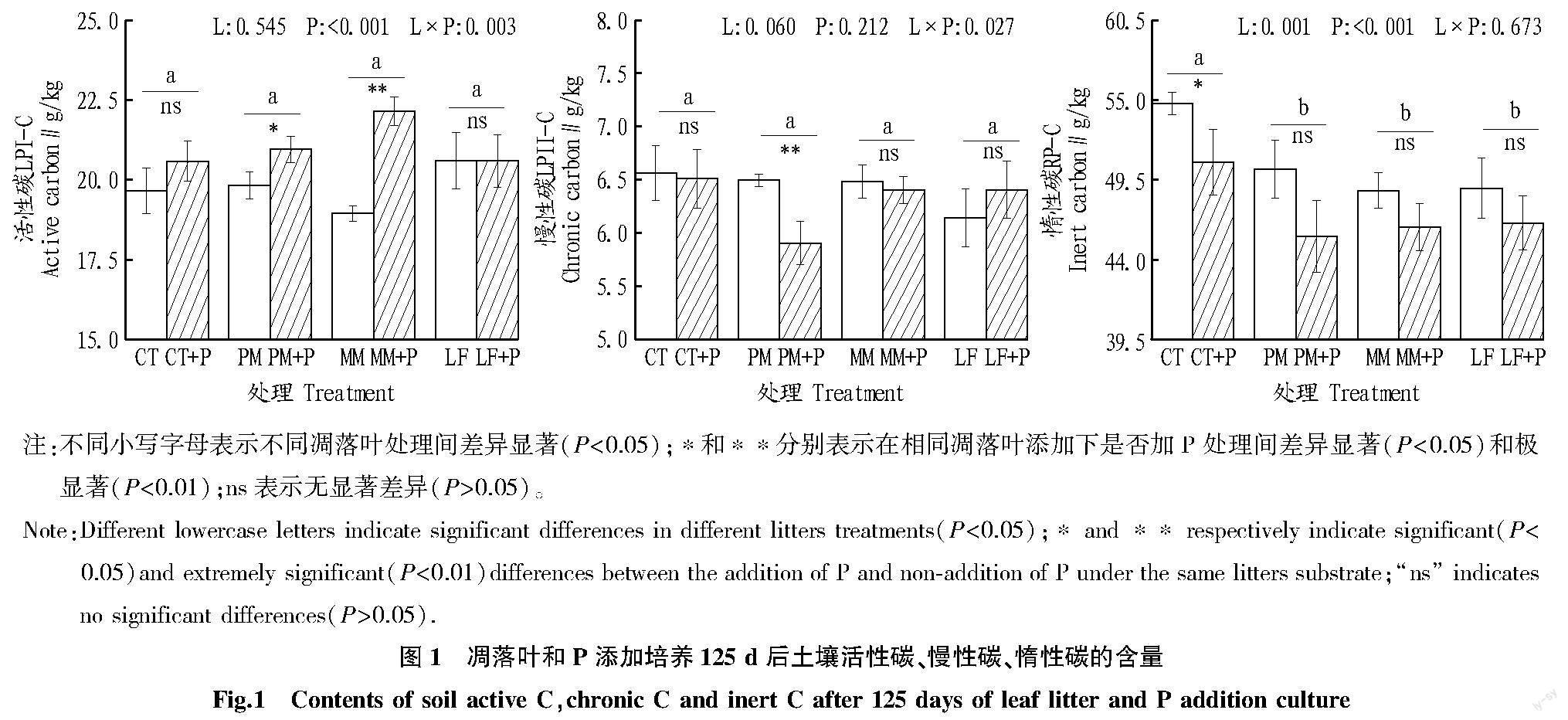
结果显示,单独凋落叶添加和单独P添加均极显著降低了RP-C组分的含量(P<0.01)。相比于单独凋落叶添加,凋落叶和P共同添加对活性碳LPI-C和慢性碳LPII-C的影响更加显著。具体而言,相比于PM单独添加,PM+P处理下LPI-C组分的含量显著增加,而LPII-C组分的含量极显著降低(P<0.01);相比于MM处理,MM+P处理则极显著增加了LPI-C组分含量(P<0.01)(图1)。
凋落叶添加对各SON组分有显著影响(P<0.05),但各处理之间,只有MM和LF 2种凋落叶添加显著增加了土壤中RP-N组分的含量(P<0.05)。单独P添加对各SON组分均无显著影响,但相比单独凋落叶添加处理,PM+P处理显著增加了LPI-N组分,而降低了LPII-N组分(P<0.05);MM+P处理极显著提高了LPI-N组分(P<0.01),显著提高了RP-N组分(P<0.05)的含量;LF+P处理也显著提高了RP-N组分的含量(P<0.05)。此外,凋落叶和P添加处理对各SON组分均有极显著交互作用(P<0.01)(图2)。
2.3土壤微生物生物量和酶活性的变化
P和凋落叶添加对微生物影响显著,且不同凋落叶添加具有一定差异。具体而言,P添加处理对3种微生物生物量均有极显著影响(P<0.01),P添加极显著降低了MBC,而极显著增加了MBN和MBP(P<0.01)。单独凋落叶添加时,对MBC和MBP影响不显著(P>0.05),而PM和LF 2种凋落物添加极显著增加了MBN的含量(P<0.01)。比较单独添加与共同添加对微生物量影响发现,其影响效应具有一定差异,对MBN表现出较强的交互作用(图3)。
经125 d培养后,对土壤中6种酶活性进行测定。结果显示,凋落叶添加对4种土壤水解酶作用极显著(P<0.001),对2种土壤氧化酶作用显著(P<0.05);而P添加处理除对PHO影响不显著外(P=0.848),对另外5种酶均具有显著(P<0.05)或极显著影响(P<0.01);同时,P和凋落叶共同添加对6种土壤酶均具有极显著的交互作用(P<0.001)。具体而言,单独P添加显著增加了βG和NAG 2种水解酶的含量(P<0.05),对其他土壤酶则影响不显著(P>0.05)(图4)。
2.4SOC和SON与环境因子的相关性
土壤环境因子对SOC组分的解释度达78.99%,其中第1轴解释度为75.37%,第2轴解释度为3.62%。对SOC组分存在显著影响的因子包括NH+4-N、AP、PEO和C∶P,其中NH+4-N(64.7%)解释度最高,其次为AP(9.2%)。在所有SOC组分中,RP-C与环境因子相关程度最高,其次为LPI-C组分。从RDA结果可以看出,相同处理的平行样在RDA1轴上分布较为集中,而在RDA2轴上分布较为分散,可见NH+4-N和AP 2个环境因子在不同处理间的影响效果更为显著,而PEO和C∶P的差异更易造成同一处理的平行样品间SOC组分的差异(图5A)。
土壤环境因子对SON组分的解释度达73.30%,其中第1轴解释度为73.17%,第2轴解释度为0.13%。对SON组分存在显著影响的因子包括DON、MBP、TN、MBC和βG,其中对SON组分解释度最高的是DON(44.6%),其次是MBP(10.2%)。在所有SON组分中,RP-N与环境因子相关程度最高,其次为LPI-N组分。这与SOC组分与环境因子关系情况类似,RP-N易受到环境因子的影响,其次是LPI-N组分(图5B)。
3讨论
3.1凋落叶添加对SOC和SON的影响
该研究中凋落叶添加仅显著降低了RP-C组分,表明相比于LPI-C组分,难降解C组分更易受到不稳定碳输入的影响,这与Chen等[28]的研究结果一致。这可能是由于分解难降解C组分的土壤微生物,其C限制阈值相对较高,微生物休眠比例较大,当新鲜C输入时,这种微生物更高比例被激活从而加速难降解C的分解。陈子豪等[29]研究发现,在有新鲜碳输入的生态系统中,活性碳的含量会增加。但该研究中,土壤中总的SOC并无显著变化,这可能是由于新鲜碳的输入激活了更多微生物分泌更多胞外酶,从而增加了对SOC的利用。
此外,不同凋落叶添加对LPI-N和LPII-N 2种SON组分无显著性影响,但MM和LF 2种凋落叶添加显著提升了土壤RP-N组分的含量。可能的原因在于MM和LF 2种均为阔叶树种凋落叶,相对于PM具有更高的C/N,通常较高的C/N更难释放活性有机质,而倾向于产生难降解有机质。因此,低质量凋落叶(高C/N)的输入可降低对土壤RP-N的利用,说明凋落叶质量也是影响土壤N组分的重要因素之一。但MM和LF 2种凋落叶添加后N循环相关的水解酶的含量变化差异较大,表明 2种凋落叶输入对SON组分的影响途径不尽相同。
3.2P添加对SOC和SON组分的影响
该研究中,單独P添加显著降低了土壤中RP-C组分,表明P养分有效性对惰性碳组分影响显著,这与Liu等[30]的研究结果一致。这可能是由于土壤难降解C组分分解微生物更易受P限制的影响。有研究表明,与N有效性相比,P有效性对热带和亚热带森林土壤的C循环影响更大[31]。与此同时,当凋落叶与P共同添加时,RP-C组分相比于对照组均显著降低,这与Hartman等[32]的研究结果一致。这可能是由于P与凋落物共同添加进一步缓解了土壤难降解C分解微生物的C、N以及P限制。P添加显著调节微生物活性和代谢率,对土壤C的周转具有不可或缺的反馈作用[33]。
单独P添加对SON各组分无显著影响,这与Feng等[34]的研究结果一致。而凋落叶与P共同添加时,则更易增加RP-N和LPI-N组分的含量,说明P对土壤SON组分存在重要影响,且不同凋落叶对土壤SON组分影响具有显著差异。这可能是凋落叶质量差异形成土壤碳氮化学计量不同而引起的微生物群落结构变化造成的。凋落叶和P的输入还促进了微生物对无机氮的同化,特别是当凋落叶添加时,无机氮的含量大幅降低,MBN 含量显著提高,这与董冬玉等[35]的研究结果一致。这可能是由于无机氮被微生物同化为有机氮或固定在微生物体内。
3.3凋落物和P添加下SOC和SON组分的影响因子
C和其他营养物质(如P)的有效性常常限制土壤中异养微生物的生长和活性[36],因此可以强烈影响C的转化和损失,以及SON矿化和随后的N转化。冗余分析发现,不同处理间的SOC组分具有较好的聚类结果,SOC组分与土壤NH+4-N含量呈显著正相关,这与吴玥等[37]研究结果一致。NH+4-N作为有效N的重要组成部分,微生物可对其快速利用而增加自身活性,更快分解土壤有机质,从而改变SOC组分含量和结构。N含量与SOC间的重要关系已得到很多验证[38-39],基于水稻土的研究也显示LPI-C和RP-C含量与土壤全氮、C/N间存在显著线性关系。该结果表明,SON组分与DON呈显著负相关,可见无机氮有效性对SON组分也具有重要影响。
此外,需要强调的是微生物和胞外酶对SOC和SON的作用。RDA分析结果显示,MBP、MBC、βG和PEO等生物特性对SOC和SON也具有重要影响。微生物是森林生态系统凋落叶分解的驱动者,凋落叶分解过程基本上是由土壤酶控制的。枫香凋落叶作为高C/N有机物添加,造成土壤N素相对匮乏,进而引起微生物多分泌NAG胞外酶来稳定自身C/N,这可以从LF+P添加NAG酶含量显著高于其他处理得到验证。此外,土壤胞外酶活性是影响土壤呼吸的主要因素,而土壤呼吸的强弱直接反映了土壤有机质分解速率,因而胞外酶的活性也是影响土壤C组分的重要因素。没有胞外酶,土壤微生物难以分解复杂的结构性碳[40],如与难降解的木质素和腐殖质有关的PHO和过氧化物酶PEO[41]。此外,C、N的有效性变化对土壤有机质变化的影响可能是通过酶活性的变化来调节的[42]。
4结论
该研究结果表明,凋落叶添加显著降低了惰性碳(RP-C)组分,而改变了土壤碳库的组成结构,但对SON组分作用受凋落叶质量及与P添加交互作用的影响。P添加进一步缓解了微生物P限制对SOC、SON组分利用的抑制,说明P有效性是P限制亚热带森林土壤碳循环的重要影响因素之一。凋落叶和P添加均可直接或间接改变土壤环境因子,而NH+4-N和DON等环境因子是影响土壤C、N组分的重要影响因素。
参考文献
[1] FANG Y Y,NAZARIES L,SINGH B K,et al.Microbial mechanisms of carbon priming effects revealed during the interaction of crop residue and nutrient inputs in contrasting soils[J].Global change biology,2018,24(7):2775-2790.
[2] POST W M,KWON K C.Soil carbon sequestration and landuse change:Processes and potential[J].Global change biology,2000,6(3):317-327.
[3] HEIMANN M,REICHSTEIN M.Terrestrial ecosystem carbon dynamics and climate feedbacks[J].Nature,2008,451(7176):289-292.
[4] 王蓓,孙庚,罗鹏,等.模拟升温和放牧对高寒草甸土壤有机碳氮组分和微生物生物量的影响[J].生态学报,2011,31(6):1506-1514.
[5] MCLAUCHLAN K K,HOBBIE S E.Comparison of labile soil organic matter fractionation techniques[J].Soil science society of America,2004,68(5):1616-1625.
[6] 郭晓伟.凋落物处理和氮添加对森林土壤碳氮组分和微生物过程的影响[D].北京:北京林业大学,2020.
[7] 张燕,强薇,罗如熠,等.氮磷添加对土壤微生物生长、周转及碳利用效率的影响研究进展[J].应用与环境生物学报,2022,28(2):526-534.
[8] ZHAO Q,CLASSEN A T,WANG W W,et al.Asymmetric effects of litter removal and litter addition on the structure and function of soil microbial communities in a managed pine forest[J].Plant soil,2017,414(1/2):81-93.
[9] PAN Y P,LIU B W,CAO J,et al.Enhanced atmospheric phosphorus deposition in Asia and Europe in the past two decades[J].Atmospheric and oceanic science letters,2021,14(5):1-5.
[10] CAMENZIND T,HTTENSCHWILER S,TRESEDER K K,et al.Nutrient limitation of soil microbial processes in tropical forests[J].Ecological monographs,2018,88(1):4-21.
[11] YUAN Y,LI Y,MOU Z J,et al.Phosphorus addition decreases microbial residual contribution to soil organic carbon pool in a tropical coastal forest[J].Global change biology,2021,27(2):454-466.
[12] FANG X M,ZHANG X L,CHEN F S,et al.Phosphorus addition alters the response of soil organic carbon decomposition to nitrogen deposition in a subtropical forest[J].Soil biology and biochemistry,2019,133:119-128.
[13] 劉仁.凋落物添加和去除对杉木林土壤剖面有机碳组分及微生物特性的影响[D].南昌:江西农业大学,2021.
[14] 梅孔灿,陈岳民,范跃新,等.凋落叶和磷添加对马尾松林土壤碳激发效应的影响[J].土壤学报,2022,59(4):1089-1099.
[15] SONG X Z,CHEN X F,ZHOU G M,et al.Observed high and persistent carbon uptake by Moso bamboo forests and its response to environmental drivers[J].Agricultural and forest meteorology,2017,247:467-475.
[16] BLAGODATSKAYA Е,KUZYAKOV Y.Mechanisms of real and apparent priming effects and their dependence on soil microbial biomass and community structure:Critical review[J].Biology and fertility of soils,2008,45(2):115-131.
[17] ZHU Z K,GE T D,LUO Y,et al.Microbial stoichiometric flexibility regulates rice straw mineralization and its priming effect in paddy soil[J].Soil biology and biochemistry,2018,121:67-76.
[18] HUANG Z Q,WAN X H,HE Z M,et al.Soil microbial biomass,community composition and soil nitrogen cycling in relation to tree species in subtropical China[J].Soil biology and biochemistry,2013,62:68-75.
[19] GUO M X.Soil sampling and methods of analysis[J].Journal of environmental quality,2009,38(1):375.
[20] OLSEN S R,SOMMERS L E.Phosphorus[M]∥PAGE A L.Methods of soil analysis,part 2.2nd Edition.Madison,WI:American Society of Agronomy,Inc.,1982:403-431.
[21] LI Y Q,QING Y X,LYU M K,et al.Effects of artificial warming on different soil organic carbon and nitrogen pools in a subtropical plantation[J].Soil biology and biochemistry,2018,124:161-167.
[22] OADES J M,KIRKMAN M A,WAGNER G H.The use of gasliquid chromatography for the determination of sugars extracted from soils by sulfuric acid[J].Soil science society of America proceedings,1970,34(2):230-235.
[23] ROVIRA P,VALLEJO V R.Labile,recalcitrant,and inert organic matter in Mediterranean forest soils[J].Soil biology and biochemistry,2007,39(1):202-215.
[24] VANCE E D,BROOKES P C,JENKINSON D S.An extraction method for measuring soil microbial biomass C[J].Soil biology and biochemistry,1987,19(6):703-707.
[25] BROOKES P C,POWLSON D S,JENKINSON D S.Measurement of microbial biomass phosphorus in soil[J].Soil biology and biochemistry,1982,14(4):319-329.
[26] SAIYACORK K R,SINSABAUGH R L,ZAK D R.The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil [J].Soil biology and biochemistry,2002,34(9):1309-1315.
[27] SINSABAUGH R L,TURNER B L,TALBOT J M,et al.Stoichiometry of microbial carbon use efficiency in soils[J].Ecological monographs,2016,86(2):172-189.
[28] CHEN L Y,LIU L,QIN S Q,et al.Regulation of priming effect by soil organic matter stability over a broad geographic scale[J].Nature communications,2019,10(1):1-10.
[29] 陳子豪,焦泽彬,刘谣,等.凋落物季节性输入对川西亚高山森林土壤活性有机碳的影响[J].应用与环境生物学报,2021,27(3):594-600.
[30] LIU L,GUNDERSEN P,ZHANG T,et al.Effects of phosphorus addition on soil microbial biomass and community composition in three forest types in tropical China[J].Soil biology and biochemistry,2012,44(1):31-38.
[31] CHEN Y,LIN H,SHEN N,et al.Phosphorus release and recovery from Feenhanced primary sedimentation sludge via alkaline fermentation[J].Bioresource technology,2019,278:266-271.
[32] HARTMAN W H,RICHARDSON C J.Differential nutrient limitation of soil microbial Biomass and metabolic quotients(qCO2):Is there a biological stoichiometry of soil microbes?[J].PLoS One,2013,8(3):1-14.
[33] MOOSHAMMER M,WANEK W,SCHNECKER J,et al.Stoichiometric controls of nitrogen and phosphorus cycling in decomposing beech leaf litter[J].Ecology,2012,93(4):770-782.
[34] FENG J G,ZHU B.Global patterns and associated drivers of priming effect in response to nutrient addition[J].Soil biology and biochemistry,2021,153:1-11.
[35] 董冬玉,王丹婷,馬红亮,等.添加葡萄糖对中亚热带阔叶林土壤氮转化的影响[J].土壤,2019,51(1):19-24.
[36] CLEVELAND C C,TOWNSEND A R,SCHMIDT S K.Phosphorus limitation of microbial processes in moist tropical forests:Evidence from shortterm laboratory incubations and field studies[J].Ecosystems,2002,5(7):680-691.
[37] 吴玥,赵盼盼,林开淼,等.戴云山黄山松林土壤碳组分的海拔变化特征及影响因素[J].生态学报,2020,40(16):5761-5770.
[38] 向慧敏,温达志,张玲玲,等.鼎湖山森林土壤活性碳及惰性碳沿海拔梯度的变化[J].生态学报,2015,35(18):6089-6099.
[39] 梅孔灿.凋落叶和磷添加对马尾松林土壤激发效应的影响及机制[D].福州:福建师范大学,2021.
[40] 廖丹,于东升,赵永存,等.成都典型区水稻土有机碳组分构成及其影响因素研究[J].土壤学报,2015,52(3):517-527.
[41] SINSABAUGH R L.Phenol oxidase,peroxidase and organic matter dynamics of soil[J].Soil biology and biochemistry,2010,42(3):391-404.
[42] MEYER N,WELP G,RODIONOV A,et al.Nitrogen and phosphorus supply controls soil organic carbon mineralization in tropical topsoil and subsoil[J].Soil biology and biochemistry,2018,119:152-161.
