蠋蝽热激蛋白基因AcHsp83a和AcHsp83b的克隆、表达谱及对高低温和UV-B胁迫的响应
2024-01-03孟建玉何龙春张雪霞杨昌利张长禹
孟建玉, 金 鑫, 何龙春, 张雪霞, 杨昌利, 张长禹,*
(1. 贵州省烟草科学研究院, 贵阳 550081; 2. 贵州省烟草公司贵阳市公司, 贵阳 550002; 3. 贵州大学农学院, 贵阳 550025)
蠋蝽Armachinensis属半翅目(Hemiptera)蝽科(Pentatomidae),是许多农林业害虫的优势天敌,其成虫和若虫对鳞翅目(Lepidoptera)、鞘翅目(Coleoptera)、半翅目(Hemiptera)和膜翅目(Hymenoptera)等40余种害虫具有较强的捕食能力(Zouetal., 2013; Mengetal., 2022)。蠋蝽搜寻到害虫后,可将口针刺入害虫的头、胸或腹部,然后刺吸害虫的体液(唐艺婷等, 2019)。孟建玉等(2022)研究发现蠋蝽3-5龄若虫对草地贪夜蛾Spodopterafrugiperda3龄幼虫的日最大捕食量分别为56.18, 59.88和64.94头,具有良好的控害潜能。大量研究表明蠋蝽可捕食斜纹夜蛾S.litura、小菜蛾Plutellaxylostella、粘虫Mythimnaseparata和烟青虫Helicoverpaassulta等多种鳞翅目害虫幼虫(李娇娇等, 2016; 唐艺婷等, 2020; 李发倩等, 2021; 杨灿等, 2022)。由于蠋蝽便于人工饲养和大规模扩繁,已在国内初步实现商品化供应,在烟草、蔬菜、园林等多种作物害虫的生物防治发挥了重要作用,具有广阔的应用前景。目前,关于蠋蝽的研究主要集中在捕食能力、生物学特性、系统发育和化学生态学等方面,但对蠋蝽的环境适应性研究鲜有报道。
Tissiéres等(1974)在研究中发现,黑腹果蝇Drosophilamelanogaster在热激反应发生时能够产生一种高度保守的特异性蛋白,并将其命名为热激蛋白(heat shock protein, Hsp),也称热休克蛋白。根据热激蛋白保守结构域的不同和分子量的大小可将其分为5个家族:Hsp100, Hsp90, Hsp70, Hsp60, Hsp40和小分子热激蛋白(small heat shock proteins, sHsps)(Kimetal., 1998; Hoffmannetal., 2003)。Hsp83属于Hsp90家族,参与昆虫多种生理生化反应,如细胞间信息传导、胚胎发生和生物应激反应等,对昆虫生长发育和响应环境胁迫具有重要作用(Knorr and Vilcinskas, 2011; Heetal., 2014; Schopfetal., 2017)。在意大利蜜蜂Apismelliferaligustica性腺发育研究中发现,Hsp83表达量显著上调参与其卵子发生过程(Lagoetal., 2022)。在温度胁迫下,腐食酪螨Tyrophagusputrescentiae和马铃薯甲虫Leptinotarsadecemlineata的Hsp90转录水平均显著上升,从而减少温度带来的不利影响(Dumasetal., 2019; Wangetal., 2021)。黑纹粉牒Pierismelete在滞育状态下受到4 ℃低温和31 ℃高温诱导时,Hsp90的表达量显著上调(Wuetal., 2018)。近年来,由于环境污染对大气层臭氧层的破坏,使得地球表面的UV-B辐射急剧增加,从而对昆虫造成胁迫,影响其生长发育(Potter and Woods, 2013; Qianetal., 2016),研究表明,在UV-B胁迫下,烟蚜Myzuspersicae可通过Hsp90表达量变化响应UV-B胁迫(苏丽等, 2018)。
本研究利用RT-PCR技术克隆蠋蝽热激蛋白基因AcHsp83a和AcHsp83b,通过生物信息学方法分析其序列特征,使用RT-qPCR检测AcHsp83a和AcHsp83b在蠋蝽不同发育阶段、成虫不同组织以及不同时长温度(38和4 ℃)和UV-B胁迫下的相对表达量,揭示AcHsp83a和AcHsp83b在蠋蝽响应高低温和UV-B胁迫中的作用,探究蠋蝽在响应环境胁迫的分子机制,为科学利用蠋蝽提供理论支持。
1 材料与方法
1.1 试虫
蠋蝽虫源来自贵州省烟草科学研究院福泉基地,饲养条件为温度(26±1) ℃、相对湿度65%±5%和光周期16L∶8D。
1.2 样品收集
随机分别收集蠋蝽卵50粒、1龄若虫40头、2龄若虫30头、3龄若虫20头、4龄若虫15头、5龄若虫10头、雌成虫10头和雄成虫10头,重复3次,取样后立即置于液氮中保存。收集蠋蝽成虫头、胸、腹和翅(每个组织取样15头)以及触角、脂肪体、足、马氏管、口器、中肠、卵巢/精巢(每个组织取样20头),重复3次,取样后立即置于液氮中保存。
将蠋蝽雌成虫和雄成虫从 26 ℃常规饲养温度条件下分别转移至38 ℃高温和4 ℃低温下进行胁迫处理,处理0(CK), 6和24 h时每个处理取10头,重复3次,取样后立即置于液氮中保存。选取蠋蝽雌成虫和雄成虫暗适应2 h后进行UV-B照射,照射强度为320 μW/cm2,处理0(CK), 6和12 h时每个处理取10头,重复3次,取样后立即置于液氮中保存。
1.3 总RNA提取和cDNA合成
采用Eastp®Super Total RNA Extraction Kit(Promega)提取1.2节蠋蝽总RNA,通过1%琼脂糖凝胶电泳和超微量紫外分光光度计NanoDrop 2000 (Thermo)检测RNA的质量和浓度。以总RNA为模板,利用HiFiScript cDNA Synthesis Kit(CoWin Biosciences)合成cDNA第1链。
1.4 蠋蝽Hsp90s的克隆
通过对已知同源昆虫Hsp83序列比对及蠋蝽转录组数据,在保守区设计特异性引物(表1),以cDNA第1链为模板扩增蠋蝽Hsp83。PCR反应体系(25 μL): cDNA模板1.5 μL, TaKaRa Ex Primer TaqTM酶(1.25 μmol/25 μL) 12.5 μL, 正反向引物(10 μmol/L)各1 μL, ddH2O 9 μL。扩增程序: 98 ℃ 3 min; 98 ℃ 10 s, 55~58 ℃ 20 s, 72 ℃ 1 min, 34个循环;72 ℃ 5 min。采用琼脂糖凝胶电泳检测PCR产物,用SanPrep Column PCR Product Purification Kit(Sangon Biotech)回收纯化目的片段,连接克隆pMDTM19-T载体(TaKaRa)并转化至大肠杆菌EscherichiacoliDH5α感受态细胞(TaKaRa),挑取经PCR检测的阳性克隆送至生工生物工程有限公司测序。

表1 本研究所用引物
1.5 序列分析
利用NCBI Blast工具进行同源序列检索确认后获得基因的全长序列,利用ORF Finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)查找蠋蝽AcHsp83a和AcHsp83b的开放阅读框,用DNAMAN(Lynnon Biosoft, San Ramon, CA, 美国)推导编码蛋白氨基酸序列,使用ExPASy ProtParam(http:∥us.expasy.org/tools/protparam.html)预测蛋白理化性质,使用ExPASy PROSITE(https:∥prosite.expasy.org/prosite.html)和InterProScan(http:∥www.ebi.ac.uk/Tools/pfa /iprscan/)预测结构域。利用BLASTP(http:∥blast.ncbi.nlm.nih.gov/blast.cgi)搜索比对其他昆虫同源蛋白质序列,应用软件MEGA 6.0以邻接法(1 000次重复)构建系统发育树(Tamuraetal., 2011)。
1.6 蠋蝽AcHsp83a和AcHsp83b的表达分析
采用RT-qPCR检测蠋蝽不同发育阶段、成虫不同组织、不同温度和UV-B胁迫下AcHsp83a和AcHsp83b的表达量,根据基因全长序列在编码区设计定量引物(表1),以GAPDH,RPL27和β-actin作为内参基因。按照TB Green®Premix DimerEraserTM试剂盒(TaKaRa)进行RT-qPCR,反应体系: cDNA模板1 μL, TB Green Premix Ex Taq 10 μL, ROX Reference Dye Ⅱ 0.4 μL, 正反向引物(10 μmol/L)各1 μL, 6.6 μL ddH2O。反应程序: 95 ℃ 30 s; 95 ℃ 5 s, 57 ℃ 30 s, 40个循环,3次生物学重复,使用2-ΔΔCt法进行基因表达量相对定量分析。
1.7 数据分析
实验数据采用SPSS21.0进行统计分析,采用Duncan法进行差异显著性分析。
2 结果
2.1 蠋蝽AcHsp83a和AcHsp83b的克隆与序列
克隆获得蠋蝽AcHsp83a和AcHsp83b(GenBank登录号分别为OP791883和OP791884),开放阅读框(ORF)分别长为2 172和2 163 bp,分别编码723和720个氨基酸,编码蛋白相对分子量分别为83.12和82.90 kD,等电点(pI)分别为4.94和4.97,稳定性系数分别为42.61和39.91。AcHsp83a和AcHsp83b的保守位点都为YSNKEIFLRE, AcHsp83a和AcHsp83b有7条Hsp90热休克蛋白特征序列,即ETFAFQAEIAQLMSLIINTFY, SNKEIFLR ELISNSSDALDKIRY, SLTIIDTGIGMTKADLVN, NLG TIAKSGTKAFMEALQ, IGQFGVGFYSAYLVADRVTV SSK, RGTKIVLYIKEDQAEFLE和ERKIKEVVKKHS QFIGYPI, AcHsp83a和AcHsp83b氨基酸尾端有MEEVD序列,表明两个蛋白存在于细胞质中,为胞质热激蛋白。
系统发育树显示(图1),AcHsp83a和AcHsp83b与茶翅蝽HalyomorphahalysHsp83(GenBank登录号: XP_014284945.1)聚为一支,其他昆虫Hsp83按目聚为一支;序列相似性分析表明,蠋蝽AcHsp83a和AcHsp83b与茶翅蝽Hsp83(GenBank登录号: XP_014284945.1)的氨基酸序列一致性最高。

图1 邻接法构建的基于氨基酸序列的蠋蝽与其他昆虫Hsp83系统进化树(1 000次重复)
2.2 蠋蝽AcHsp83a和AcHsp83b在不同发育阶段和成虫组织中的表达量
AcHsp83a和AcHsp83b在蠋蝽不同发育阶段的表达模式不同(图2)。AcHsp83a在蠋蝽所有发育阶段均有表达,在卵期的表达量最高,显著高于其他发育阶段的(P<0.05),其次是在雄成虫和雌成虫中的(图2: A)。AcHsp83b除在5龄若虫中不表达外,在其他发育阶段均有表达,且在雄成虫中表达量最高,其次是在雌成虫中的,雌雄成虫中的表达量显著高于其他发育阶段的(P<0.05)(图2: B)。
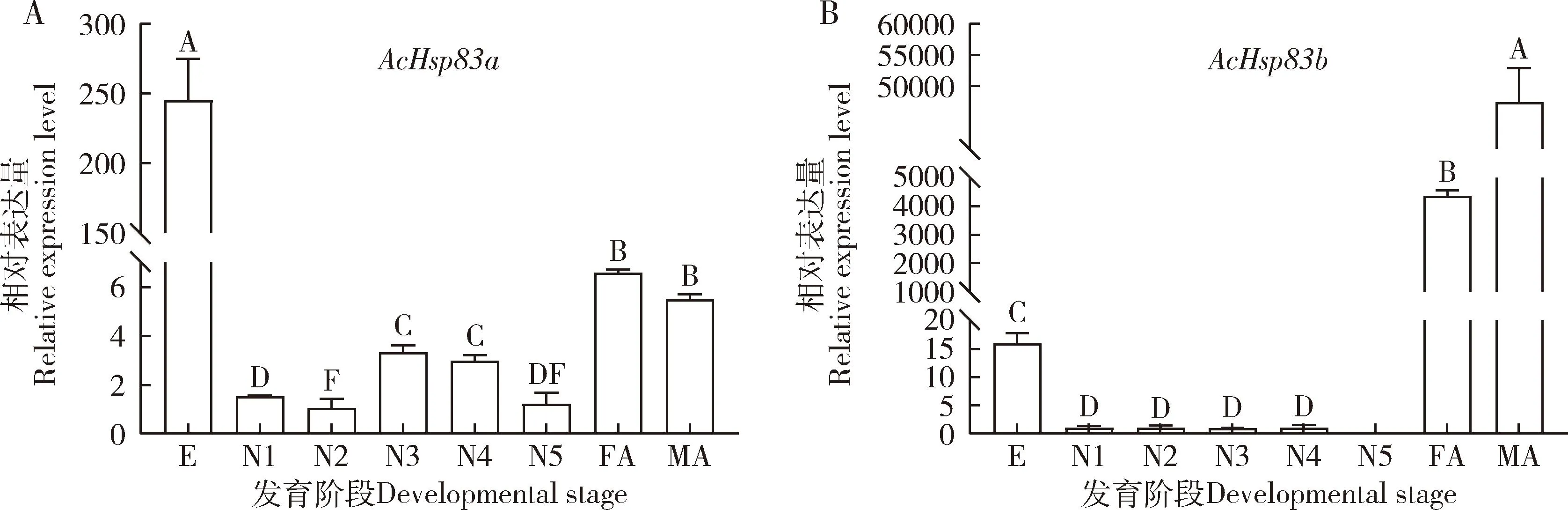
图2 不同发育阶段蠋蝽AcHsp83a(A)和AcHsp83b(B)的相对表达量
AcHsp83a和AcHsp83b在蠋蝽雌雄成虫11种组织中的表达量存在显著差异(图3)。在雌成虫中,AcHsp83a和AcHsp83b均在中肠中表达量最高。在雄成虫中,AcHsp83a在精巢中表达量最高,其次是在马氏管中的(图3: A);AcHsp83b在中肠中表达量最高,其次是在马氏管中的(图3: B)。

图3 蠋蝽成虫不同组织中AcHsp83a(A)和AcHsp83b (B)的相对表达量
2.3 蠋蝽AcHsp83a和AcHsp83b在高低温胁迫下的表达量
高温能诱导蠋蝽AcHsp83a和AcHsp83b的表达(图4)。38 ℃胁迫下,雌雄成虫AcHsp83a和雌成虫AcHsp83b的表达量先升高后下降,AcHsp83a在6 h的表达量最高,且显著高于对照(0 h)(P<0.05)(图4: A);随着胁迫时间的延长,雌雄成虫AcHsp83b的表达量在24 h时较6 h时的均显著降低(P<0.05),雄成虫AcHsp83b在6和24 h时的表达量均较对照组的显著下降(P<0.05)(图4: B)。
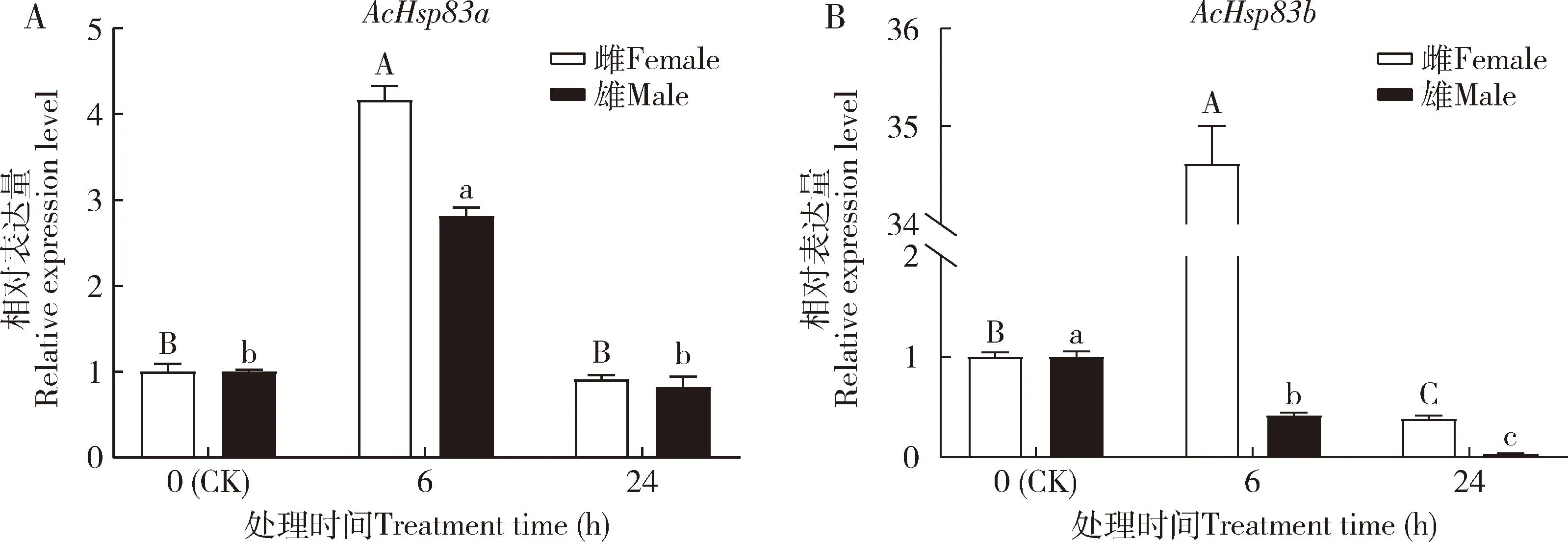
图4 蠋蝽成虫AcHsp83a (A)和AcHsp83b (B)在38 ℃高温胁迫下的相对表达量
低温胁迫下蠋蝽AcHsp83a和AcHsp83b的表达有所不同(图5)。4 ℃胁迫下,雌成虫AcHsp83a和AcHsp83b表达量出现先增加后降低的趋势,在6 h的表达量显著高于对照(0 h)(P<0.05);与6 h相比,随着低温胁迫时间的延长,AcHsp83a和AcHsp83b表达量均显著下降(P<0.05)。雄成虫AcHsp83a的表达量先降低后升高,在6 h显著低于对照(P<0.05);AcHsp83b在6和24 h的表达量较对照均显著降低(P<0.05)。
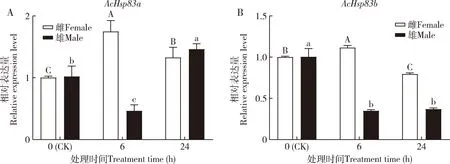
图5 蠋蝽成虫AcHsp83a (A)和AcHsp83b (B)在4 ℃低温胁迫下的相对表达量
2.4 蠋蝽AcHsp83a和AcHsp83b在UV-B胁迫下的表达量
蠋蝽AcHsp83a和AcHsp83b在UV-B胁迫下的表达有所差异(图6),雄成虫AcHsp83a在6 h时的表达量显著高于对照(0 h)(P<0.05),雌成虫AcHsp83a表达量在12 h时显著低于对照(P<0.05);雌成虫AcHsp83b在6 h时的表达量显著高于对照(P<0.05),雄成虫AcHsp83b在6和12 h时的表达量较对照均显著降低(P<0.05)。
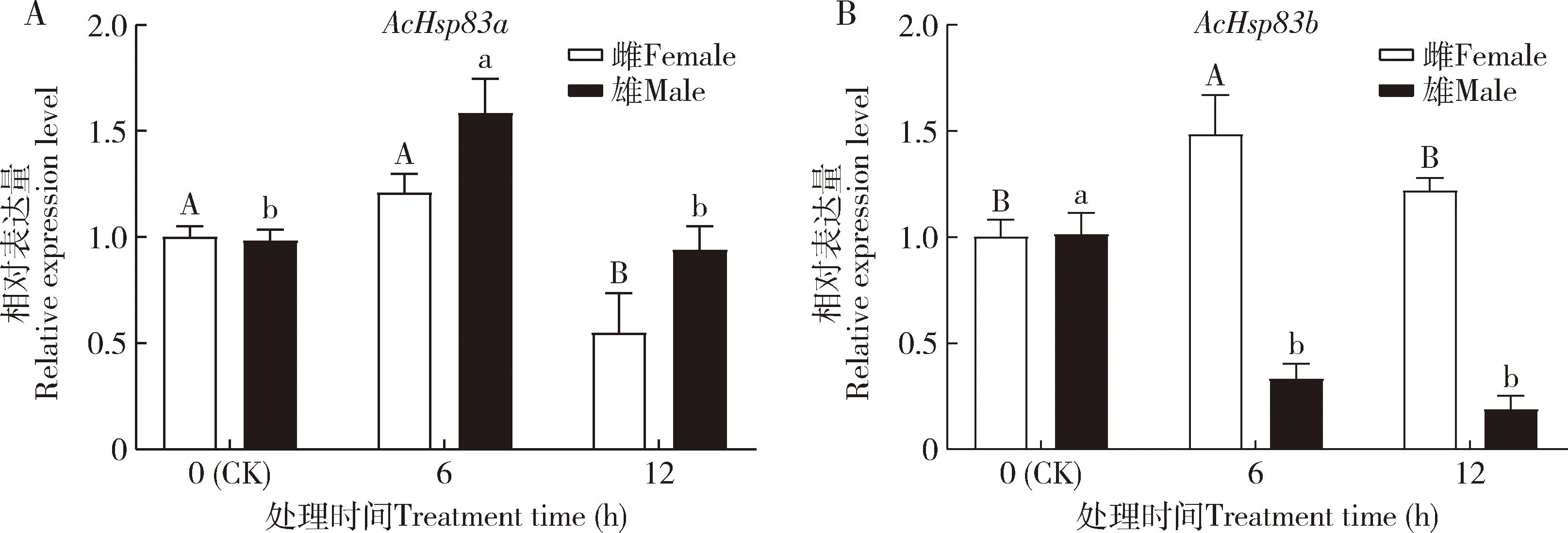
图6 蠋蝽成虫AcHsp83a (A)和AcHsp83b (B)在320 μW/cm2 UV-B胁迫下的相对表达量
3 讨论
本研究基于转录组克隆得到蠋蝽AcHsp83a和AcHsp83b基因序列,其ORF分别长2 172和2 163 bp,分别编码723和720个氨基酸。氨基酸序列分析结果显示,AcHsp83a和AcHsp83b均具有5个家族签名序列。在氨基酸序列C末端,AcHsp83a和AcHsp83b 存在EEVD结构,均存在细胞质,该结果与Csermely等 (1998)和Wang等(2019)研究结果一致。由系统发育树可知,蠋蝽AcHsp83a和AcHsp83b与半翅目昆虫Hsp83聚为一支(图1), 证明Hsp90基因在进化中具有保守性。这与赤拟谷盗TriboliumcastaneumHsp90研究结果(Knorr and Vilcinskas, 2011)相同。
Hsp90家族具有高度保守性,在昆虫生长发育过程中具有重要作用,包括适应环境胁迫、介导蛋白活性和参与胚后发育等多种生理过程(Knorr and Vilcinskas, 2011; King and MacRae, 2015; Zhangetal., 2016)。AcHsp83a和AcHsp83b在不同发育阶段的表达研究发现,AcHsp83b在成虫期的表达量显著高于其他发育阶段的,而AcHsp83a在卵期相对表达量达到最大值(图2: A),这说明AcHsp90基因在不同发育阶段的表达具有差异。这与周吕等(2020)对草地贪夜蛾SfHsp90研究结果相一致。同时,AcHsp83a和AcHsp83b在蠋蝽若虫期均有表达(图2),这与黄野螟HeortiavitessoidesHsp90在幼虫期表达结果 (Chengetal., 2018)一致。本研究发现,AcHsp83a和AcHsp83b在蠋蝽成虫不同组织中具有不同的表达模式,其中AcHsp83a在精巢中大量表达(图3: A)。这与Xu等(2010)对赤拟谷盗Hsp83研究结果相同。
温度是影响昆虫生长发育的重要因素之一(Caoetal., 2018; Wangetal., 2020)。在本研究中,蠋蝽受到高温和低温胁迫时,AcHsp83a和AcHsp83b表达量均显著变化,这说明昆虫可通过调节Hsp90s的表达量以响应温度胁迫,从而帮助昆虫适应环境温度的变化(杨静等, 2017)。在本研究中,蠋蝽受到38 ℃高温胁迫时,雌雄成虫AcHsp83a和雌成虫AcHsp83b的表达量先升高后下降,在6 h时的表达量最高(图4),推测高温胁迫可导致Hsp90s的累积,抵御高温胁迫。这与玉米蛀茎夜蛾BusseolafuscaHsp83和近亲真宽水蚤EurytemoraaffinisHsp90研究结果(Gkouvitsasetal., 2009; Rahlffetal., 2017)相一致。随着温度胁迫时间的延长,蠋蝽雌雄成虫AcHsp83a和AcHsp83b的表达量在24 h时均显著降低(图4),可能是因为长时间的高温胁迫对昆虫造成的损伤超过AcHsp83a和AcHsp83b的保护限度,这与草地贪夜蛾、麦红吸浆虫SitodiplosismosellanaHsp90响应高温胁迫时的结果(Chengetal., 2016; 周吕等, 2020)相符。4 ℃胁迫下,在蠋蝽雌成虫中AcHsp83a和AcHsp83b表达量出现先增加后降低的趋势(图5),表明Hsp83可能参与了虫体抗寒调节过程。该结果与两种沙棘木蠹蛾幼虫Hsp90s的表达模式研究结果(Wangetal., 2019)一致。蠋蝽雄成虫经4 ℃处理后,AcHsp83a和AcHsp83b表达显著下降(图5)。这与二化螟盘绒茧蜂CotesiachilonisHsp70-3在低温下的表达模式 (高鹏, 2020)相似。
昆虫长期暴露在UV-B照射下,可以对其生长发育、繁殖、行动以及基因表达等方面造成影响(Isaharaetal., 1999; 杜一民等, 2014; Rechner and Poehling, 2014)。本研究发现,UV-B胁迫下,蠋蝽雌雄成虫AcHsp83a和雌成虫AcHsp83b表达量先升高后下降,在6 h时表达量最高(图6),表明Hsp83参与了蠋蝽对UV-B胁迫的响应,这与烟蚜在不同时间UV-B暴露下Hsp70的表达结果(苏丽等, 2018)相似。在UV-B处理12 h时,雌雄成虫AcHsp83a和雌成虫AcHsp83b表达量显著下降(图6),可能是UV-B辐射造成的损伤超过了Hsp83的保护限度,该结果与轮虫Brachionussp. Hsp基因研究结果(Kimetal., 2011)相似。本研究中,蠋蝽AcHsp83a和AcHsp83b虽然同属于Hsp90家族,但在蠋蝽不同发育阶段及不同组织中的表达模式不同,对环境胁迫的应答反应也有所不同,这可能与其编码蛋白的结构域差异有关,有待于下一步深入研究(Biebe and Buchner, 2019)。此外,在昆虫应对环境胁迫时,并非体内某一热激蛋白起作用,而是由不同的家族蛋白协同作用,小分子热激蛋白作为昆虫抵御外界胁迫的第一道防线(李慧等, 2018),如何与Hsp90家族协作抵御胁迫还需更深入的研究。
蠋蝽是一种捕食范围广、适应能力强、繁殖快的优势天敌昆虫,对农业害虫绿色防控具有重要意义。由于近年来气候变暖和臭氧层空洞,蠋蝽野外生存环境恶劣,影响蠋蝽的田间活动。本研究检测了蠋蝽AcHsp83a和AcHsp83b在高温、低温和UV-B胁迫下的表达量,揭示了其响应温度和UV-B胁迫的分子机制,为进一步完善蠋蝽的田间应用提供参考。
猜你喜欢
杂志排行
昆虫学报的其它文章
- 基于转录组数据的中华按蚊细胞色素P450超家族基因不同发育阶段、成蚊不同组织和吸血前后不同时期雌成蚊的表达模式分析
- 狄斯瓦螨VdesNPC2b蛋白的基因克隆、原核表达及其与寄主幼虫信息素结合机制研究
- 亚洲玉米螟对球孢白僵菌分生孢子和芽生孢子-玉米共生体的取食选择和嗅觉反应
- 紫外线辐照被寄生的黑腹果蝇蛹对果蝇锤角细蜂生长发育的影响
- Response of heat inducible heat shock protein 90 gene of Aphis gossypii (Hemiptera: Aphididae) to gossypol and flupyradifurone stresses and mutual effect on transcription factor HSF
- 蜜蜂衰老与寿命调控研究进展
