不同非酿酒酵母与酿酒酵母顺序发酵对茵红李果酒风味的影响
2024-01-03李静雅
李 甜,雷 雨,李 东,李静雅,金 磊
(四川轻化工大学生物工程学院,四川 宜宾 644005)
茵红李(Prunus salicinaLindl.)是李属中的一个优良品种,主要分布在中国四川宜宾和卧龙等地,其质地嫩脆化渣、口感酸甜适中、营养价值高等优点广受消费者青睐[1]。随着茵红李的栽培面积扩大和产量提高,导致茵红李不能及时销售而造成大量浪费。目前,果酒是水果精深加工的主要方向之一,将茵红李加工生产为果酒,不仅能保留茵红李的风味,而且在发酵过程中形成多种活性物质和风味物质。有助于提高茵红李的经济价值[2]。然而,由于缺乏专用酵母,李子果酒的风味单一且同质化严重[3],降低了其在果酒市场上的竞争力。
香气化合物在决定果酒的质量和可接受性方面起着至关重要的作用[4]。果酒香气受不同因素的影响,而微生物发酵是影响果酒香气的主要因素之一[5]。在果酒发酵过程中,酿酒酵母(Saccharomyces cerevisiae)主要是将糖类物质转化为乙醇,并产生少量的风味物质。而非酿酒酵母合成一些较高活性的酶类,可将原料中的非挥发性前体物质转化为酯类、高级醇类等香气化合物[6],提高挥发性化合物的气味活性值[7-8],改变酸类物质含量[9]和降低不良气味活性化合物含量[10]。近年来研究表明,不同种类的非酿酒酵母参与果酒混菌发酵产生的风味物质也不相同,克鲁维毕赤酵母(Pichia kluyveri)与酿酒酵母混菌发酵有利于异戊丁酸乙酯、乙酸异戊酯等香气物质的合成,使果酒的果香和花香味更加浓郁[11-12]。汉逊酵母属(Hanseniaspora)与酿酒酵母混菌发酵产更高水平的果味乙酸酯,如2-苯基乙基乙酸酯和乙酸异戊酯[13]。异常威克汉姆酵母(Wickerhamomyces anomalus)与酿酒酵母发酵葡萄酒产更高水平的乙酯和乙酸酯,赋予葡萄酒适宜的果香和花香味[14]。而戴尔有孢圆酵母(Torulaspora delbrueckii)则会产生更高含量的有益化合物,如2-苯基乙基乙酸酯和乳酸乙酯[15]。此外,果酒混菌发酵的方式包括同时发酵和顺序发酵。相比于同时发酵,顺序发酵能延长非酿酒酵母在发酵体系中的存活时间,进而产生更多的甘油和挥发性风味物质[16],降低脂肪酸含量[17],进而更有效地改善果酒的感官品质,并缩短发酵周期[18]。因此,顺序发酵是非酿酒酵母混菌发酵的较好接种方式。目前,混合发酵在葡萄酒领域得到了广泛研究,但对于李子酒的研究则相对较少[18]。因此,有必要筛选出适宜的非酿酒酵母,用其与酿酒酵母进行混合发酵,以提高茵红李果酒的品质。
本研究以宜宾茵红李为原料,选用6 株本实验室筛选出的非酿酒酵母(包括异常威克汉姆酵母1 株Wa3,葡萄汁有孢汉逊酵母(H.uvarum)1 株Hu12,克鲁维毕赤酵母3 株Pk2A2、PkW2、PkY2,季也蒙毕赤酵母属(P.guilliermondii)1 株Pg1),与商业酿酒酵母FX10进行顺序混合发酵,同时以酿酒酵母FX10发酵作对照。对不同非酿酒酵母混菌发酵过程中生长状况进行评估,并对茵红李果酒的理化性质、有机酸、香气成分及感官特性进行比较分析。研究将有助于筛选出为茵红李果酒增香的最优酵母组合,为提升茵红李果酒品质提供理论参考。
1 材料与方法
1.1 材料与试剂
茵红李原料于2022年8月购自中国四川宜宾,挑选成熟、无病害的茵红李用于果酒发酵。经检测其pH 3.42,可溶性固形物为11.6 °Brix,总酸(以苹果酸计)为5.01 g/L,还原糖为6.07 g/100 mL。
异常威克汉姆酵母(Wa3)、葡萄汁有孢汉逊酵母(Hu12)、克鲁维毕赤酵母(Pk2A2、PkW2和PkY2)和季也蒙毕赤酵母(Pg1)为四川轻化工大学生物工程学院农畜产品精深加工实验室2022年经从水果自然发酵汁中分离、纯化得到的自选酵母,使用前均已鉴定。商业酿酒酵母FX10购自法国LAFFORT公司。
仲辛醇、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸、酒石酸(均为色谱纯)成都德思特生物技术有限公司;氢氧化钠、氯化钠、无水葡萄糖(均为分析纯)成都科隆化学品有限公司;甘油G K 法检测试剂盒(70 assays)北京海富达科技有限公司;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基青岛高科技工业园海博生物技术有限公司;WL营养琼脂培养基 北京陆桥技术股份有限公司。
1.2 仪器与设备
LB80T手持糖度计 广东省速为电子科技有限公司;HT512ATC高精度酒精计 深圳市巴里世纪贸易有限公司;N5000PLUS紫外-可见分光光度计 上海佑科仪器仪表有限公司;TSQ8000气相色谱-质谱联用仪 美国赛默飞公司;1260infinity I高效液相色谱仪 美国安捷伦公司;UitraScan VIS色差仪 美国Hunter Lab公司。
1.3 方法
1.3.1 实验处理
酵母活化与计数:将保藏菌株接种于YPD固体培养基上,26 ℃培养24 h,再将YPD固体培养基上的单菌落接种于300 mL YPD液体培养基中,28 ℃、200 r/min振荡培养24 h。将培养液在5 000 r/min离心5 min并用无菌生理盐水洗涤干净。将酵母菌悬液为108CFU/mL(显微镜观察)加入发酵。在发酵0、1、2、3、4、5、6、7、8、9 d和10 d分别取样并涂布在WL培养基上。通过观察酿酒酵母FX10(淡绿奶油状凸起)、异常威克汉姆酵母(白色褶皱凸起)、葡萄汁有孢汉逊酵母(深绿色光滑)、克鲁维毕赤酵母(白色扁平褶皱)、季也蒙毕赤酵母属(乳白光滑奶油凸起)在WL培养基上的菌落形态的差异,进行活细胞计数[19]。
对照组:接种量约为106CFU/mL的酿酒酵母FX10。
实验组:先分别接种106CFU/mL的异常威克汉姆酵母Wa3、葡萄汁有孢汉逊酵母Hu12、克鲁维毕赤酵母Pk2A2、克鲁维毕赤酵母PkW2、克鲁维毕赤酵母PkY2和季也蒙毕赤酵母Pg1,在24 h后以1∶1的接种比例接种106CFU/mL的酿酒酵母FX10,分别简称为Wa3-FX10、Hu12-FX10、Pk2A2-FX10、PkW2-FX10、PkY2-FX10、Pg1-FX10。
茵红李果酒发酵工艺:茵红李→清洗去核打浆酶解(加入0.1 g/L焦亚硫酸钾和0.03 g/L果胶酶酶解2 h)→用白砂糖将糖度调整到23 °Brix→浆汁分装于10 L可取样发酵罐中→75 ℃水浴巴氏杀菌30 min→冷却后接种不同处理组酵母→26 ℃下进行发酵直至主发酵结束(连续3 d发酵罐质量减少在1 g以内)→放于10 ℃恒温箱中进行后发酵1 周(促进酒体的澄清和成熟)→再将发酵液10 000 r/min离心10 min除去酵母细胞,贮藏在4 ℃冰箱→陈酿1 个月后对其理化指标、有机酸、香气成分以及感官特性进行分析。所有处理一式三份进行。
1.3.2 理化测定
乙醇体积分数、pH 值、挥发酸测定参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》[20];总酸(以苹果酸计)测定参考GB/T 12456—2021《食品中总酸的测定》酸碱指示剂滴定法[21];总酚测定参考T/AHFIA 005—2018《植物提取物及其制品中总多酚含量的测定》分光光度法[22];还原糖测定参考GB/T 5009.7—2016《食品中还原糖的测定》直接滴定法[23];甘油测定使用甘油GK法检测试剂盒;色差使用色差仪进行测定。
1.3.3 有机酸
取5 mL原酒液临用前经0.22 μm滤膜过滤后进样分析。参照段云飞等[24]有机酸测定方法,采用高效液相色谱(high performance liquid chromatography,HPLC)进行有机酸含量的测定。色谱条件:Agilent ZORBAX SB-Aq色谱柱(4.6 mm×250 mm,5 μm),检测波长210 nm,流动相为磷酸二氢钾(pH 2.4)100%,进样量15 μL,流速0.4 mL/min,柱温25 ℃。
1.3.4 挥发性风味成分测定
参考Liu Chunfeng等[7]的方法,采用顶空固相微萃取-气相色谱-质谱联用技术进行测定。吸取5 mL茵红李果酒于20 mL顶空瓶中,再加入1.4 g氯化钠和无水乙醇稀释过的10 mL/L仲辛醇溶液1 μL作为内标,于45 ℃平衡15 min,再萃取30 min。取出插入气相色谱柱的进样口解吸附7 min,解吸温度为210 ℃。
色谱条件:毛细管柱为DB-WAX(60 m×0.25 mm,0.25 μm)。载气为高纯氦气,恒定流速1 mL/min,进样口温度250 ℃,不分流进样模式。柱温箱采用程序升温,起始温度40 ℃,保持2 min,以5 ℃/min升到120 ℃,保持2 min,再以7 ℃/min升到220 ℃,保持5 min,运行时间39 min。
质谱条件:电子轰击能量为70eV;接口温度220 ℃,离子源温度250 ℃,四极杆温度150 ℃,扫描质量范围m/z35~500,扫描频率3.6 scans/s。
气味活性值(odor activity value,OAV)是指某种化合物的浓度与该化合物在该试剂中可察觉的阈值之比。
1.3.5 感官评价
参考张文文等[25]研究略作修改,由8 名经验丰富的品评员(4 名女性和4 名男性,年龄在20~36 岁之间)使用定量描述性分析进行感官评估。在正式评估之前,举行了2 次会议。首先,品评员在评估后分别写下有关香气特征的词汇,并选择重复的词汇(2 次以上)进行进一步分析。接下来,品评员讨论了最终的香气描述并达成共识。选择并量化了6 种感官属性,包括花果香味、酸味、甜味、乙醇、平衡感和整体可接受性。在正式的感官分析期间,评估员获得了10 mL单个样品,这些样品在(20±2)℃下分别呈递在20 mL透明杯中。此外,每个样本都用3 个随机数编码,并按随机顺序放在表格上。最后,对指定的茵红李果酒6 个等级打分,分别是0~5代表由弱到强。
1.4 数据处理
采用SPSS 26.0进行单因素方差分析和Duncan多重比较分析检验,P<0.05,差异显著,数据以形式呈现。采用Origin 2021进行主成分分析(principal component analysis,PCA)图、折线图和雷达图的制作。
2 结果与分析
2.1 酵母发酵动力学与乙醇生成动力学
在果酒发酵过程中,酵母的数量和种群动态变化与风味的形成和变化密切相关[26]。不同酵母组合和酿酒酵母发酵过程中酵母生长情况和乙醇体积分数的变化如图1所示。在对照组中,酵母生物量在发酵2~5 d维持在较高水平,约为7.5(lg(CFU/mL)),随后菌体量缓慢下降,在10 d酵母的生物量为6.04(lg(CFU/mL))。然而,在混菌发酵中,尽管酿酒酵母以相同的初始接种浓度进行发酵,但其最大生物量下降了4.4%~9.1%。这一结果与Liu Chunfeng等[7]发现混菌发酵中酿酒酵母的最大生物量会下降保持一致。此外,在混菌发酵中,非酿酒酵母主要在发酵前期发挥作用,6 d未检测到Hu12的活细胞,7 d未检测到Wa3、PkY2和Pg1的活细胞,8 d未检测到PkW2和Pk2A2的活细胞。表明在混合发酵中,非酿酒酵母和酿酒酵母的生长均受到一定程度的抑制。这种抑制可能是由于乙醇含量逐渐增加、溶氧量逐渐降低以及酵母菌之间的相互作用等多种因素导致[27]。通过对乙醇体积分数的监测发现,酿酒酵母FX10在发酵前5 d乙醇体积分数的增长速率最快,在5~10 d乙醇体积分数基本维持稳定,在10 d乙醇体积分数为11.85%。然而,在混合发酵中,乙醇体积分数的增长速度相对较慢,在发酵10 d乙醇体积分数为9.89%~10.94%。可能是非酿酒酵母加入混菌发酵,降低了酿酒酵母最大生物量,进而使产生的乙醇体积分数降低。
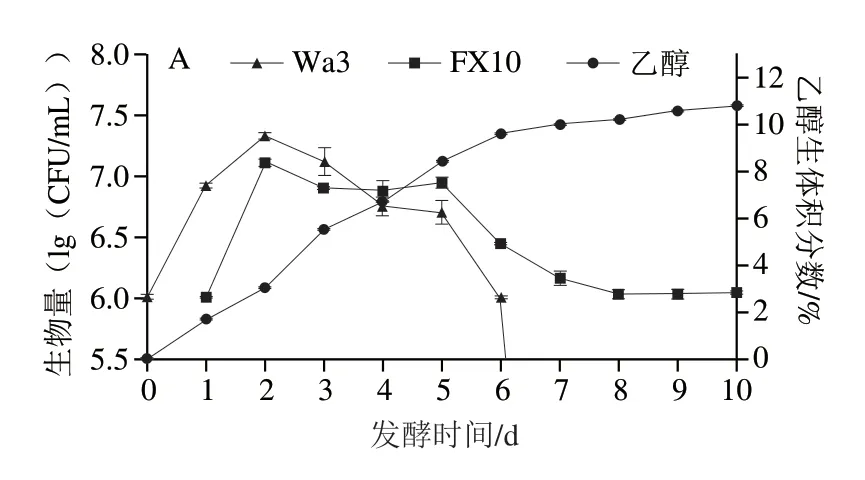
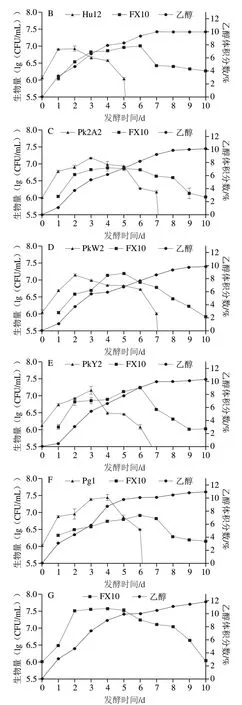
图1 非酿酒酵母和酿酒酵母的生物量与乙醇生成量动态变化Fig.1 Dynamic changes in yeast biomass and alcohol production of non-Saccharomyces and S.cerevisiae during plum wine fermentation
2.2 基本理化指标
如表1所示,混菌发酵的茵红李果酒乙醇体积分数范围为10.93%~11.66%,显著低于酿酒酵母FX10发酵果酒中的乙醇体积分数12.2%。而混菌发酵果酒中还原糖质量浓度范围为1.95~2.75 g/L,高于酿酒酵母FX10发酵果酒中的还原糖1.88 g/L。甘油可以使果酒的口感更加圆润,同时带有微甜的味道。各混菌发酵酒中的甘油质量浓度范围为6.85~7.22 g/L,均高于酿酒酵母FX10发酵6.65 g/L,其中PkY2-FX10发酵酒中甘油含量最多,这与Benito等[16]报道克鲁维毕赤酵母参与顺序发酵可以增加甘油含量的结果一致。可以推测,混菌发酵中乙醇含量减少的原因可能是酵母菌株受到抑制导致糖代谢受阻,也可能是糖代谢过程中使更多的糖类物质转化为甘油等其他物质[28]。

表1 不同酵母组合发酵茵红李果酒的理化特性Table 1 Physicochemical properties of Yinhong plum wines producing using different fermentation strategies
在长时间的贮藏过程中,果酒的pH值可能会影响其色泽。较低的pH值会导致游离花青素含量减少,而较高的pH值将导致果酒发生褐变[29]。本实验测得的果酒pH值介于3.16~3.35之间。果酒的酸度是评估其独特纯净和清爽特性的重要参数[30]。Pk2A2-FX10、PkW2-FX10和PkY2-FX10发酵酒中总酸含量显著高于其他发酵酒,与张文静等[11]报道克鲁维毕赤酵母具有增加总酸含量的结果一致。Wa3-FX10发酵酒中产生的挥发酸最高为0.76 g/L,其次是Pk2A2-FX10、PkW2-FX10和PkY2-FX10。然而,挥发酸含量过高可能会给果酒带来负面影响[31],但本实验结果均在GB 15037—2006规定范围内(挥发酸<1.2 g/L)。
酚类化合物是果酒中的天然抗氧化剂,对色泽、香气、涩味和苦味等感官品质起关键作用[32]。本研究发现Wa3-FX10和PkW2-FX10发酵的茵红李果酒中总酚含量显著高于酿酒酵母FX10发酵的茵红李酒。此外,之前报道也指出,异常威克汉姆酵母和酿酒酵母发酵能显著增加果酒中的多酚产量[30]。在混菌发酵中,除Pk2A2-FX10和PkW2-FX10发酵酒外,其他酒的ΔE*值高于酿酒酵母FX10发酵的茵红李酒。
2.3 有机酸
有机酸对果酒的感官特性和品质起着十分重要的作用[33]。如表2所示,茵红李果酒中苹果酸占有机酸中的比例最高,发酵茵红李果酒中苹果酸质量浓度在3.16~4.99 g/L之间,显著低于茵红李果汁(6.84 g/L)。特别是Hu12-FX10发酵后的茵红李果酒中苹果酸含量最低,表明葡萄汁有孢汉逊酵母可能具有降解苹果酸的能力,这结果与白玉峰等[34]发现葡萄汁有孢汉逊酵母能降低苹果酸含量的结果一致。而Wa3-FX10发酵酒中乙酸和琥珀酸的含量最高,大量的乙酸具有醋酸味,而琥珀酸具有“盐-苦-酸”的味道,可能给果酒带来令人不愉悦的味道。与对照相比,混菌发酵的乳酸质量浓度降低了0.12~1.07 g/L,但乙酸质量浓度增加了0.14~0.91 g/L。其中Wa3-FX10发酵茵红李果酒中乙酸质量浓度最高1.16 g/L,为酿酒酵母FX10的4.64 倍。乙酸含量的增加可能是不同种类酵母混合在一起进行发酵时,它们之间会相互抑制对方的生长和代谢,从而导致了不利条件的形成,促使了乙酸的产生增加[30]。

表2 茵红李果酒和果汁中有机酸质量浓度Table 2 Organic acid concentrations in Yinhong plum wines and juice g/L
2.4 挥发性风味分析
香气是影响果酒品质的重要特征之一,尤其是酯类、高级醇和挥发性脂肪酸等挥发性风味物质对果酒的次级香气具有显著影响[35]。本研究采用顶空固相微萃取-气相色谱-质谱联用技术,在茵红李果酒和果汁中共检测到43 种挥发性风味物质,包括酯类18 种、高级醇类12 种、挥发性脂肪酸类5 种和其他类物质8 种,结果如表3所示。不同发酵酒中挥发性风味物质的组成和含量存在差异,在Wa3-FX10、Hu12-FX10、Pk2A2-FX10、PkW2-FX10、PkY2-FX10、Pg1-FX10和FX10发酵酒中分别检测到32、31、35、35、34、34 种和33 种挥发性风味物质。其总量分别为5.683、5.715、6.033、7.734、7.961、3.790 mg/L和3.775 mg/L。而茵红李果汁中检测到28 种挥发性风味物质,总量为0.733 mg/L。果汁中含有较多的醛类香味物质,而经过发酵后,酯类、高级醇类及挥发性脂肪酸化合物的含量显著提高,表明发酵过程增加了挥发性风味物质的种类和含量。
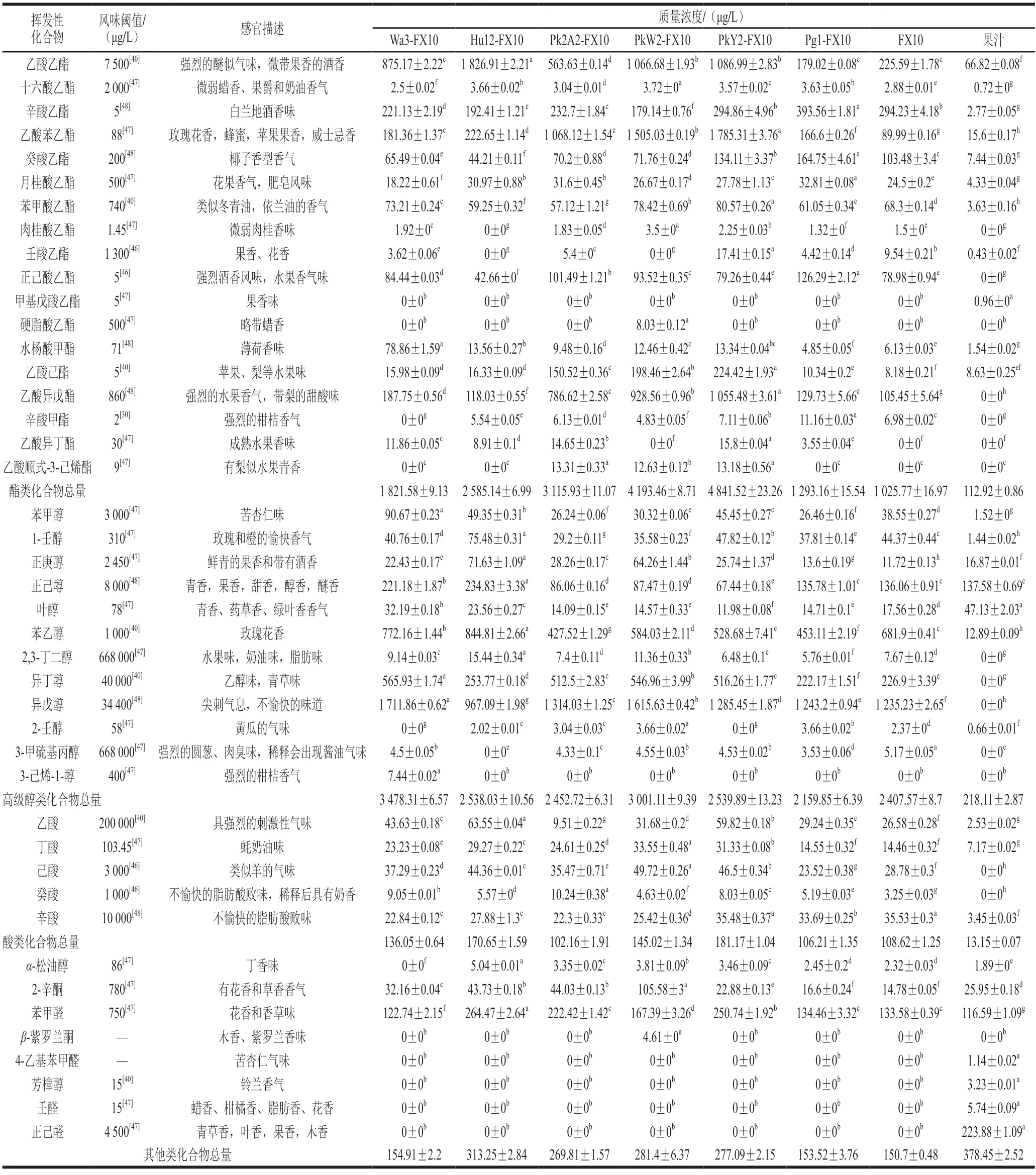
表3 茵红李果酒和果汁中挥发性化合物浓度Table 3 Concentrations of volatile compounds in Yinhong plum wine and juice
酯类化合物是果酒中的重要香气化合物之一,主要包括乙酯和乙酸酯类,对果酒的主体香气具有重要影响[36]。在检测到的18 种酯类化合物中,Wa3-FX10、Hu12-FX10、Pk2A2-FX10、PkW2-FX10、PkY2-FX10、Pg1-FX10和FX10发酵茵红李果酒中分别有6、5、8、7、8、5 种和6 种为气味活性化合物(OAV>1)。其中辛酸乙酯、乙酸苯乙酯、正己酸乙酯、乙酸己酯是7 种发酵酒中共有的气味活性化合物(OAV>1),这些化合物是茵红李果酒的特征风味物质。混菌发酵茵红李果酒中酯类化合物的总量(1.293~4.842 mg/L)显著高于对照组FX10(1.026 mg/L)。尤其是乙酸苯乙酯、乙酸己酯和乙酸异戊酯的含量显著提高,表明混菌发酵有利于乙酸酯的形成。这与之前的研究结果一致[37]。另外,PkY2-FX10发酵的茵红李果酒中酯类化合物总量最高,为对照菌株FX10的4.72 倍。其次是Pk2A2-FX10和PkW2-FX10发酵的茵红李果酒,它们的酯类含量分别为对照组的4.09 倍和3.04 倍。这可能与克鲁维毕赤酵母具有较高的酯酶活性有关[38]。在PkY2-FX10、Pk2A2-FX10和PkW2-FX10发酵的茵红李果酒中,乙酸苯乙酯、乙酸己酯、乙酸异戊酯和乙酸顺式-3-己烯酯质量浓度显著高于其他混菌发酵组合。乙酸顺式-3-己烯酯仅在克鲁维毕赤酵母参与发酵的酒中检测到,这可为茵红李果酒带来梨样的水果香。乙酸苯乙酯的OAV在12.14~20.29之间,可为茵红李果酒带来玫瑰花香和苹果果香[39]。此外,乙酸己酯具有较高的OAV,在30.11~44.89之间,可赋予茵红李果带来苹果、梨等水果香味[40]。Wa3-FX10产水杨酸甲酯质量浓度最高,为0.079 mg/L,超过了其阈值0.071 mg/L,可赋予果酒淡淡的薄荷清香味[41]。乙酸乙酯是果酒中最重要的酯类化合物,由乙醇和乙酸脱水反应而成。在较低质量浓度水平(<50 mg/L)下,它具有令人愉悦的果香[42]。Hu12-FX10发酵的茵红李果酒中乙酸乙酯质量浓度最高,为1.82 mg/L,也有研究报道,葡萄汁有孢汉逊酵母与酿酒酵母混菌发酵会产生较多的乙酸乙酯[43]。
高级醇是由微生物通过Ehrlich途径将相应氨基酸转化或将糖类物质分解产生的一类化合物[44]。高级醇是愉悦酯类化合物的前体物,当高级醇总质量浓度低于300 mg/L时,可以促进果酒的风味复杂性[7]。在本实验中,除Pg1-FX10发酵酒中高级醇总量(2.160 mg/L)低于对照FX10(2.408 mg/L)外,其余混菌发酵酒样中高级醇总量均高于对照。特别是Wa3-FX10质量浓度(3.478 mg/L)最高。高级醇中1-壬醇、苯乙醇和苯甲醇在果汁含量较少,经发酵成果酒后,它们的含量显著增加。均在Hu12-FX10发酵酒中含量最高,其中1-壬醇和苯乙醇可以为茵红李果酒带来蜂蜜、玫瑰等宜人香气,而苯甲醇会给果酒带来苦杏仁味。叶醇具有青香、药草香、绿叶香香气[40]。叶醇在果汁中质量浓度(0.047 mg/L)显著高于其他发酵酒(0.012~0.032 mg/L),说明经发酵后的酒样能明显降低果汁中的青草香气。
挥发性脂肪酸是果酒香气复杂性和香气平衡性的重要挥发性化合物[45]。然而,当挥发性脂肪酸的总质量浓度低于20 mg/L时,可赋予果酒丰富的果味[43]。在本研究中,发酵的茵红李果酒中共有5 种挥发性酸类化合物,包括乙酸、丁酸、己酸、癸酸和辛酸。这些化合物的总量范围为0.102~0.181 mg/L,均未超过于20 mg/L。在混菌发酵酒中,除Pg1-FX10和Pk2A2-FX10发酵酒中挥发性酸类物质总量略低于对照FX10外,其余混菌发酵酒样中挥发性酸类物质总量范围为0.136~0.181 mg/L,均高于对照(0.082 mg/L)。值得注意的是,乙酸、丁酸和辛酸是李子中本身存在的挥发性酸,经发酵后,各种挥发性脂肪酸类化合物的含量均显著提高。乙酸具有尖锐的酸味,而辛酸、己酸和癸酸均有不愉快的气味,如山羊臭、奶酪香和脂肪臭。然而,由于这些酸类化合物均具有极高的阈值[46],它们不会给果酒带来不良影响。另外,与酿酒酵母FX10相比,混菌发酵酒中辛酸的含量有所降低。这与张曼[40]在其研究中所得到的混菌发酵脆红李果酒中辛酸含量降低的结果一致。
除了主要的酯类、高级醇类和挥发性脂肪酸类化合物外,部分醛、酮和萜烯类化合物对果酒的香气产生一定的影响。在混菌发酵茵红李果酒中,2-辛酮质量浓度(0.017~0.106 mg/L)显著高于酿酒酵母发酵0.015 mg/L。混菌发酵酒中苯甲醛质量浓度(0.123~0.264 mg/L)也高于对照0.117 mg/L。2-辛酮具有花香和草香香气,苯甲醛具有花香和香草等特殊气味,有利于提高果酒风味的复杂性。另外,仅在茵红李果汁中检测到了4-乙基苯甲醛、芳樟醇、壬醛和正己醛,这表明它们是茵红李独特的品种香气成分。
2.5 PCA
一般认为OAV>1的化合物对果酒的香气贡献较为显著,而OAV>0.1的化合物可能表现出协同作用,有助于果酒的风味[49]。因此,本实验对OAV>0.1的20 种香气化合物进行PCA,结果如图2所示。PCA解释了累计贡献率的67.6%,PC1和PC2分别占总差异的48.7%和18.9%。可以看出,发酵过程中不同酵母组合可以产生独特的气味活性化合物,从而在茵红李果酒中产生不同的风味特征。Pk2A2-FX10、PkW2-FX10和PkY2-FX10与乙酸己酯、乙酸苯乙酯、乙酸异戊酯、辛酸乙酯、肉桂酸乙酯、乙酸异丁酯和乙酸顺式-3-己烯酯7 种香气化合物聚集在右上角。这些酵母组合与对照组差异显著,表明克鲁维毕赤酵母与酿酒酵母的混菌发可以显著影响茵红李果酒的风味。Wa3-FX10位于PC2负轴上,FX10位于左下角,而Pg1-FX10和Hu12-FX10则位于右下角,这4 种酵母组合距离较近,说明这3株非酿酒酵母与酿酒酵母混菌发酵对果酒的风味影响不显著。另外,果汁样品的位置位于PC1的左上角,与壬醛、甲基戊酸乙酯和芳樟醇密切相关。
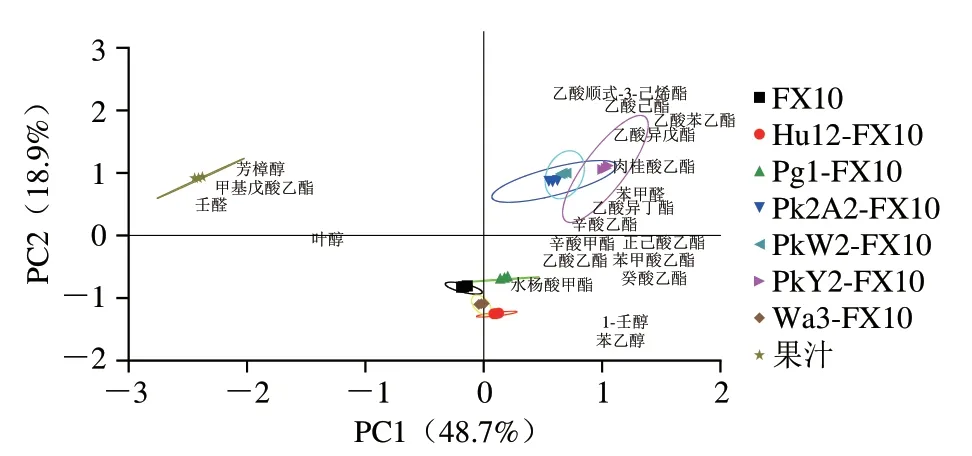
图2 发酵结束后茵红李果酒中OAV>0.1的香气化合物PCAFig.2 PCA plot of aroma compounds with OAV >0.1 in Yinghong plum wines and juice
2.6 感官分析
采用定量描述性分析对茵红李果酒样品进行感官评定,结果如图3所示。与对照组相比,混菌发酵产生的乙醇味相对较弱,这与混菌发酵降低了其乙醇体积分数相关。此外,最突出的花果香味主要在PkY2-FX10发酵液中发现,其次是Pk2A2-FX10和PkW2-FX10,这主要与它们产生大量酯类气味活性化合物相关。Wa3-FX10和Hu12-FX10发酵酒中酸味比较明显,可能与它们产生较多的乙酸相关。此外,虽然PkY2-FX10、Pk2A2-FX10和PkW2-FX10的总酸含量高于其他发酵组,但它们的酸味强度显著降低(P<0.05)。这可能是因为更高的甜味和酯类化合物掩盖了尖锐的乙酸酸味。总体而言,PkY2-FX10、Pk2A2-FX10和PkW2-FX10发酵的茵红李果酒在花果香味、整体可接受性和平衡感方面均具有较高的评分,这表明克鲁维毕赤酵母与酿酒酵母混菌发酵对茵红李果酒香气和品质具有积极影响。
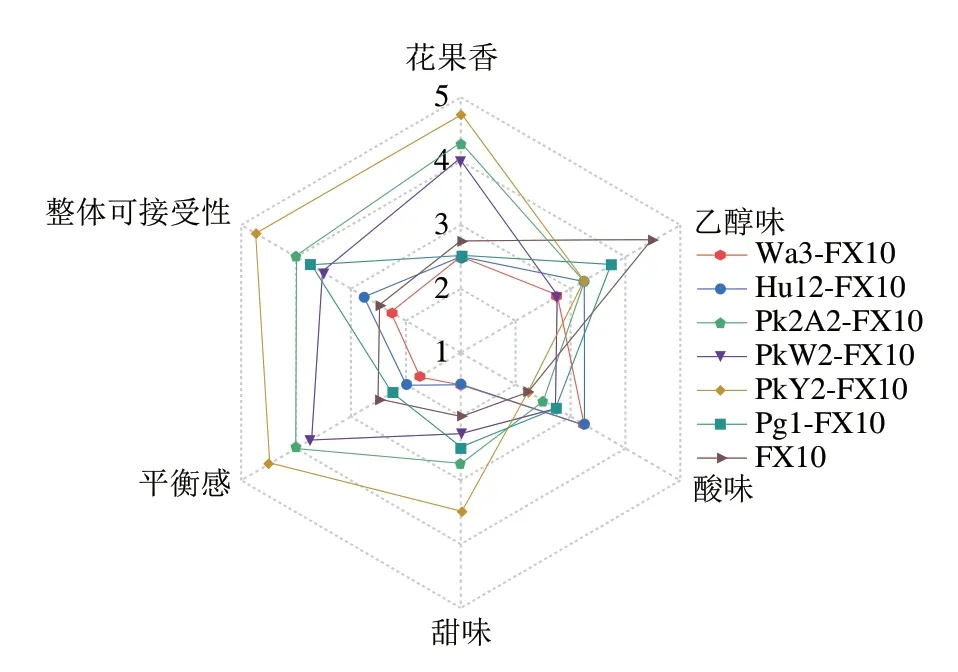
图3 采用定量描述性分析对茵红李果酒样品进行感官评定结果Fig.3 Sensory evaluation results of Yinhong plum wine samples by quantitative descriptive analysis
3 结论
实验分析了不同非酿酒酵母与酿酒酵母顺序发酵对茵红李果酒风味品质的影响。结果表明,混菌发酵中,酿酒酵母与非酿酒酵母均受到了一定程度的抑制作用,而非酿酒酵母主要在发酵初期发挥作用,6~8 d出现死亡现象。发酵组中茵红李果酒中的各项理化指标存在差异。与酿酒酵母FX10相比,混菌发酵的茵红李果酒中甘油产量提高,乳酸含量、乙醇含量和对还原糖的消耗降低。在风味成分方面,通过气相色谱-质谱共检测到43 种挥发性风味物质,茵红李果酒中主要以酯类和高级醇类化合物为主。其中辛酸乙酯、乙酸苯乙酯、正己酸乙酯、乙酸己酯被确认为茵红李果酒的特征风味物质。与酿酒酵母FX10相比,混菌发酵的酯类化合物含量均显著提高。其中,PkY2-FX10发酵的茵红李果酒中酯类含量最高,为对照组的4.72 倍。其次是Pk2A2-FX10和PkW2-FX10发酵,酯类含量分别为对照组的4.09 倍和3.04 倍。PCA显示,Pk2A2-FX10、PkW2-FX10和PkY2-FX10与辛酸乙酯、乙酸异戊酯、乙酸苯乙酯、乙酸己酯、肉桂酸乙酯、乙酸顺式-3-己烯酯和乙酸异戊酯7 种香气化合物紧密相关,这些化合物显著提升了茵红李果酒中的花果香味。综上,将克鲁维毕赤酵母和酿酒酵母顺序发酵是提高茵红李果酒香气成分的最佳酵母组合,但其增加茵红李果酒香气成分的机理仍需进一步研究。
