植物乳杆菌HB13-2抑制白假丝酵母菌作用及机制
2024-01-03宁亚维张东春张雅娟司海山康亚朋王志新王世杰
宁亚维,孙 颖,张东春,张雅娟,司海山,康亚朋,王志新,王世杰
(河北科技大学食品与生物学院,河北 石家庄 050018)
白假丝酵母菌是一种条件致病菌,通常存在于正常人口腔黏膜、上呼吸道、肠道及阴道,当机体免疫功能下降或菌群失调时则大量繁殖侵入细胞引起疾病。在口腔中白假丝酵母菌感染可引起鹅口疮[1],还会感染口腔黏膜炎病变,导致口咽黏膜炎症[2],并且与龋齿、牙周炎等口腔疾病也密切相关[3]。白假丝酵母菌生物膜的形成是导致和加深口腔疾病的重要原因,因为与浮游细胞相比生物被膜细胞具有更大的耐药性,并且能更加持久的黏附在牙齿或口腔黏膜表面。在口腔中白假丝酵母菌可以与口腔致病菌形成混合生物膜并互相利用,例如与致龋菌变异链球菌的相互作用可以增强细菌-真菌的结合,使得形成的双物种生物膜具有更大的三维复杂性,增加抵抗应激条件的能力,同时增强变异链球菌生物膜的致龋性[4-5];白假丝酵母菌与牙菌斑形成相关的口腔链球菌协同可以增加彼此的数量,口腔链球菌还能促进白假丝酵母菌菌丝的形成;白假丝酵母菌与牙周炎致病菌伴放线放线杆菌聚集杆菌也具有协同的作用,可明显增强毒力从而破坏牙周组织[6]。
目前对口腔念珠病感染的治疗方法包括使用抗真菌药物、天然植物衍生物、光动力疗法等,其中对于治疗白假丝酵母菌常用的抗生素类药物包括氟康唑、两性霉素B等。近年来抗真菌药物的大量使用使越来越多的耐药菌株出现并传播[7]。为了应对白假丝酵母对抗生素的耐药性,目前运用植物中提取的化合物替代传统药物得到广泛研究。研究较多的植物衍生物包括提取物、精油、萜烯、生物碱、黄酮类化合物、多酚、凝集素等[8]。光动力疗法主要是利用光敏剂被光源激活并与氧气反应,导致细胞死亡,对耐药性白假丝酵母也具有效果,但这种疗法更适用于深度感染且有术后不良反应[9-10]。
白假丝酵母菌数量的增加会引起多种口腔疾病,造成口腔菌群失衡,细菌与白假丝酵母的特定相互作用可以促进其向致病菌的转变。因此对于口腔疾病,调节菌群失衡的防治手段对维护口腔环境健康十分重要。近几年益生菌在口腔中的使用和研究越来越受到关注,在各项研究中均表明常见的几种乳酸菌如鼠李糖乳杆菌、干酪乳杆菌、嗜酸乳杆菌等对白假丝酵母菌在口腔中的发展均有抑制作用[11-12]。而益生菌的作用机制也多种多样,其中包括通过黏附竞争、产生有机酸、细菌素、生物表面活性剂等抑制病原体[13-14]。因此选取实验室前期筛选出的对口腔致病菌具有较好抑制作用的植物乳杆菌HB13-2,研究其对白假丝酵母菌的细胞壁、细胞膜、跨膜电势、微观结构、活性氧(reactive oxygen species,ROS)积累以及线粒体膜电位方面影响,分析植物乳杆菌HB13-2上清液对菌体的抑菌作用机制,旨在为植物乳杆菌HB13-2作为口腔益生菌开发提供科学依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌HB13-2分离自农家自制酸菜,白假丝酵母菌ATCC10231由河北科技大学食品生物技术与安全实验室保藏。
无水乙醇、戊二醛、乙酸异戊酯、异丙醇 天津永大化学试剂公司;Hepes 北京科博生物技术有限公司;Nigericin、Valinomycin、DiSC3(5)、罗丹明-123、2,′7′-二氯二氢荧光素二乙酸酯(2′,7′-dichlorodihydrofluo rescein diacetate,DCFH-DA)、荧光增白剂(calcofluor white,CFW)荧光染料 美国Sigma公司;碘化丙啶(propidium iodine,PI)、SYTO-9 美国Thermo Fisher公司。
1.2 仪器与设备
YXQ-LS-5S立式蒸汽灭菌锅 上海博讯有限公司;3-18K高速冷冻离心机 德国Sigma公司;ZSD-A1160恒温培养箱 上海智诚分析仪器制造公司;BX53荧光显微镜 日本奥林巴斯株式会社;F-7000-FL 220荧光分光光度计、S-4800-1扫描电镜 日本日立公司;AccuriC6 Plus流式细胞仪 美国Becton Dickinson公司;Alpha 2-4 L Dplus冷冻干燥机 德国CHRIST公司。
1.3 方法
1.3.1 植物乳杆菌HB13-2上清液的制备
将植物乳杆菌HB13-2接种于MRS肉汤中于37 ℃恒温培养48 h。然后,将菌悬液8 000 r/min离心15 min,以使植物乳杆菌与上清液分离。取出上清液后在-40 ℃预冻12 h后置于冷冻干燥机30 h,将冻干后的上清液贮存在-40 ℃,实验进行前按照不同质量浓度制备上清液并经0.22 μm无菌滤膜过滤处理。
1.3.2 最小抑菌浓度(minimum inhibitory concentration,MIC)的测定
采用二倍稀释法测定植物乳杆菌HB13-2对白假丝酵母菌的MIC。将植物乳杆菌HB13-2上清液冻干配制成质量浓度为640 mg/mL的上清液,白假丝酵母菌用YPD调节浓度为106CFU/mL。在96 孔板中先加入100 μL YPD,再将质量浓度为400 mg/mL植物乳杆菌HB13-2上清液加入第1个孔中,吸打混匀后取100 μL加入第2个孔,依次重复,最终实验组终质量浓度100~5 mg/mL。以200 μL YPD作为阴性对照组,以白假丝酵母菌液与YPD各100 μL作为空白对照组。放入37 ℃培养箱24 h用光密度法观察,以被抑制的最低抑菌剂浓度作为MIC。
1.3.3 时间-抑菌曲线的测定
将白假丝酵母菌活化后培养至对数期,调节菌浓度为106CFU/mL,配制不同质量浓度的植物乳杆菌上清液与菌悬液等体积混合,使终质量浓度分别为1/2 MIC、MIC以及2 MIC,以不加入上清液作为空白对照。分别在0、2、4、6、8、10、12、24 h用平板计数法进行活菌数计数,并绘制时间-抑菌曲线。
1.3.4 细胞壁完整性的测定
用KOH 和CFW 染色检测上清液对白假丝酵母菌细胞壁的影响[15]。白假丝酵母菌悬液调整浓度为106CFU/mL,并在37 ℃与终质量浓度为1/2 MIC、MIC、2 MIC、4 MIC的植物乳杆菌上清液孵育6 h。8 000 r/min离心10 min后弃上清液,用0.85%生理盐水清洗菌体3 次后,将菌体取1 环放置在载玻片上,用10% KOH和0.1% CFW溶液染色,并用荧光显微镜观察,在每个质量浓度的处理组中至少选择3 个随机视野观察。
1.3.5 细胞膜完整性的测定
采用PI和SYTO-9染色法分析白假丝酵母菌细胞膜完整性[16]。将培养至对数生长期的白假丝酵母菌用0.85%生理盐水重复清洗3 次,重悬为浓度106CFU/mL的菌悬液,将用生理盐水配制的不同质量浓度植物乳杆菌上清液与菌悬液等体积混合,使上清液终质量浓度为1/2 MIC、MIC、2 MIC、4 MIC,未经过上清液处理的菌体作阴性对照,用70%异丙醇溶液处理的样品用作阳性对照,并在37 ℃恒温培养箱孵育6 h。离心后收集细胞,清洗3 次以去除上清液,重悬在生理盐水中,在黑暗条件下用2 μmol/L SYTO-9和12 μmol/L PI染色15 min。再次清洗3 次探针,重悬后用荧光显微镜观察,并用流式细胞仪分析。
1.3.6 细胞膜跨膜电势的测定
采用DiSC3(5)考察菌体细胞膜跨膜电势变化[17]。将培养至对数生长期的白假丝酵母菌用含有10 mmol/L葡萄糖的Hepes缓冲液(5 mmol/L)重复清洗3 次,重悬为浓度106CFU/mL的菌悬液,向菌液中加入DiSC3(5)使其终浓度为1 μmol/L,37 ℃避光孵育30 min,加入终浓度100 mmol/L KCl溶液。在比色皿中加入等体积菌悬液和不同质量浓度抑菌剂,使抑菌剂终质量浓度分别为1/2 MIC、MIC、2 MIC、4 MIC,以0.85%生理盐水作空白对照。以Valinomycin作为阴性对照,以Nigericin作为阳性对照(终浓度5 mmol/L),以Hepes缓冲液为空白对照组,用荧光分光光度计进行时间扫描,测定荧光强度变化(激发波长650 nm,发射波长672 nm)。
1.3.7 扫描电镜分析
收集对数期的白假丝酵母菌,清洗、重悬,调整菌浓度为106CFU/mL,将等体积菌悬液与不同质量浓度植物乳杆菌上清液混合作用6 h。离心,用0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)清洗菌体后,在4 ℃下用体积分数2.5%戊二醛溶液固定过夜。之后,样品经0.1 mol/L PBS清洗除去戊二醛,然后用乙醇(30%、50%、70%、85%、90%、100%)进行逐级梯度脱水,每次15 min,无水乙醇脱水2 次。最后用乙酸异戊酯将乙醇置换2 次,每次20 min,干燥后通过扫描电子显微镜观察。
1.3.8 细胞内ROS的测定
DCFH-DA用于测定白假丝酵母菌中细胞内ROS水平[18]。将培养至对数期的白假丝酵母菌用0.1 mol/L PBS清洗3 次,重悬在PBS中并将菌悬液浓度调节为106CFU/mL,将植物乳杆菌上清液与菌悬液等体积混合,使终质量浓度分别为1/2 MIC、MIC、2 MIC以及4 MIC,以不加上清液组为对照组,于37 ℃孵育6 h。然后,用PBS清洗细胞3 次以除去上清液,再重悬在1 mL的PBS中,加入DCFH-DA使其终浓度为10 μmol/L,避光孵育30 min。再次用PBS清洗探针3 次,以PBS为空白对照组并通过荧光分光光度计测定荧光强度(激发波长488 nm,发射波长520 nm)。
1.3.9 线粒体膜电位
采用罗丹明-123考察菌体线粒体膜电位的变化[19]。将培养至对数期的白假丝酵母菌用0.1 mol/L PBS清洗3 次,重悬在PBS中并将菌悬液浓度调节为106CFU/mL,用PBS配制植物乳杆菌上清液与菌悬液等体积混合,使终质量浓度分别为1/2 MIC、MIC、2 MIC以及4 MIC,以不加上清液组为对照组,于37 ℃孵育6 h。用PBS清洗菌体以除去上清液,加入罗丹明-123,于37 ℃避光染色30 min。再次清洗探针3 次,以PBS为空白对照组,通过荧光分光光度计测定荧光强度(激发波长486 nm,发射波长525 nm)。
1.4 数据处理
所有实验均重复3 次取其平均值。采用Origin 9.0软件通过单因素方差分析法对实验结果进行统计分析并作图,P<0.05,差异显著。
2 结果与分析
2.1 植物乳杆菌HB13-2对白假丝酵母菌的抑菌活性
MIC可以反映植物乳杆菌HB13-2上清液对浮游白假丝酵母菌的抑制活性,测定得到其MIC值为50 mg/mL。进一步进行时间-抑菌曲线的测定,以考察植物乳杆菌HB13-2上清液对白假丝酵母菌生长和繁殖的抑制情况。如图1所示,与没有加入植物乳杆菌上清液的细胞相比,1/2 MIC、MIC、2 MIC处理对白假丝酵母菌均有抑制作用,且呈质量浓度依赖性。在1/2 MIC处理组中植物乳杆菌HB13-2上清液延缓了白假丝酵母菌的生长速度,MIC处理组完全抑制了白假丝酵母菌的生长繁殖,在作用24 h后白假丝酵母菌处于生长停滞状态,数量与0 h相比基本保持不变,2 MIC处理组则在作用2 h后无活菌检出,表明在此质量浓度下植物乳杆菌HB13-2上清液对白假丝酵母菌显示出致死作用。
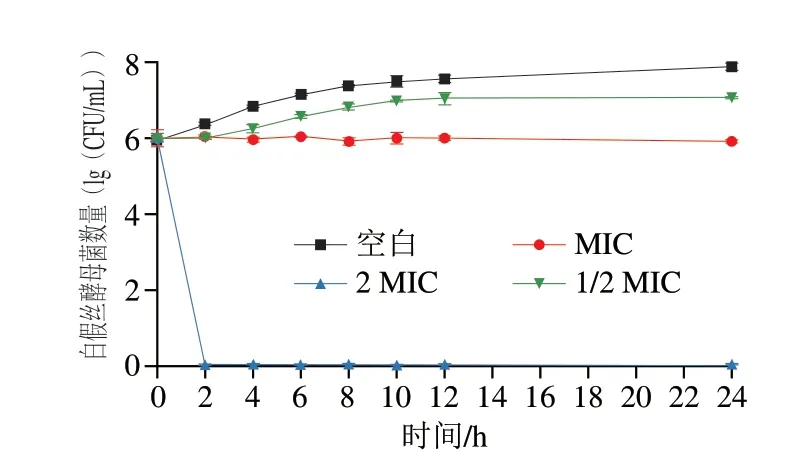
图1 植物乳杆菌HB13-2对白假丝酵母菌的抑菌曲线Fig.1 Inhibitory curves of L.plantarum HB13-2 against C.albicans
2.2 植物乳杆菌HB13-2对白假丝酵母菌细胞壁完整性的影响
白假丝酵母菌的细胞壁起到渗透屏障、维持细胞完整性并赋予结构刚性的作用,主要是由几丁质和β-1,3-葡聚糖组成[20]。荧光染料CFW与组成细胞壁的成分几丁质具有亲和力,两者结合可发出蓝光,蓝光强度越强则证明几丁质越密集,结合的越紧密,因此采用荧光染料CFW对白假丝酵母进行染色,考察了植物乳杆菌上清液对白假丝酵母菌细胞壁的作用[21]。图2荧光显微镜观察结果显示,未经上清液处理过的细胞与经上清液处理后的细胞均呈蓝色荧光,但未经上清液处理过的细胞荧光强度较弱,1/2 MIC与MIC处理组仅观察到荧光强度的增强,而2 MIC处理组可以观察到部分菌体的端部出现亮荧光,这种现象在4 MIC处理组中明显增多,大部分菌体都带有明显的亮点。Rueda等[22]研究证明,利用能有效杀灭念珠菌的药物——卡泊芬净处理白假丝酵母后,发现细胞壁中的几丁质积累,并使其他细胞壁成分重排,这可能是药物引起细胞壁修复机制的信号通路的激活,但并不足以使细胞免受药物的攻击。Da Silva等[21]发现,从石榴果皮中提取的凝集素PgTeL经荧光染料CFW染色后酵母壁中CFW荧光强度增强,并且出现在细胞质中扩散的现象,表明细胞壁完整性丧失。因此,在本研究中上清液处理后观察到荧光强度增强可能是由于几丁质的积累造成,而细胞中出现荧光斑点可能是由于细胞壁成分的重排导致荧光沾染率的差异,这表明上清液使细胞壁产生了损伤,从而导致几丁质的补偿性增加。
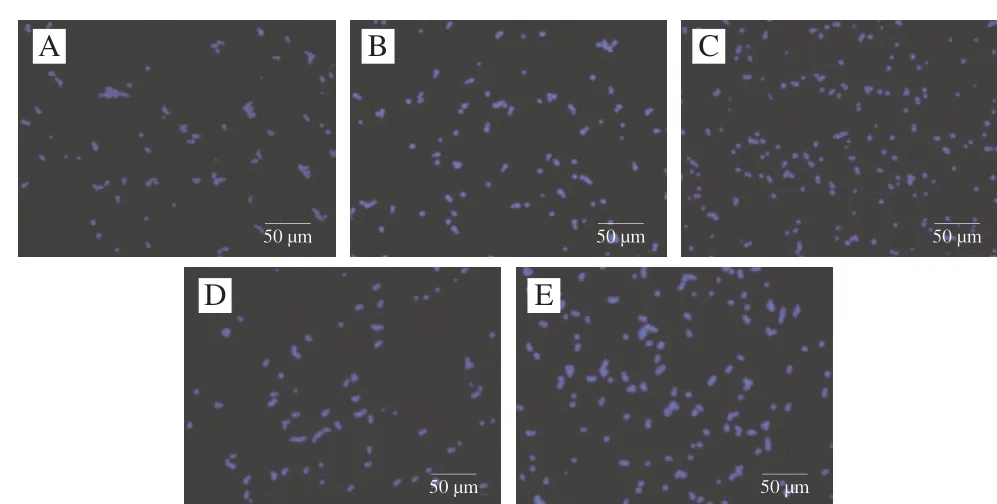
图2 植物乳杆菌HB13-2对白假丝酵母菌细胞壁完整性的影响Fig.2 Effect of L.plantarum HB13-2 on the cell wall integrity of C.albicans
2.3 植物乳杆菌HB13-2对白假丝酵母菌细胞膜完整性的影响
采用PI和SYTO-9对白假丝酵母菌进行染色,并通过荧光显微镜观察植物乳杆菌HB13-2上清液对其细胞膜完整性的影响。PI不能通过完整的细胞膜对DNA进行染色,但当细胞膜破损使可以进入胞内对DNA染色并发出红色荧光[23],而SYTO-9能够通过细胞膜对DNA进行染色发出绿色荧光[24],因此对细胞进行双染后从荧光显微镜观察菌体的颜色呈现绿色、黄色、橙色、红色,红色荧光强度越强则表明菌体细胞膜受损越严重。如图3所示,未经上清液处理过的细胞呈现绿色表明菌体细胞膜完整未出现破损,1/2 MIC处理组菌体仍以绿色为主,少数菌体呈现黄色,表明在此质量浓度处理下对大部分白假丝酵母菌细胞膜损伤不大;MIC处理组少部分菌体呈现黄色荧光强度较弱;2 MIC处理组中呈现黄色的菌体数量增加,少数菌体呈现橙色;4 MIC处理组红色荧光强度明显增加,菌体呈现红色表明菌体细胞膜损伤严重。
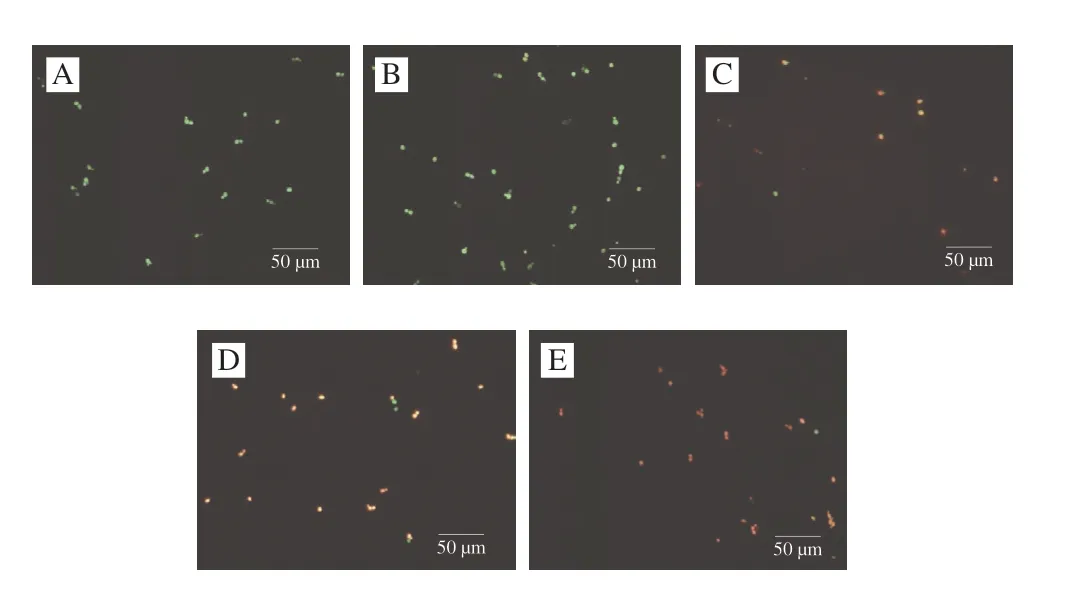
图3 植物乳杆菌HB13-2上清液对白假丝酵母菌细胞膜完整性的影响Fig.3 Effect of the culture supernatant of L.plantarum HB13-2 on the cell membrane integrity of C.albicans
为了进一步考察上清液对细胞膜的破坏,采用流式细胞术对破损程度进行定量分析。如图4所示,未经处理的白假丝酵母菌膜受损率为0.2%,1/2 MIC处理组膜受损率为2.3%,MIC处理组膜受损率为13.9%,2 MIC处理组膜受损率为56.8%,4 MIC处理组膜受损率为84.3%。因此,流式细胞仪结果表明1/2 MIC和MIC处理组对细胞膜的破坏作用均不明显,2 MIC与4 MIC处理组则显示出显著的破坏作用。荧光显微镜观察结果与流式细胞仪检测结果一致,均表明上清液处理可以破坏细胞膜完整性。
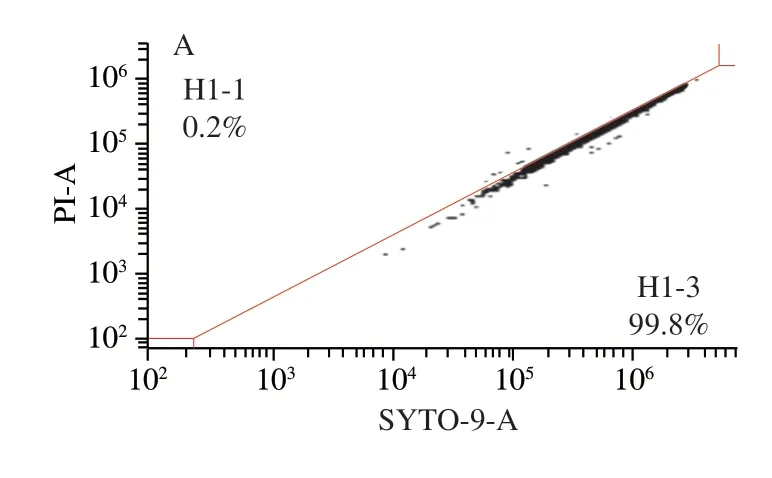
图4 流式细胞术分析植物乳杆菌HB13-2上清液对白假丝酵母菌细胞膜完整性的影响Fig.4 Flow cytometry analysis of the effect of the culture supernatant of L.plantarum HB13-2 on the cell membrane integrity of C.albicans
2.4 植物乳杆菌HB13-2对白假丝酵母菌细胞膜跨膜电势的影响
DiSC3(5)是一种亲脂性的荧光探针,由于其疏水性和阳离子性质可以穿透脂质双层并在极化细胞中积累到高水平[25]。膜去极化后,染料迅速从细胞中释放,随后可通过荧光分光光度计检测其荧光强度从而判断细胞膜膜电势水平[26]。如图5所示,未经上清液处理的细胞荧光强度为28.97,经Nigericin处理过的阴性对照组荧光强度为26.325,而经1/2 MIC、MIC、2 MIC、4 MIC处理后的细胞最终荧光强度分别达到54.57、66.12、86.305、100.48,随着上清液质量浓度的增加,DiSC3(5)荧光强度增大,呈现质量浓度依赖性。细胞内电化学梯度的破坏与质膜通透性的增加相关[27],上清液可能通过导致白假丝酵母菌细胞膜的去极化及通透性增加,从而起到抗真菌作用,这一结果与杜仲抗菌肽EuCHIT1对白假丝酵母菌的抑菌机制类似均可破坏膜电势[28]。
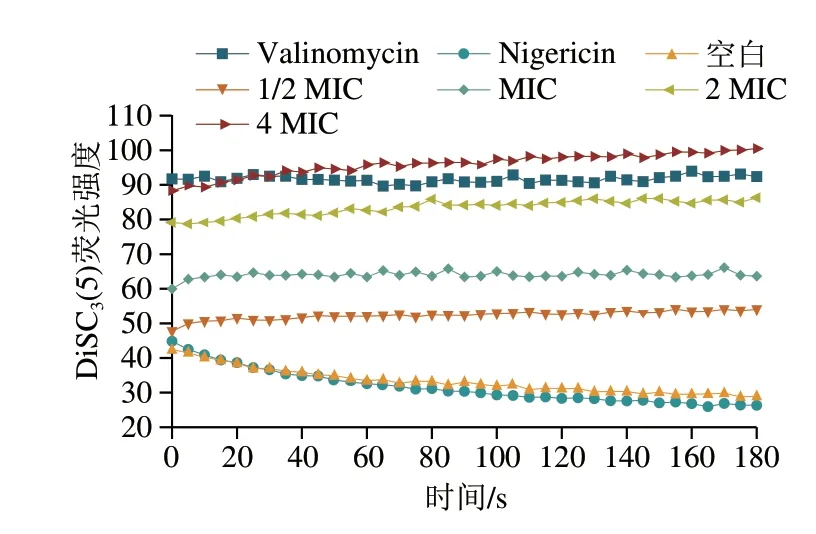
图5 植物乳杆菌HB13-2对白假丝酵母菌跨膜电势的影响Fig.5 Effect of L.plantarum HB13-2 on the transmembrane potential of C.albicans
2.5 植物乳杆菌HB13-2对白假丝酵母菌超微结构的影响
如图6所示,未经上清液处理的白假丝酵母菌菌体完整、饱满、边缘清晰,且表面光滑呈球状,而用不同质量浓度植物乳杆菌HB13-2上清液处理6 h后白假丝酵母菌的形态发生了不同程度改变。经MIC处理后,白假丝酵母菌菌体表面变的粗糙,并出现皱缩,部分菌体表面出现凹陷,并伴有少量附着在菌体上的泄漏内容物。经2 MIC处理后,白假丝酵母菌菌体表面皱缩,出现严重凹陷并产生空洞,大量泄漏的内容物与溶解的细胞以及细胞碎片出现,并出现附着团聚的现象。

图6 扫描电镜观察植物乳杆菌HB13-2对白假丝酵母菌形态结构的影响Fig.6 Effect of L.plantarum HB13-2 on the morphological structure of C.albicans observed by SEM
2.6 植物乳杆菌HB13-2对白假丝酵母菌ROS的影响
ROS是在细胞氧化呼吸过程中产生,还原酶可以消除产生的ROS,以达到细胞内氧化还原的平衡,当ROS水平较高时可能会扰乱细胞正常代谢,破坏细胞器和细胞膜,从而进一步导致细胞的死亡[29]。DCFH-DA能够进入细胞,并通过酯酶脱乙酰化为2′,7′-二氯二氢荧光素(2′,7′-dichlorodihydrofluorescein,DCFH),DCFH不能通过细胞因此留存在细胞内部,DCFH无荧光但当ROS存在时能够被氧化为有荧光的2′,7′-二氯荧光素,因此通过测定荧光强度可以测定细胞内ROS的积累水平[30]。如图7所示,未经处理的细胞荧光强度为9.41,而经1/2 MIC、MIC、2 MIC、4 MIC处理后的细胞最终荧光强度分别达到15.78、30.86、56.68、83.995,荧光强度的增强表明植物乳杆菌HB13-2上清液能显著增加白假丝酵母菌细胞内ROS水平,并呈现质量浓度依赖性。ROS积累是许多抗真菌药物以及化学物质发挥抑制和致死作用的机制之一,伊曲康唑是对白假丝酵母十分有效的杀菌剂,其主要杀菌机制是引起白假丝酵母菌ROS的积累诱导细胞的凋亡[31]。经香芹酚处理后的白假丝酵母,ROS水平增加并且改变了线粒体膜电位,并影响了线粒体形态[32]。因此ROS的积累可能是上清液的抑菌机制之一,并有可能对白假丝酵母菌的线粒体产生影响。
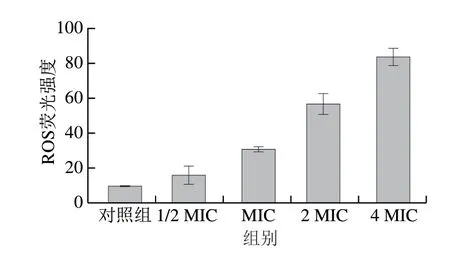
图7 植物乳杆菌HB13-2对白假丝酵母菌ROS的影响Fig.7 Effect of L.plantarum HB13-2 on intracellular ROS levels in C.albicans
2.7 植物乳杆菌HB13-2对白假丝酵母菌线粒体膜电位的影响
线粒体膜电位作为细胞能量状态的指标,可以反映线粒体中的质子负荷、电子转运蛋白的活性和线粒体膜的通透性[33],因此膜电位的改变也是抗真菌的重要机制。罗丹明-123是一种阳离子亲脂性染料,渗透到带负电荷的线粒体中,并反映线粒体膜电位[19]。如图8所示,植物乳杆菌HB13-2以质量浓度依赖的方式显著增强了罗丹明-123荧光强度,未经处理过的细胞荧光强度为9.26,而经1/2 MIC、MIC、2 MIC、4 MIC处理后终荧光强度分别达到13.36、15.495、25.57、45.96,显著增加了白假丝酵母菌线粒体膜电位水平。线粒体膜电位的增加表明上清液可以诱导白假丝酵母菌线粒体膜电位的超极化,并诱导线粒体损伤,使线粒体功能出现障碍。线粒体是细胞凋亡过程中最常见的ROS来源,ROS积累会导致线粒体膜性能改变,最终改变膜电位[34]。ROS研究结果表明上清液处理会导致细胞内ROS的积累,因此推测这是导致白假丝酵母菌线粒体膜电位改变的原因之一。
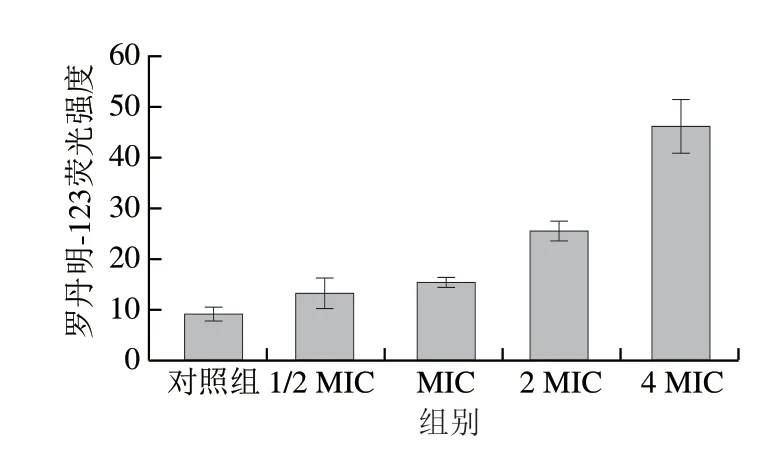
图8 植物乳杆菌HB13-2对白假丝酵母菌线粒体膜电位的影响Fig.8 Effect of L.plantarum HB13-2 on mitochondrial membrane potential of C.albicans
3 结论
植物乳杆菌HB13-2上清液能够抑制白假丝酵母菌的生长,并能破坏细胞壁的完整性,改变细胞膜通透性并导致跨膜电势消散。从微观结构观察也发现经上清液处理后菌体产生明显的皱缩、形变,引起内容物的泄漏。另外,上清液处理也会导致菌体内ROS积累以及线粒体膜电位的改变并出现超极化。总之,植物乳杆菌HB13-2上清液可通过破坏细胞壁和细胞膜完整性、影响膜电势、改变菌体形态、导致ROS积累、损伤线粒体功能对白假丝酵母菌产生抑制效果。本研究可为植物乳杆菌HB13-2开发成为口腔益生菌提供科学依据。
