甘蓝广谱抗根肿病材料的鉴定和创制
2024-01-03卢淑锦朱明钊张娜杨丽梅张扬勇吕红豪季家磊闫继平王勇
卢淑锦 朱明钊 张娜 杨丽梅 庄 木 张扬勇 吕红豪 季家磊 闫继平 王勇*
(1 湖南农业大学园艺学院,园艺作物种质创新与新品种选育教育部工程研究中心,蔬菜生物学湖南省重点实验室,湖南长沙 410128;2 中国农业科学院蔬菜花卉研究所,蔬菜生物育种全国重点实验室,北京 100081;3 北京市农林科学院蔬菜研究所,蔬菜生物育种全国重点实验室,国家工程技术研究中心,蔬菜种质改良北京市重点实验室,农业农村部华北都市农业重点实验室,北京 100097;4 昌黎县农业农村局,河北秦皇岛 066600)
结球甘蓝(BrassicaoleraceaL.var.capitataL.)简称甘蓝,其适应性强,风味独特,是主要的十字花科芸薹属蔬菜作物之一(方智远,2017)。甘蓝在我国广泛栽培,在蔬菜周年供应和出口贸易中占重要地位(杨丽梅 等,2016,2021)。根肿病是由芸薹根肿菌(PlasmodiophorabrassicaeWoronin)侵染引起的一种世界性土传病害,主要危害十字花科作物(Dixon,2009;章艺 等,2022),可危害的十字花科植物超过100 种(Howard et al.,2010),近年来已严重影响甘蓝的生产。植株在苗期感病,主要表现为根部形成肿瘤,叶片会永久性萎蔫,直至死亡(Devos et al.,2005)。根肿菌的休眠孢子可以在适宜土壤环境中存活20年之久(Koji &Takahiro,2009),一旦田间土壤受到根肿菌污染,将长期不适宜种植十字花科作物。
目前,防治根肿病的主要方法是采用抗病品种,同时实行轮作、深耕、调节土壤酸碱度等措施进行综合防治(赵利民 等,2022)。田间管理和生物防治、化学防治方法虽然有一定的防治效果,但不能从根本上有效防治根肿病,选育抗根肿病品种是最经济有效的方法(Kuginuki et al.,1999)。芸薹属A 基因组作物中的欧洲芜菁和白菜是十字花科作物中抗根肿病遗传规律研究最透彻的作物,迄今为止在芸薹属A 基因组作物中已定位的抗根肿病基因超过12 个,其 中CRa、CRb、CRd、CRk、Crr3、PbBa3.1、PbBa3.3、QS_B3.1位于A3 染色体上,Crr1、Crr2、Crr4、CRc则分别位于A8、A1、A6、A2 染色体上。芸薹属A 基因组作物中的根肿病抗性多为单基因控制,而甘蓝根肿病抗性是由多基因控制的数量性状(Diederichsen et al.,2009)。由于甘蓝种质中根肿病抗源材料稀少,抗病遗传机制复杂,抗病机制研究不透彻等原因造成甘蓝抗根肿病育种工作进展缓慢。尽管已有一些抗根肿病甘蓝品种在田间实际生产中应用,但仍不足以解决日益严重的根肿病危害。同时,根肿菌存在生理小种的分化,不同生理小种的致病力有差异。国际上常用的划分根肿菌生理小种的系统主要有2 个,分别是ECD系统和Williams 系统。由于Williams 系统仅采用4个鉴别寄主-2 个结球甘蓝和2 个芜菁甘蓝,其鉴别寄主少,鉴定方便,是目前鉴定根肿菌生理小种的主流方法。国内白宇鹏(2019)还创建了SCD鉴别系统,采用更多的大白菜自交系作为鉴别寄主,可对根肿菌生理小种进行更加精确的划分。沈向群等(2009)采用Williams 系统鉴定出4号生理小种致病力最强,为国内十字花科蔬菜根肿菌主流生理小种,甘蓝主产区的湖北、重庆、云南等病区均为4号生理小种(陈静 等,2016;费维新 等,2016)。但来源不同的4号生理小种也会表现出不同的致病力(张淑霞 等,2019)。目前国内缺乏对来源于湖北长阳、重庆武隆等地的根肿菌4号生理小种表现高抗且对不同地区根肿菌生理小种具有广谱抗性的甘蓝品种。因此,创制出广谱抗根肿病甘蓝材料,对甘蓝抗根肿病育种具有重要意义。
甘蓝是具有典型杂种优势的异花授粉植物,其进行杂交种生产的途径之一是利用雄性不育系(方智远 等,2002)。高等植物中的细胞质雄性不育(cytoplasmic male sterility,CMS)通常是指雄性配子的退化或者功能丧失,在150 多种高等植物中均发现了细胞质雄性不育系(Carlsson et al.,2008),其中萝卜细胞质雄性不育(Ogura CMS)是国内外甘蓝育种工作者应用最多的不育类型。目前,甘蓝杂交种主要是利用Ogura CMS 配制而成,不育性稳定,无法进行自交、分离和纯化。利用种间杂交技术将育性恢复基因Rfo(restorer-of-fertility gene)导入含有抗病基因的Ogura CMS 商品种中,恢复其育性,可将抗病基因转育至甘蓝自交系中,对拓宽甘蓝抗病种质资源具有重大意义。
本试验以来自湖北长阳、重庆武隆、四川广元的根肿菌生理小种作为病原菌菌源,对抗根肿病Ogura CMS 甘蓝材料GY306 进行抗性鉴定。并以GY306 为母本,与Ogura CMS 恢复材料Z92 进行种间杂交,以期创制出对多个地区根肿菌生理小种表现抗性的甘蓝种质,为甘蓝抗根肿病育种提供抗源材料。
1 材料与方法
1.1 试验材料
供试Ogura CMS 甘蓝材料GY306 采集自四川广元根肿病病田,对根肿菌4号生理小种具有良好抗性,叶球扁球形、绿色,中心柱短,商品性好。抗病对照绿抗9号(试验编号为CR1)亦为Ogura CMS 甘蓝品种,由武汉市九头鸟种苗有限公司提供。感病对照CR2 和Ogura CMS 育性恢复材料Z92(含有育性恢复基因Rfo)均由中国农业科学院蔬菜花卉研究所甘蓝遗传育种课题组提供。
供试根肿菌采集于湖北长阳、重庆武隆、四川广元根肿病病田的甘蓝肿根,经Williams 系统鉴定分别为4号、4号、7号生理小种。将甘蓝肿根清洗后保存于-20 ℃冰箱,备用。
1.2 试验方法
1.2.1 材料种植 2021年10月,在中国农业科学院蔬菜花卉研究所南圃场温室内种植GY306、CR1、CR2、Z92,分别选取颗粒饱满的种子,采用32 孔穴盘基质育苗,每份材料播种2 盘。
2022年4月,采用人工剥蕾的方法,于上午取含有Ogura CMS 育性恢复基因(Rfo)甘蓝材料Z92 的盛花期花粉,涂抹在GY306 的柱头上,然后套袋、挂牌标记;待种荚成熟时进行收获。
2022年7月种植Z92×GY306 杂交F1群体。
1.2.2 根肿菌接种液制备 取20 g 备用的甘蓝肿根,置于室温腐化12 h;然后放进搅拌器,加入3倍体积的无菌蒸馏水,匀浆经过8 层纱布过滤,将滤液收集至50 mL 的离心管中,500 r·min-1离心5 min;上清液收集至新的离心管中,2 500 r·min-1离心5 min,弃上清液;沉淀用无菌水重悬3 次后,利用血球计数板将孢子浓度调整至2×108个·mL-1。4 ℃冰箱保存,24 h 内使用。
1.2.3 苗期人工接种抗病性鉴定 待GY306、CR1、CR2 幼苗长至两叶一心时,采用孢子注射法分别接种长阳、武隆、广元根肿菌菌液,吸取2 mL 菌液注射于幼苗根部;接种后置于温室内,适时浇水。接种42 d 后,将幼苗根部轻轻拔出,并用清水洗净,调查根肿病发病情况,参考Ning 等(2018)的病情分级标准及方法计算病情指数,进行抗性评价。
病情分级标准:0 级,根部无症状;1 级,主根无症状,侧根有小瘤;2 级,主根略有膨大,侧根肿瘤较大;3 级,主根膨大较严重,有明显侧根;4 级,主根膨大非常严重,几乎没有侧根。
病情指数(DI)=∑(各病级株数×相应级值)/(调查总株数×最高级值)×100
抗性评价标准:免疫(I),DI=0;高抗(HR),0<DI≤5;抗病(R),5<DI≤20;中抗(MR),20<DI≤30;感病(S),30<DI≤60;高感(HS),DI > 60。
1.2.4 甘蓝根肿病抗性基因分子标记检测 利用已报道的7 对与根肿病抗性基因连锁的分子标记(表1)(Saito et al.,2006;Matsumoto et al.,2012;Zhang et al.,2014),以不含根肿病抗性基因的CR2为感病对照,以CR1 为抗病对照,对GY306 进行分子标记鉴定。采用改良的CTAB 法提取植株基因组DNA(Stefanova et al.,2013),并将DNA 浓度调整至30~50 ng·μL-1。分别以GY306、CR1、CR2 的DNA 作为模板,依次采用7 对引物进行PCR 扩增。PCR 扩增体系为10 μL:模板DNA 1 μL,PCR mix 5 μL,1.0 μmol·L-1上、下游引物各0.5μL,ddH2O 补齐至10 μL。PCR 扩增程序:94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,35 个循环;72 ℃延伸5 min。取PCR 产物1 μL,使用1.0%琼脂糖凝胶进行电泳检测。

表1 甘蓝根肿病抗性基因的引物序列
1.2.5 甘蓝Ogura CMS 及其恢复基因分子标记检测 利用Chen 等(2021)设计的与Ogura CMS 相关的分子标记OKB(表2),以非Ogura CMS 甘蓝材料CR2 为阴性对照,以Ogura CMS 甘蓝品种CR1 为阳性对照,对GY306 进行分子标记鉴定,方法同1.2.4。
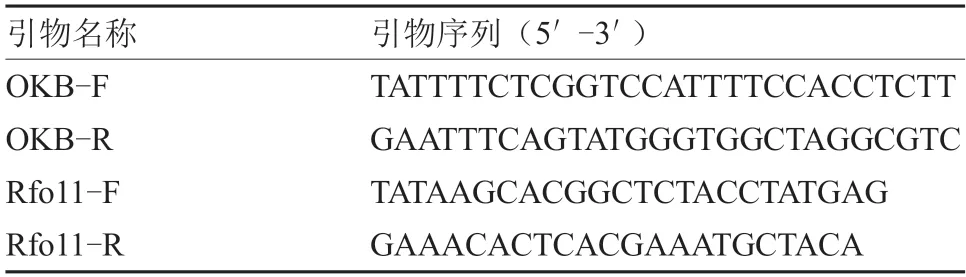
表2 甘蓝Ogura CMS 及其恢复基因的引物序列
利用任文静(2021)设计的与Ogura CMS 恢复基因相关的分子标记Rfo11(表2),以不含Ogura CMS 恢复基因的CR2 为对照,对Z92×GY306 杂交F1群体进行分子标记鉴定,方法同1.2.4。
1.2.6 育性调查 待Z92×GY306 杂交F1植株抽薹开花后,于盛花期对花粉进行观察。对花粉正常的植株进行育性检测,采集具有正常花粉的花朵,使用亚历山大染液进行染色,观察花粉状态,判断植株是否恢复育性。
2 结果与分析
2.1 GY306 根肿病抗性鉴定与抗病基因检测
由图1、表3 可知,GY306 对长阳和广元的根肿菌生理小种均表现为免疫(DI=0),对武隆的根肿菌生理小种表现为抗病(DI=6.25);抗病对照CR1 对武隆和广元的根肿菌生理小种均表现为高抗,但对长阳的根肿菌生理小种则表现为高感;而感病对照CR2 对3 个地区的根肿菌生理小种均表现为感病或高感。经Williams 系统鉴定,长阳、武隆的根肿菌均为我国主要流行的4号生理小种,广元的根肿菌为7号生理小种。表明,GY306 对根肿病具有广谱抗性,对根肿菌4号生理小种和7号生理小种均表现抗病。
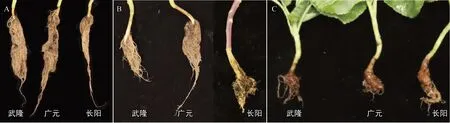
图1 GY306 根肿病室内苗期人工接种鉴定表型结果
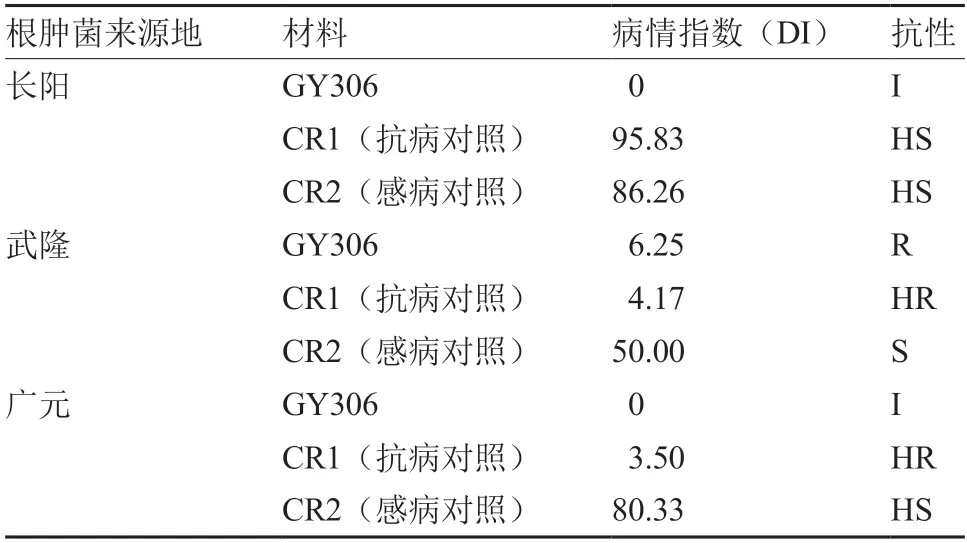
表3 GY306 根肿病室内苗期人工接种鉴定结果
利用已报道的7 对与根肿病抗性基因连锁的分子标记对GY306 进行抗性基因检测,结果发现抗病对照CR1 含有抗根肿病基因CRa,而GY306 中未发现根肿病抗性基因(表4)。说明GY306 可作为甘蓝抗根肿病育种的新种质。

表4 GY306 根肿病抗性基因分子标记检测结果
2.2 GY306 的育性恢复及抗病种质创制
GY306 的雄蕊花药干瘪,不能产生正常的花粉,利用分子标记OKB 检测发现GY306 的不育类型为Ogura CMS(图2)。

图2 GY306 不育类型检测结果
利用含有Ogura CMS 育性恢复基因(Rfo)的甘蓝材料Z92,对GY306 进行育性恢复。然后利用分子标记Rfo11 对5 000 株Z92×GY306 杂交F1群体进行分子标记鉴定,共筛选获得Rfo阳性单株3 株,编号分别为971、1551、1937,阳性率为0.06%。综上所述,Z92×GY306 杂交种携带Z92 含有的Rfo基因。
在盛花期,对3 株阳性株(971、1551、1937)的育性进行调查。结果表明,阳性株雄蕊可正常产生花粉(图3、4),即杂交种已恢复育性,可进行根肿病抗性基因的转育。
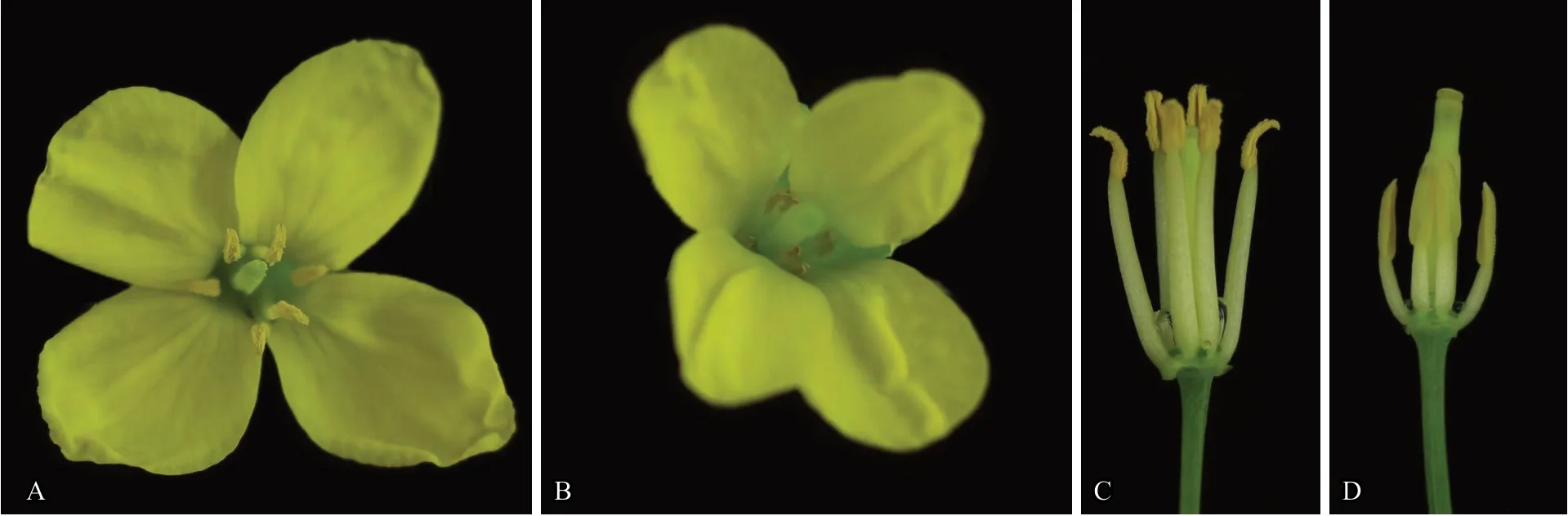
图3 Z97×GY306 杂交F1 花朵表型

图4 Rfo 阳性株花粉亚历山大染色检测结果
采用来自长阳的根肿菌,对3 株阳性株(971、1551、1937)进行根肿病抗性鉴定。结果表明(表5、图5),3 株阳性株均表现为免疫,可作为具有根肿病广谱抗性且可育的甘蓝育种材料。

图5 3 株阳性株根肿病室内苗期人工接种鉴定表型结果

表5 3 株阳性株根肿病室内苗期人工接种鉴定结果
3 结论与讨论
甘蓝是我国重要的叶菜类蔬菜之一,在各地广泛种植,由芸薹根肿菌侵染引发的根肿病严重威胁其生产。根肿菌生理小种复杂,变异速度迅速,加大了根肿病的田间防治难度,选育抗根肿病的甘蓝新品种是最经济有效的防治方法(司军,2002)。而甘蓝中根肿病抗源相对稀缺,遗传机制较为复杂(孙超 等,2016)。不仅如此,根肿菌的不同生理小种分化伴随着致病力的变化,主流的4号生理小种更是有几个分型(原玉香 等,2017)。本试验中,抗病对照CR1 对同为4号生理小种的武隆和长阳根肿菌表现出不同的抗性,说明武隆与长阳的根肿菌是4号生理小种的不同分型。大部分国内科研单位推出的抗根肿病品种表现为抗病或耐病,表现高抗的并不多,不能满足市场需求(曾爱松 等,2022)。陈萍等(2022)筛选到2 份对云南通海、陕西太白和湖北恩施的根肿菌生理小种均表现抗病的甘蓝材料,但抗性有差异。本试验结果表明,GY306 对湖北长阳、重庆武隆、四川广元3 个地区的根肿菌生理小种皆表现良好的抗性,是具有广谱抗性的甘蓝根肿病抗源,有较大的育种应用价值。但还需进一步对GY306 中的抗根肿病基因的遗传机理、定位和克隆进行研究。
目前选育抗根肿病甘蓝品种的方法主要是通过远缘杂交将白菜中的抗病基因导入到甘蓝中以获得抗性(沈舒,2019;曾爱松 等,2021),其抗病育种过程非常缓慢和困难,寻找新的抗病育种方式极为迫切。而甘蓝杂交种多为Ogura CMS 配制而成,均表现为不育,难以进行抗病基因的转育,阻碍了抗病种质的创新。近年来,已成功创制了甘蓝型油菜、芥菜型油菜、甘蓝的Ogura CMS 恢复系(Primard-Brisset et al.,2005;Tian et al.,2014;于海龙 等,2021),可以恢复抗病Ogura CMS 品种的育性,加快甘蓝抗根肿病新品种的育种进程。本试验利用Ogura CMS 育性恢复材料Z92(含有育性恢复基因Rfo)对GY306 进行育性恢复,获得了3 份既含有抗根肿病基因又含有Rfo恢复基因的可育甘蓝材料,为今后的甘蓝抗根肿病育种奠定了基础。
