铜和浓硫酸反应的一体化新设计
2024-01-03西华师范大学化学教育研究所637000周于莉彭新月四川省南充市白塔中学637100
西华师范大学化学教育研究所(637000) 周于莉 彭新月 四川省南充市白塔中学(637100) 田 权
铜与浓硫酸反应选自人教版必修2第1单元第1节“硫及其化合物”,《普通高中化学课程标准(2017年版)》[1]对该部分的要求是:对不同含硫价态物质的转化进行探究,学生能够例举、描述、辨识典型物质重要的物理和化学性质及实验现象,能用化学方程式表示典型物质的主要化学性质。通过铜与浓硫酸反应的实验,学生能够掌握浓硫酸的强氧化性、验证产物二氧化硫的还原性、漂白性和酸性。
化学是一门以实验为基础的学科,通过实验的直观展示可以提高教学的趣味性、学生的探索欲,但由于大多数化学实验存在一定的危险性,所以中学实验通常以教师演示为主,这就要求实验现象明显、便于操作、无污染物。铜与浓硫酸反应是高中化学非常重要的一个实验,值得对其进行探究。
1 研究背景
1.1 教材实验分析
1.1.1 人教版教材实验分析[2]
人教版教材实验(如图1所示)存在以下缺点:①抽拉铜丝容易受到橡胶塞的阻力,不便于控制反应的发生与停止;②该实验性质检验用品红溶液和石蕊试液,浪费药品。
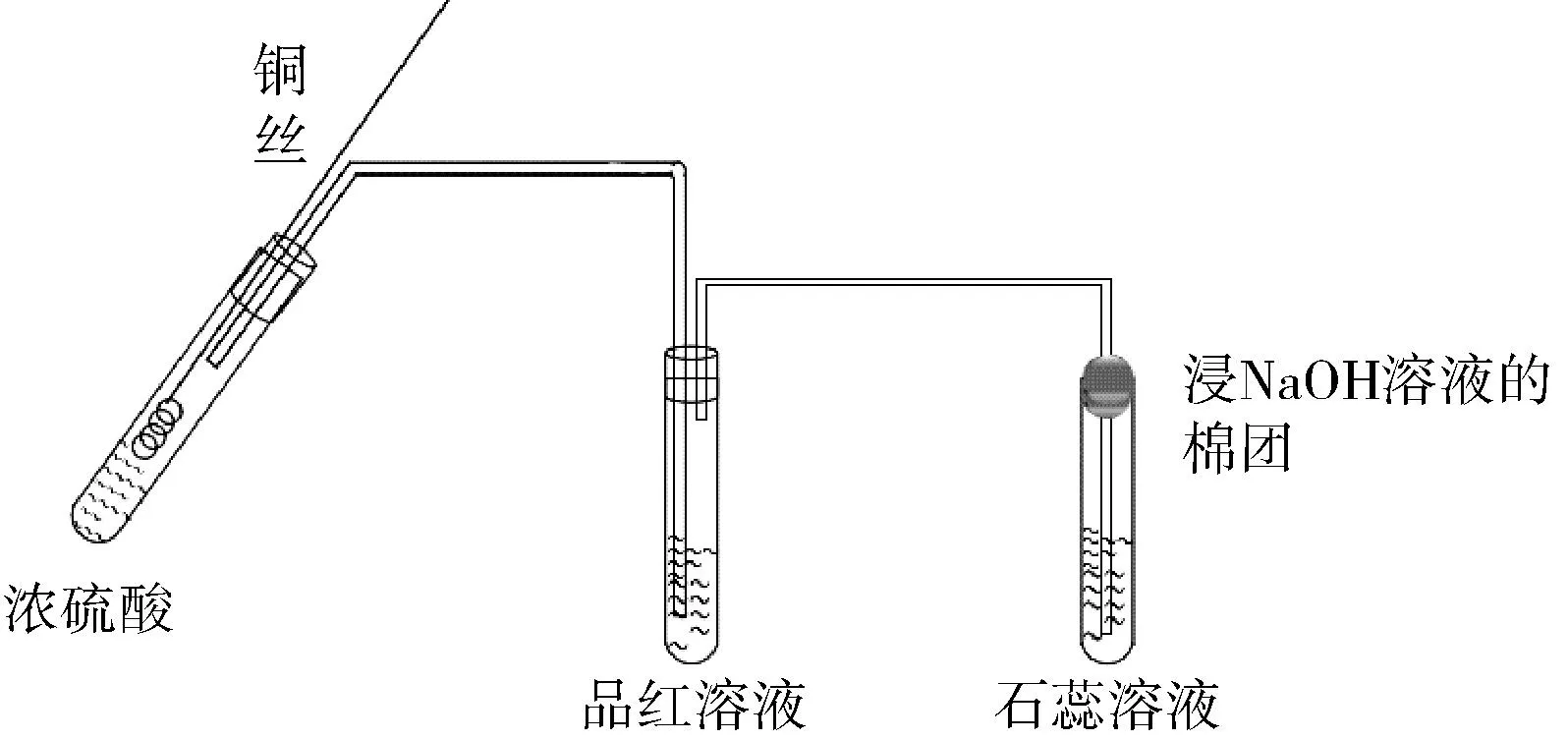
图1 人教版Cu与浓硫酸反应装置图
1.1.2 苏教版教材实验分析[3]
苏教版铜与浓硫酸反应装置图如图2所示。该反应装置简单,操作方便。但存在以下几个弊端:①尾气处理装置不当。SO2在水中的溶解性极好,若先撤酒精灯,则容易造成倒吸,若先撤导管,SO2则容易逸出,污染空气;②反应结束后,试管中的SO2没有得到处理,会逸出污染空气。
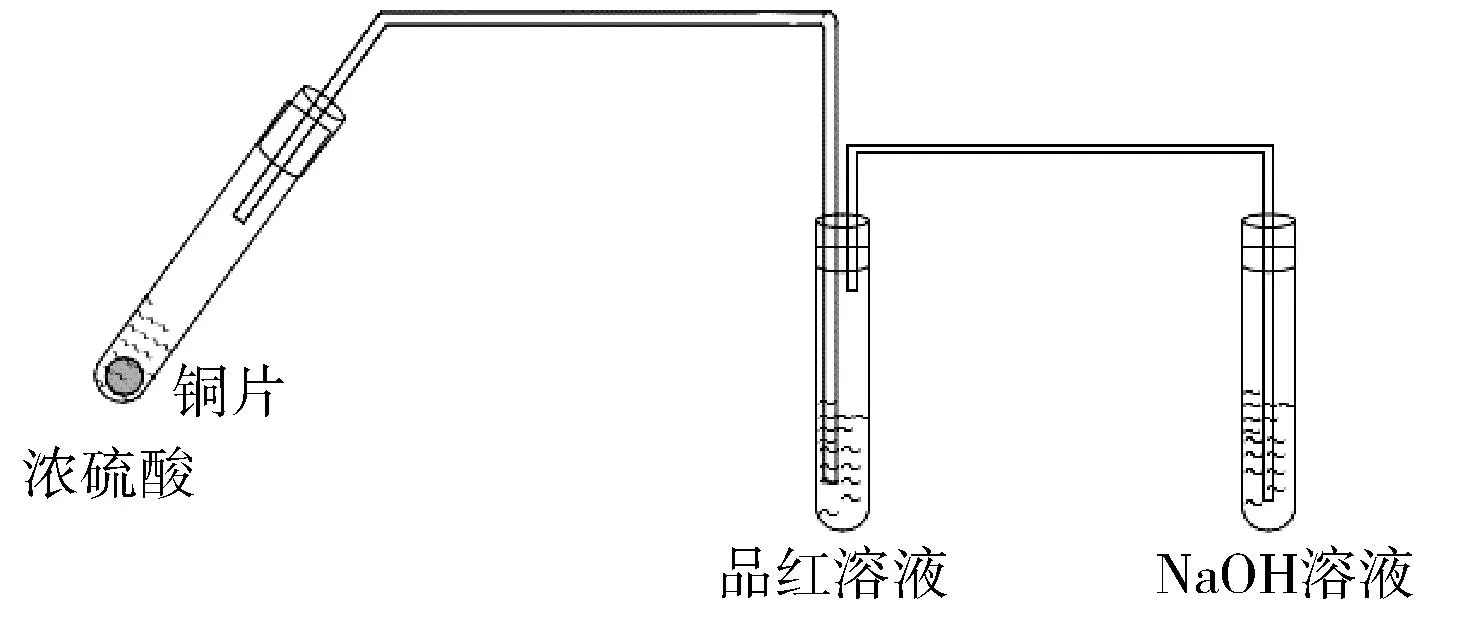
图2 苏教版Cu与浓硫酸反应装置图
1.1.3 沪教版教材实验分析[4]
沪教版铜与浓硫酸反应装置图如图3所示。该设计与苏教版教材极为相似,但在苏教版基础上多了一个抽气装置,可以将试管中的SO2完全吸收,防止污染空气。但该装置仍然存在仅探讨了SO2的漂白性,不利于学生系统学习SO2的还原性、酸性的缺点。
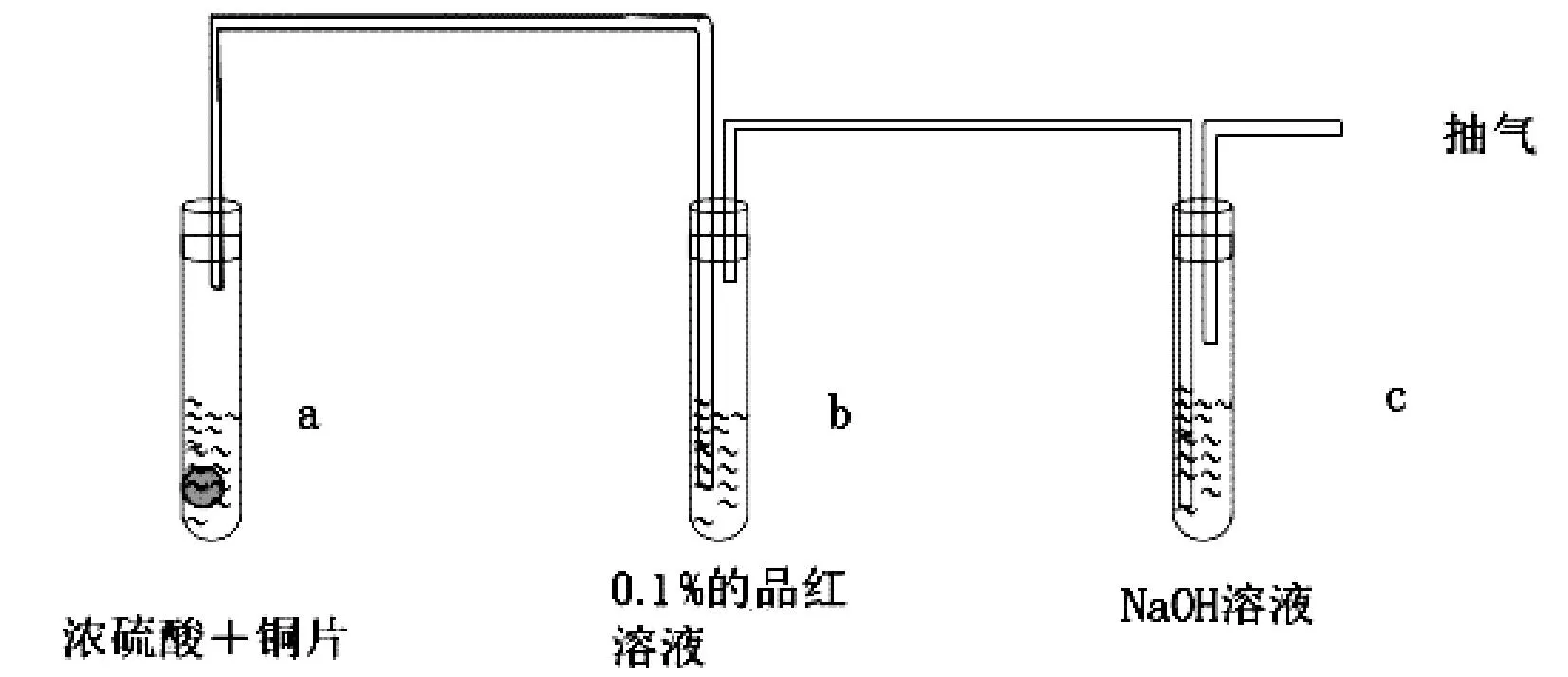
图3 沪教版Cu与浓硫酸反应装置图
1.2 改进实验分析
针对以上缺点,目前已经有不少人对该实验进行了改进。主要分为探究不同实验条件对反应的影响和对实验装置进行改进。
探究不同实验条件主要是通过比对不同酸的用量、反应温度、铜的用量等来寻找最佳反应条件。例如夏立先[5]对铜与浓硫酸反应溶液呈绿色的原因进行了探究,最后发现是氯元素的掺入影响了实验探究。在实验时一定要注意实验原料的纯度,即打磨铜丝、用蒸馏水清洗实验仪器;郑茹丹[6]通过让铜与不同浓度的浓硫酸进行反应,得出浓硫酸的浓度不是越大越好,而是存在一定的最佳范围的结论。
对装置进行改进则是从改进反应物参与实验的方式、药剂的用量、尾气的处理等角度出发对实验装置进行改进。例如巩永锐[7]、 陈海涛[8]的设计是通过磁环、搅拌子或者制作封铁玻璃管利用磁力吸引来控制反应的发生与停止;王丹[9]、张义[10]等人则是通过针管抽拉与橡胶相连的铜丝来控制反应的发生与停止,但大多数还是选择铜片或铜粉与酸直接接触保证绝对封闭性来进行反应;王春[11]、曾广勇[12]等人通过1根防倒吸的导管将尾气插入到氢氧化钠溶液中进行尾气吸收。
通过以上文献分析,我们可以发现实验改进仍然存在不少缺点。例如反应装置复杂,前期准备工作较多;SO2的性质检验不全,不利于学生系统学习;尾气处理不当,容易污染空气。基于此,笔者提出了一个简单易行、一体化封闭设计、零污染的实验改进装置。
2 实验改进
2.1 实验药品及仪器
(1)实验药品:Cu粉、浓硫酸、NaOH溶液、紫色石蕊溶液、高锰酸钾溶液、品红溶液。
(2)实验仪器:U形管、球形干燥管、铁架台、酒精灯、脱脂棉团、细线、橡皮塞、橡胶管、打气筒、大头针。
2.2 实验装置图
实验装置如图4所示。

图4 Cu与浓硫酸反应装置改进图
2.3 实验过程
(1)首先,按照图4搭建好反应装置图。将大头针穿过脱脂棉团后弯曲交叉,重复完成3个这种脱脂棉团。然后先用蒸馏水将这3个脱脂棉团微微润湿,然后滴加适量的试剂使棉团着色即可,防止试剂过量各棉团浸润的溶液滴落造成干扰。最后用细线将这3个脱脂棉团串起来,将细线固定在塞子和试管的夹缝处。
(2)装置搭建好以后,点燃酒精灯对U形管进行预热,预热结束后用酒精灯外焰对U形管底部集中加热产SO2。
(3)观察到3个脱脂棉团从上到下依次由红色变为无色、紫色变为红色、紫色变为无色时反应结束停止加热。
(4)反应结束后用打气筒打气将瓶内和管道内的SO2气体全部送到干燥管内的蘸有氢氧化钠溶液的脱脂棉团处(以使SO2被充分吸收)。
2.4 实验现象分析
学生通过研究实验现象的变化,回忆所学知识,寻找证据来支撑自己的猜想,获取知识的本质,同时通过实验的呈现来巩固知识。在验证产物SO2化学性质的几个小实验中,颜色变化非常复杂。脱脂棉团“一褪两变”:2个紫色脱脂棉球在同等条件下经过一段时间后却发生了不同的变化形成鲜明对比。学生因此会产生疑惑,教师引导学生通过已学的知识来解释这种现象:
(1)高锰酸钾溶液的紫色棉团,反应一段时间后紫色褪去,证明是具有还原性的物质与高锰酸钾溶液之间发生了氧化还原反应,因此证明产生的气体是SO2,非SO3。
褪色原理:2KMnO4+5SO2+2H2O=2MnSO4+2H2SO4+K2SO4。
(2)蘸有紫色石蕊试液的脱脂棉团,反应一段时间后变红,证明SO2是酸性气体,与水反应生成了能使石蕊变色的物质H2SO3,如图5所示。

图5 SO2溶于水
(3)蘸有品红溶液的脱脂棉团,由红色变为无色。说明品红溶液与SO2化合,生成无色物质,如图6所示。
图6 SO2与品红溶液反应
3 实验总结
实验注意事项:本次实验改进所需的装置易得,操作简单,现象明显,无毒无害。
①为了使实现现象变化明显,可先用蒸馏水将脱脂棉团润湿再滴加试剂;②为了说明产生的气体是SO2非SO3,需要将最下面的棉团滴加高锰酸钾溶液。因为蘸有高锰酸钾溶液的脱脂棉团褪色,证明了产物具有还原性,所以该气体是SO2。
