血清硫氧还原蛋白、总tau蛋白水平在急性脑梗死溶栓后发生出血性转化患者中的变化及意义
2024-01-03赵旭锐孙国才权泽威王彩霞
赵旭锐,孙国才△,权泽威,朱 娇,王彩霞,秦 燕
兵器工业五二一医院:1.老年病科;2.肿瘤血液病科,陕西西安 710065
急性脑梗死(ACI)是指机体脑部供血出现障碍造成脑组织缺血、缺氧坏死的脑血管疾病,其具有高复发率、高致死率的特点[1-2]。重组组织型纤溶酶原激活剂(rt-PA)静脉溶栓是临床上治疗ACI的有效手段,但溶栓后10%~40%患者会发生出血性转化(HT),进而会增加预后不良的风险[3]。目前临床尚未发现预测HT发生的有效指标,因此准确评估ACI患者溶栓后发生HT的风险、筛查发生HT的高危人群并进行积极、有效的干预具有重要的现实意义。硫氧还原蛋白(Trx)是细胞内重要的还原性保护蛋白,其作为脑血管病发病机制中细胞凋亡、氧化应激的重要蛋白,在脑神经元损伤、凋亡过程中发挥保护作用[4]。tau蛋白是神经细胞主要的微管连接结构蛋白,既往研究证实tau蛋白可在不利的脑环境中发挥保护性作用,可作为神经元损伤的标志物[5],总tau蛋白 (T-tau)可在急性脑损伤后瞬间增高。本研究旨在探讨Trx、T-tau与ACI患者溶栓后发生HT的关系,为临床提供依据。
1 资料与方法
1.1一般资料 选取本院2020年12月至2022年1月收治的132例接受rt-PA静脉溶栓的ACI患者为研究对象,其中男58例、女74例。依据《中国急性脑梗死后出血转化诊治共识2019》[6],按是否发生HT,可将ACI患者分为HT组34例和非HT组98例。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2014》[7]中ACI的诊断标准;(2)临床资料完整;(3)发病后4.5 h内接受rt-PA静脉溶栓治疗。排除标准:(1)有脑出血、脑梗死、脑外伤既往病史者;(2)合并心、肝、肾功能不全者;(3) 合并恶性肿瘤、出血性疾病、全身炎症或凝血功能障碍、免疫系统疾病者;(4)不配合采集基线资料或治疗者。本研究经本院医学伦理委员会审核批准,所有受试者自愿参加且签署知情同意书。
1.2方法
1.2.1血清Trx、T-tau水平检测 采集所有受试者接受T-tau静脉溶栓后清晨空腹肘静脉血4 mL,4 ℃、1 000 r/min离心标本15 min,分离血清,移入EP管内,并置于-80 ℃冰箱中冷冻保存。采用酶联免疫吸附试验(ELISA)检测血清Trx、T-tau水平,ELISA按照试剂盒说明书进行操作。
1.2.2收集资料 收集两组受试者一般资料,如性别、年龄、合并症、溶栓时间、梗死体积、美国国立卫生研究院卒中量表(NIHSS)评分、收缩压、舒张压,以及血脂指标[总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)]水平。NIHSS评分0~15分表示轻度损伤,16~30分表示中度损伤,31~45分表示重度损伤[8]。

2 结 果
2.1两组患者一般资料及血脂指标水平比较 两组患者性别、年龄、合并症、发病至溶栓时间、收缩压、舒张压及TC、TG、LDL-C、HDL-C水平比较,差异均无统计学意义(P>0.05);HT组的梗死体积、NIHSS评分明显高于非HT组,差异均有统计学意义(P<0.05)。见表1。

表1 两组患者一般资料及血脂指标水平比较[n/n或或n(%)]
2.2两组患者血清Trx、T-tau水平比较 HT组血清Trx、T-tau水平明显高于非HT组,差异有统计学意义(P<0.05)。见表2。

表2 两组患者血清Trx、T-tau水平比较
2.3多因素Logistic回归分析影响ACI患者溶栓后发生HT的因素 以ACI患者是否发生HT为因变量(发生HT=1,未发生HT=0),以梗死体积(原值输入)、NIHSS评分(原值输入)以及血清Trx(原值输入)、T-tau(原值输入)为自变量,进行多因素Logistic回归分析。结果显示:梗死体积增大、NIHSS评分升高及血清Trx、T-tau水平升高是ACI患者溶栓后发生 HT的独立危险因素(P<0.05)。见表3。
2.4血清Trx、T-tau预测ACI患者溶栓后发生HT的ROC曲线分析 ROC曲线分析显示,血清Trx、T-tau单项检测及联合检测预测ACI患者溶栓后发生HT的曲线下面积(AUC)分别为0.768(95%CI:0.622~0.913)、0.760(95%CI:0.573~0.946)、0.906(95%CI:0.812~0.999),联合检测的AUC明显大于单独检测(P<0.05)。见表4、图1。
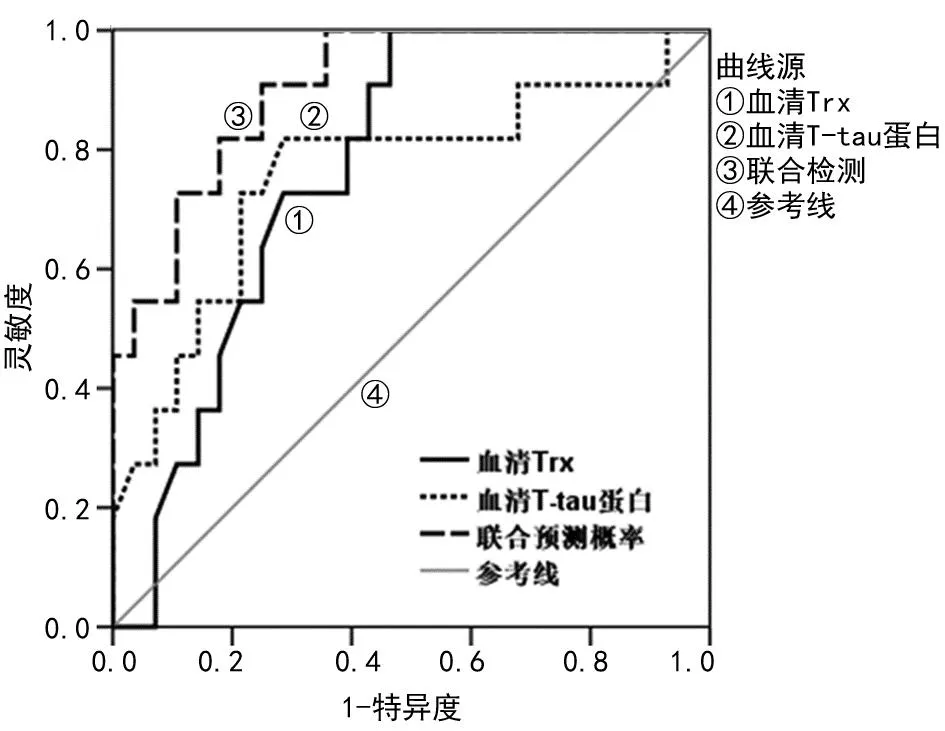
图1 血清Trx、T-tau预测ACI患者溶栓后发生HT的ROC曲线分析

表4 血清Trx、T-tau预测ACI患者溶栓后发生HT的效能分析
3 讨 论
ACI是常见的脑血管病,临床中表现出较高的致残率、致死率,同时其发病率逐年升高。HT为ACI常见并发症,临床发生率可高达40%[9]。溶栓治疗可有效降低ACI患者病死率,早期溶栓能够改善患者预后。与此同时溶栓治疗会影响生理性凝血功能,导致出现HT,加重患者神经功能的损伤,引起不良预后。因此,临床及早准确评估ACI患者HT情况非常重要且必要,有利于为改善患者预后提供科学指导。
本研究回顾性分析了132例ACI患者的一般资料和实验室检查结果,结果显示HT组的梗死体积、NIHSS评分明显高于非HT组。分析认为,NIHSS评分可有效评估脑卒中患者的感觉、意识等状况,NIHSS评分越高,表示患者神经功能受损越严重,其与溶栓后颅内出血关系密切。大面积的梗死病灶会挤压正常的毛细血管,静脉溶栓治疗可消退脑水肿,刺激建立侧支循环,改善神经功能,但当毛细血管受损时极易出现破裂,出血概率将会增加。
脑梗死HT是由于血脑屏障破坏后导致的缺血性脑组织转化为出血性病变,是ACI再灌注治疗后的主要并发症。目前认为ACI溶栓后HT的发生与氧化应激、血脑屏障破坏、凝血功能紊乱、炎症反应等机制有关[10-13]。Trx是一种细胞内抗氧化保护性蛋白,高度保守且广泛表达,具有清除自由基、调节细胞氧化还原活性、抑制细胞凋亡等功能。Trx可通过多种机制对抗氧化应激。本研究结果显示,溶栓后HT组血清Trx水平高于非HT组,原因可能是血清Trx作为抗氧化剂,在氧化应激条件下会迅速增加。tau蛋白水平升高可能是机体对脑环境发生不利改变的一种保护性反应,tau蛋白是一种微管相关蛋白,已被证实与认知功能障碍相关[14-18]。目前关于T-tau与ACI溶栓后HT的相关性研究较少,近年来研究发现低温体外循环术后脑损伤患者多伴有脑脊液中tau蛋白水平的升高,并且tau蛋白升高程度与损伤程度相关。本研究结果显示,溶栓后HT组血清T-tau水平高于非HT组。既往tau蛋白的测定大多通过脑脊液采样,影响其临床应用,血液标本虽特异性不如脑脊液,但创伤性小、采集方便,且既往研究证明,外周血中tau蛋白水平与脑脊液中tau蛋白水平一致性较高[19],因此本研究选择检测血清tau蛋白水平。
综上所述,血清Trx、T-tau水平升高是ACI患者溶栓后发生HT的独立危险因素,血清Trx、T-tau联合检测预测ACI患者溶栓后发生HT的准确性高,临床可据此制订干预措施,以降低HT的发生率。
