新生大鼠缺氧缺血性脑病中miRNA表达谱的改变及分析*
2024-01-03张腾伟肖咏梅彭湘莲
袁 昊,李 婷,张腾伟,肖 娟,杨 刘,黎 巧,阮 滔,朱 昉,肖咏梅,彭湘莲
湖南省妇幼保健院新生儿一科,湖南长沙 410000
新生儿缺氧缺血性脑病(HIE)是指足月和近足月新生儿由于围生期缺氧导致的急性脑损伤。我国报告HIE发生率为活产婴儿的3‰~6‰,其中15%~20%患儿在新生儿期死亡,存活者中有25%~30%可遗留严重的神经功能障碍,包括脑瘫、癫痫、视听障碍、认知障碍、行为异常等,成为影响我国儿童生活质量的重要疾病之一[1-2]。因此,积极研究HIE的发生机制、早期诊断及针对性干预治疗,在临床上具有重大意义。microRNA(miRNA)是一种内源性非编码RNA(由18~23个核苷酸组成),其功能广泛,参与细胞周期、增殖和分化、信号传导和凋亡等过程[3]。有研究证明,许多miRNA在神经系统损伤修复过程中发挥重要的调控作用[4],将成为HIE具有潜力的治疗靶点及有效的生物预测指标。本研究利用基因芯片技术,分析出新生大鼠HIE中差异表达的miRNA,筛选特异性的miRNA,探讨其可能的发生机制,为HIE的机制研究、临床诊断及药物设计提供理论依据和新的治疗思路。
1 材料与方法
1.1实验动物及分组 7 d龄SD大鼠12只,雌雄不限,体质量12~16 g,购自广东省实验动物检测所。随机分为HIE组及假手术对照组,每组6只。
1.2主要材料及仪器 基因芯片筛选miRNA由新开源晶锐(广州)生物医药科技有限公司完成。
1.3方法
1.3.1造模 采用Rice法制作HIE模型:7 d龄SD新生大鼠乙醚吸入麻醉后,仰卧位固定于手术台,消毒切开颈部皮肤,分离左侧颈总动脉并在远、近心端进行双结扎,缝合切口,术后放入37 ℃恒温箱中30 min,以1.5 L/min不断输入含8%氧气和92%氮气的低氧气源2 h。假手术对照组:7 d龄SD新生大鼠只游离左侧颈总动脉穿线但不结扎,缝合伤口后不进行缺氧处理。两组手术时间均低于10 min,环境温度26~28 ℃。造模后观察新生大鼠行为情况。
1.3.2取新生大鼠海马组织 造模后24 h,取海马组织。给予新生大鼠乙醚吸入麻醉,在低温环境下快速断头取脑,冰上分离海马组织。将左右两侧海马放入冻存管中,液氮速冻后放入-80 ℃低温冰箱备用。
1.3.3基因芯片筛选差异性miRNA 取新生大鼠海马组织,采用Trizol法进行样品的总RNA抽提纯化并质检。将提取的总RNA送检,进行微阵列杂交、芯片扫描,利用生物信息软件筛选显著差异的miRNA。本实验采用illumina Hiseq测序平台的单端50 bp测序模式对样本进行高通量测序。原始数据需经过引物与adaptor序列去除,并经过对测序片段碱基的质量检验和长度筛选,最终选择质量可靠的测序片段。将每个样本的reads比对到已有的miRNA数据库(miRBase)和新miRNA预测的结果上,从而计算miRNA表达量。利用DESeq软件进行差异表达分析,筛选差异表达的miRNA,计算每个样本的表达量和组内均值,并且计算组间差异Fold Change,再计算log2(Fold Change)用于后续筛选差异基因。
1.3.4目的基因GO功能集分析及富集分析 将全部基因作为背景列表,目的基因列表作为从背景列表中筛选出来的候选列表,利用Fisher精确检验计算GO功能集在目的基因列表中是否显著富集的P值,再对P值经Benjamini &Hochberg多重检验纠正后得到FDR。针对这些基因进行KEGG数据库中通路的功能注释和归类,以及DisGeNET疾病数据库中疾病类型的功能注释和归类。
1.4统计学处理 利用Seqtk(1.0-r82-dirty)对预处理数据进行质量控制分析。序列比对使用Bowtie(1.0.0)软件分析,采用DESeq软件进行差异表达分析。以P<0.05为差异有统计学意义。
2 结 果
2.1行为学评估 HIE组术后1只新生大鼠表现为持续精神萎靡,其余5只均出现先兴奋后抑制行为:首先躁动不安;术后30 min,出现呼吸增快、站立不稳、全身震颤症状;术后1 h,出现精神萎靡、嗜睡、易激惹、夹尾左旋症状。假手术对照组活动正常。
2.2miRNA检测结果分析
2.2.1测序数据质控 针对每个样本预处理后所有序列和去重复后的唯一序列,分别采用bowtie软件与该物种的参考基因组、Rfam序列数据库、RepBase序列数据库、miRBase数据库进行比对,平均质控率大于89.00%,平均对比率约为47.96%,所获得数据能满足进一步分析要求。
2.2.2差异表达的miRNA 通过比较两组miRNA表达量,利用DESeq软件对两组进行差异表达分析,筛选出共22个表达存在差异的miRNA,HIE组表达上调的miRNA共9个(mmu-miR-215-5p,mmu-miR-1249-3p,mmu-miR-3072-5p,mmu-miR-324-3p,mmu-miR-690,mmu-miR-874-5p,11_10767,11_10888,13_12928_star),表达下调的miRNA共13个(mmu-miR-141-3p,mmu-miR-182-5p,mmu-miR-183-5p,mmu-miR-190a-3p,mmu-miR-200a-3p,mmu-miR-200b-3p,mmu-miR-200c-3p,mmu-miR-429-3p,mmu-miR-455-3p,mmu-miR-760-5p,mmu-miR-96-5p,6_5971_star,9_8784),见图1和表1。当满足P<0.05并且|log2(Fold Change)|≥0.58时,认为该基因表达在组间差异有统计学意义。

表1 HIE组与假手术对照组差异性miRNA筛选
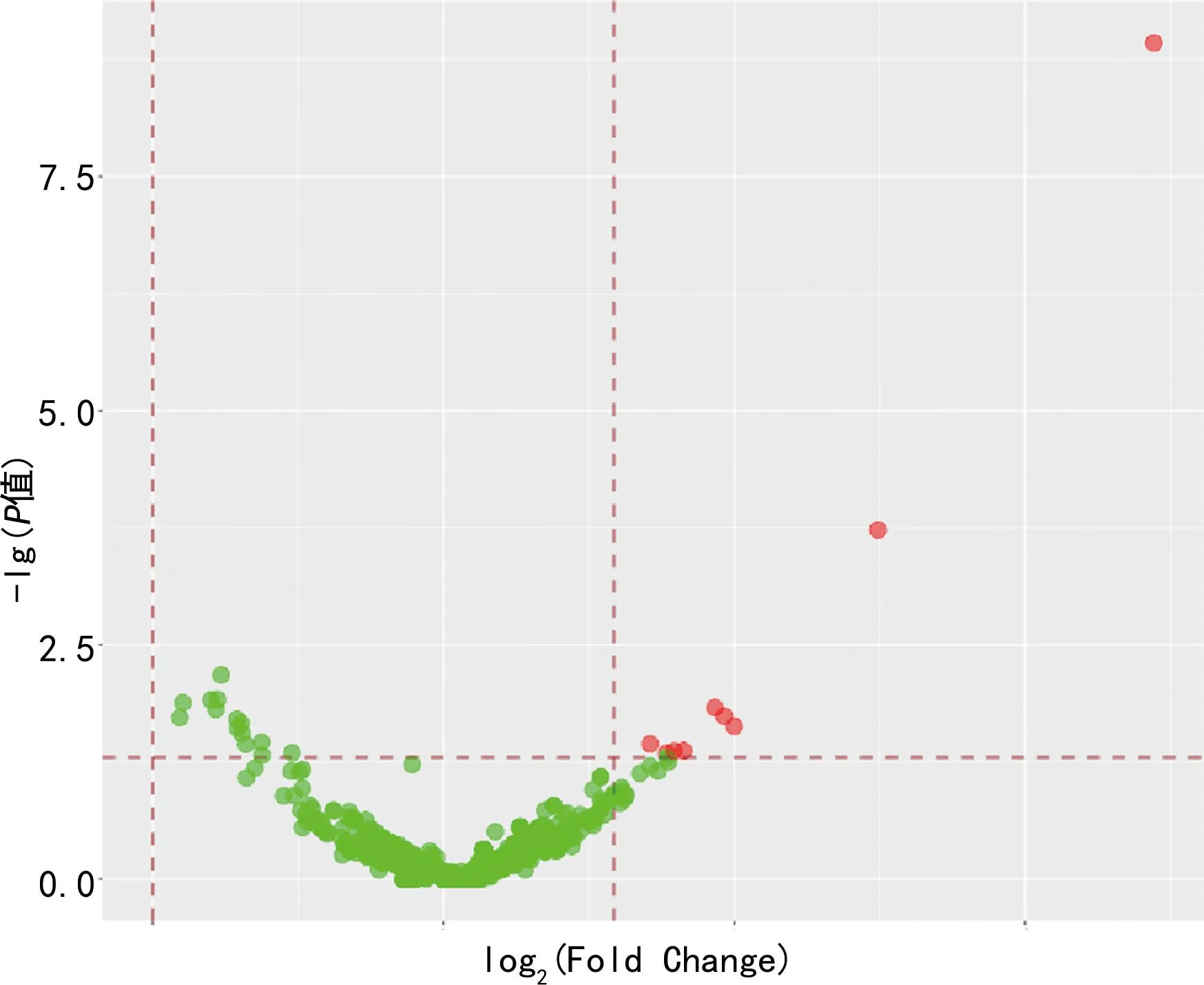
图1 HIE组与假手术对照组对比的火山图
2.2.3差异性miRNA的靶基因预测及富集分析 使用miRanda对差异表达的miRNA进行靶标预测,共得到1 495个靶基因。针对目的基因集,采用TopGO软件进行GO功能分析。图2展示预测靶基因在生物过程、细胞组成、分子功能的前10个最显著的GO。结果显示差异miRNA调控基因在生物过程中主要参与调节生物生长发育、神经元形成与分化过程,在细胞组成中主要与突触发生、突触可塑性有关,在分子功能中调节蛋白结合、酶结合及谷氨酸受体活性等。
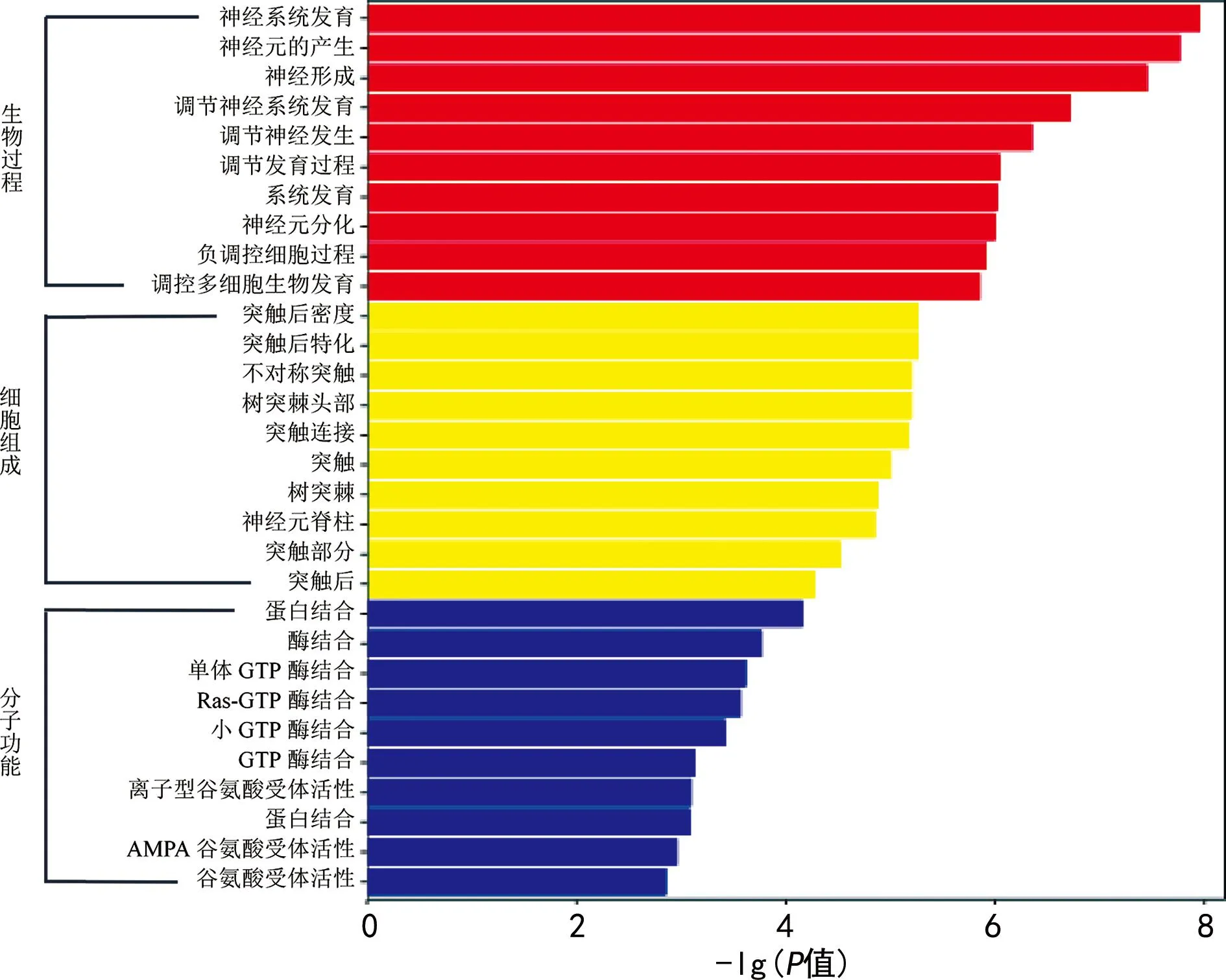
注:横坐标代表-lg(P值),纵坐标代表显著富集的GO名称。图2 显著富集GO柱状图
针对这些基因进行KEGG数据库中通路的功能注释和归类。图3显示富集到的主要通路有丝裂原活化蛋白激酶(MAPK)信号通路、神经节鞘磷脂生物合成、细胞内吞作用等。其中以MAPK信号通路最为显著,HIE组表达上调的11-10767及mmu-miR-874-5p调控的8个靶基因(Braf,Mapt,Ppp5c,Mapk8ip2,Fgf6,Flt1,Ngfr,Tgfb1 )共同参与此信号通路。
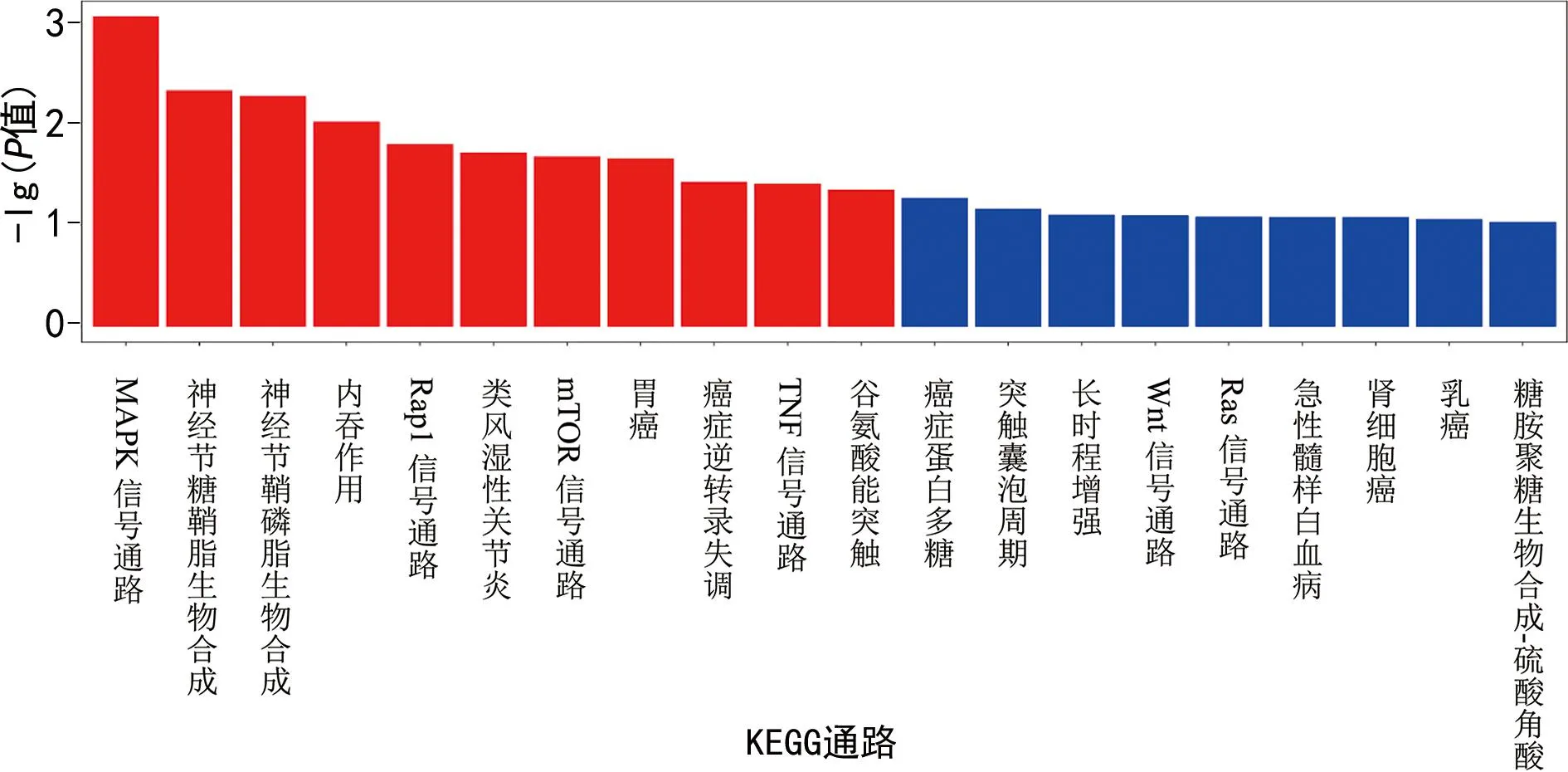
注:横坐标代表显著富集的KEGG通路名称,纵坐标代表-lg(P值)。纵坐标越显著表示该通路越富集显著,红色柱表示显著的通路(P<0.05),蓝色柱表示不显著的通路。图3 显著富集KEGG通路柱状图
3 讨 论
新生儿HIE病理生理改变主要包括脑血流低灌注或过度灌注、脑细胞能力代谢障碍、自由基损伤及神经元坏死或过度凋亡等。临床治疗策略主要通过增加氧分压、维持脑血流灌注等多方法联合治疗,但不能有效阻断神经损伤。如何进行早期诊断及高效治疗,最大程度上减少后遗症发生,是近年来国内外研究热点。miRNA被认为参与多种疾病的发病机制,能够通过转录后调控靶基因的表达来调节不同的细胞过程[5],可用于疾病分子生物诊断、靶向治疗和评估。目前,已有大量研究证明,miRNA在HIE损伤修复过程中发挥重要的调控作用,将有助于新生儿HIE早期诊断、评估预后及靶向治疗[6-7]。
本研究通过构建HIE新生大鼠模型,在HIE发生24 h进行基因测序,共筛选出22个表达差异的miRNA,其中9个表达上调,13个表达下调。通过靶基因预测,将目的基因进行GO功能富集分析,显示调控基因主要涉及调节生物生长发育、神经元形成与分化的过程,促进突触发生。因此,笔者推测在HIE发生脑损伤早期,miRNA大多富集在与神经元功能相关的生物通路中,修复受损神经元。
在HIE表达上调的miRNA中,mmu-miR-215-5p差异倍数最为明显,大量研究认为,其参与调控肿瘤发生、发展。在非小细胞肺癌,miR-215-5p通过调控MAPK/ERK信号通路靶向调节ZEB2表达,参与细胞凋亡及死亡[8]。在恶性胸膜间皮瘤中,miR-215-5p通过激活基因p53功能,参与DNA损伤修复、细胞周期调控、细胞凋亡及抑制血管生成等过程,其低表达与该疾病不良预后有关[9]。在其他肿瘤疾病如乳腺癌、结肠直肠癌、髓系白血病等中均有异常表达[10]。本研究中发现mmu-miR-215-5p表达明显上调,考虑可能参与缺氧缺血损伤后神经元凋亡及死亡的调控机制,需进一步研究验证,其有望成为评估HIE的生物标志物。
在HIE表达下调的miRNA中,miR-200家族最为明显。miR-200家族成员包括miR-200a、miR-200b、miR-200c、miR-141、miR-429,其参与多种疾病的发病机制,包括神经退行性病变、纤维化、肿瘤等[11]。在缺氧缺血发生后,少突胶质前体细胞迅速反应、增殖、迁移到损伤部位,分化为成熟的少突胶质细胞,包绕轴突形成髓鞘,促进神经修复。在脑卒中的研究中发现,miRNA-200过表达可抑制血清反应因子表达,从而抑制少突胶质前体细胞分化[12]。在缺氧研究中发现,抑制miRNA-200表达可诱导内皮细胞血管生成,改善组织缺氧[13]。由此可见,miRNA-200参与神经系统损伤修复的病理过程。本研究发现miRNA-200表达下调,GO功能富集提示主要与神经元形成与分化有关,推测新生大鼠神经系统损伤后,机体修复神经元及促进血管生成,与上述研究结论一致。故本研究认为,miR-200家族有望成为HIE治疗靶点之一。
在HIE中KEGG通路分析结果显示MAPK信号通路激活。MAPK家族主要包括细胞外调节蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38丝裂原活化蛋白激酶(p38MAPK),通过调节细胞内相关基因转录,参与细胞增殖、分化、癌变、转移、凋亡等生理过程,介导生长发育、炎症反应等[14]。研究表明,MAPK参与调节脑缺血再灌注损伤的发生、发展过程,但存在脑保护及脑损伤双重作用[15-16]。本研究发现HIE组表达上调的11-10767及mmu-miR-874-5p调控的8个靶基因(Braf,Mapt,Ppp5c,Mapk8ip2,Fgf6,Flt1,Ngfr,Tgfb1 )共同参与此信号通路,可为治疗靶点提供参考方向。
综上所述,本研究初步筛选出HIE中差异miRNA表达谱,构建靶基因调控网络,提示HIE发生机制复杂多样,需进一步对差异表达的miRNA进行验证、分子机制及信号通路调控的研究。随着不断发现及深入研究miRNA及其靶位点,miRNA在HIE中发挥的作用将逐步被揭开,分子机制也将逐渐阐明。这将为HIE找到新的生物标志物和治疗靶点提供思路及理论基础。
