mRNA疫苗:战胜新型冠状病毒感染的重要突破*
2024-01-03肖子怡吴晓敏曾朝阳王芙艳
肖子怡 吴晓敏 关 凡 曾朝阳 熊 炜 王芙艳*
(1)中南大学基础医学院,长沙 410013;2)中南大学肿瘤研究所,国家卫健委癌变原理重点实验室和教育部癌变与侵袭原理重点实验室,长沙 410078)
疫苗是医学发展史上最杰出的成就之一,是预防传染病最经济最有效的措施。通过激活免疫系统,疫苗使机体建立了对病原体的防御机制。由于疫苗的广泛使用,天花疾病已被消灭,脊髓灰质炎、麻疹和其他儿童疾病的发病率在世界范围内大幅降低[1]。从中国古代的种痘、英国乡村医生Edward Jenner 的牛痘疫苗预防天花到如今的严重急性呼吸综合征冠状病毒2(SARS-CoV-2)疫苗,疫苗由传统的第一代疫苗(灭活疫苗、减毒活疫苗和类毒素)发展至第二代(重组蛋白疫苗、亚单位疫苗)和第三代疫苗(基因疫苗)。2023 年10 月2日,瑞典卡罗琳斯卡医学院宣布将2023 年诺贝尔生理学或医学奖授予匈牙利科学家卡塔琳·卡里科(Katalin Karikó) 和美国科学家德鲁·韦斯曼(Drew Weissman),以表彰他们对于核苷碱基修饰技术的发现,以及德鲁·韦斯曼在递送系统方面的贡献,从而为开发有效的抗SARS-CoV-2 mRNA疫苗所做出的重要贡献。
1798 年, Edward Jenner 提 出 了 疫 苗(vaccination)的概念,开创了人工主动免疫的先河。随着病原菌的发现,法国微生物学家和化学家巴斯德制备了首个减毒狂犬病疫苗,随后,Calmette和Guerin将牛型结核分枝杆菌经过长达13年传代213 代后,将卡介苗(Bacille Calmette-Guerin,BCG) 应用于预防结核病;针对脊髓灰质炎病毒的Salk 疫苗[2]展现了良好的预防效果,但因生产过程中的失误(未被完全灭活)导致了149例小儿麻痹症,却催生了口服减毒疫苗(Sabin疫苗);此外还有麻疹-流行性腮腺炎-风疹三联疫苗、白喉-破伤风类毒素疫苗等。这些第一代传统疫苗通过诱导免疫应答反应,产生针对特定病原体的抗体或效应T 细胞,是预防传染病的有力武器。但由于这些疫苗成分较为复杂,有一定的副反应发生,如减毒活疫苗有毒力回复的风险等。第二代疫苗是由病原体的天然成分或其产物制成的亚单位疫苗和通过基因工程技术制备的重组蛋白疫苗。它们通过特定抗原蛋白而不是完整的病原体来诱导免疫反应,减少了潜在的风险,同时提高了疫苗的免疫效果。如通过DNA 重组技术制备的乙肝疫苗是疫苗发展新的里程碑,标志着疫苗发展进入了分子时代。虽然传统疫苗,如减毒活疫苗、灭活疫苗以及亚单位疫苗,可以对各种传染病提供持久的保护[3]。但对于新发传染病或传染病的大流行,需要更快速的开发和大规模部署,亟需开发新一代疫苗。
第三代疫苗为核酸疫苗,代表了当代疫苗研究的最新进展。这一类疫苗的核心特点是使用核酸分子,如RNA 或DNA,作为构建疫苗的基本材料。这些核酸分子经过精心设计,携带目标病原体的遗传信息。核酸疫苗导入宿主细胞内,内源性表达抗原,可以模拟病原体感染[4]。此外,DNA 或mRNA 疫苗无需专职抗原提呈细胞(antigenpresenting cells,APC)摄取也可表达产生相应蛋白质抗原,刺激B 细胞或T 细胞产生免疫应答反应。核酸疫苗的生产无需在生物安全水平较高的实验室,并且完全无毒性的疫苗成分也利于免疫功能低下人群的疫苗接种[5]。近年来,mRNA 疫苗受到了特别关注,并表现出优于DNA 疫苗的一些优势,例如仅靶向递送至细胞质、消除基因组整合的风险以及独立于细胞分裂发挥其功能[6]。但是RNA 疫苗在生产过程中需要额外的步骤,且其具有高免疫原性,容易在离体和体内降解,而DNA疫苗更热稳定,有利于储存。
正如前文所述,传统的mRNA 疫苗具有一定的免疫原性,因此在注射入体内后,往往会因为激活过度的炎症反应,降低疫苗的效力,同时剧烈的炎症反应还可以对机体造成伤害。然而,卡塔琳·卡里科和德鲁·韦斯曼通过核苷酸修饰技术和RNA 递送系统,使mRNA 疫苗的稳定性和表达量都得到了显著提升。这一技术的突破对于全球范围内对抗COVⅠD-19疫情发挥了重要作用。
1 mRNA在体内表达多肽的关键技术突破
1.1 核苷修饰
早在21 世纪以前,体外合成mRNA 的技术就已经发展起来,但是因为是酶法合成,所以体外转录的mRNA 不仅仅包括目的产物mRNA,还通常含有dsRNA 污染物。目的产物mRNA 具有高免疫原性,作为ssRNA,可以被内体的先天免疫受体Toll 样受体(Toll-like receptor,TLR)7、TLR8 识别(图1)。污染物dsRNA 可以被内体先天免疫受体TLR3、 视 黄 酸 诱 导 蛋 白1 (retinoic acidinducible protein 1,RⅠG-1)、2'-5'-寡腺苷酸合酶(2'-5'-oligoadenylate synthase,OAS)和黑色素瘤分化相关蛋白 5 (melanoma differentiationassociated protein 5,MDA5)识别[7-9]。mRNA 若要成为能够诱导强大免疫反应的疫苗,它需要激活先天免疫和适应性免疫。显然,体外合成的mRNA可以直接激活上述模式识别受体(pattern recognition receptors,PRRs),触发炎症反应,建立先天免疫和适应性免疫之间的联系。这赋予了mRNA“自我佐剂”的特性,这对于它成为高效力的疫苗来说是非常重要的。但事物都具有两面性,拥有“自我佐剂”特性的同时,也意味着先天免疫系统会对mRNA 表现出抗病毒反应[7]。例如,TLR7 和TLR8 的激活会产生大量的Ⅰ型干扰素特别是ⅠFN-α。ⅠFN-α 可以诱导OAS 家族基因的表达,产生以酶原形式存在的寡腺苷酸合成酶,而寡腺苷酸合成酶在dsRNA 的激活下,会催化合成2'-5'寡核苷酸。然后由2'-5'寡核苷酸激活核糖核酸酶RNase L,最后由激活的RNase L 降解外来mRNA[10-13]。
dsRNA 的污染以及mRNA 的高免疫原性使得这些体外合成的mRNA 应用十分局限。针对dsRNA 的污染,可以在合成完成以后采取纯化的方式解决,但仅仅解决这个方面还不足够。体外合成的mRNA 因为高免疫原性,注射进机体就要面临被降解的风险,这显然不符合研究人员预期。面对这样的局面,Karikó 等[14]通过实验发现,体外转录的mRNA 之所以会激活TLR3、TLR7 和TLR8,是因为这些mRNA 缺乏核苷修饰。哺乳动物mRNA 几乎不刺激树突状细胞产生干扰素,是因为哺乳动物mRNA 具有核苷修饰,包括m5C(5-methylcytidine)、m6A (N6-methyladenosine)、m7G (N7-methylguanosine) 和 假 尿 苷(pseudouridine,Ψ)等。当额外加入m5C、m6A、m5U(5-methyluridine)、s2U(2-thiouridine)或者Ψ 时,mRNA 刺激TLR3、TLR7 和TLR8 的能力会被限制。修饰核苷m6A和s2U可以限制TLR3的激活,修饰核苷m6A、m5C、m5U、s2U和假尿苷则可以限制TLR7和TLR8的激活。TLR3、7、8激活被限制之后,Ⅰ型干扰素的分泌大大减少,并且它们可以对RNase L 的切割表现出抗性[12]。这些都解释了为什么1963 年的研究会发现,向动物体内注射用亚硝酸处理过的同源RNA,动物体内均会产生干扰素。这是因为亚硝酸处理后的RNA,尿苷的含量会大大增加,先天免疫的激活也会增强[15]。
除此之外,前面还提及了RⅠG-1,而体外合成mRNA 能和RⅠG-1 相互识别的原因是体外合成mRNA 具有和病毒RNA 一样的结构,也就是5′-三磷酸基团,这个结构在宿主细胞的RNA 中是不存在的,这也是为什么机体能够区分RNA 是否为外来的原因[16]。5'-三磷酸基团可以被RⅠG-1 有效识别,如果想要排除这种因素的干扰,那么在体外酶促合成mRNA 的过程中,可以使用酶法去除5'-三磷酸基团或者使用可以干扰RⅠG-1的病毒蛋白[17]。Karikó等[18]也发现,当在体外合成mRNA的环境中添加修饰核苷s2U 和Ψ 时,RⅠG-1 的激活会被抑制,这也意味着体外mRNA 的免疫原性被进一步降低。Ψ 作为RNA 中丰富的修饰核苷,它的存在不仅仅能够让mRNA 的免疫原性消失,还可以增强mRNA 的翻译。Ψ 可以增强磷酸盐骨架的刚性,Ψ 和腺嘌呤之间的碱基配对强于尿嘧啶和腺嘌呤,同时Ψ 可促进碱基的堆积,进而稳定mRNA 的二级结构,此外翻译的增强可以通过保护具有高核糖体占有率的mRNA来使mRNA稳定性提高[14,18-20]。2010年Anderson等[21]通过实验证明,含有尿苷的mRNA 可以激活RNA 依赖性蛋白激酶(protein kinase,PKR),激活后的PKR 会磷酸化翻译起始因子2的α亚基,最后导致翻译的抑制。而当尿苷被假尿苷取代时,mRNA 的翻译水平明显提高。这说明了与尿苷相比,假尿苷激活PKR 的程度非常小。此外,Andries 等[22]在2015 年的研究中发现,由m1Ψ(N1-methylpseudouridine)和m5C 修饰的mRNA 基因表达的效率高于由Ψ 和m5C 修饰的mRNA,而这可能与m1Ψ 和m5C 修饰的mRNA能够更有效地逃避TLR 识别有关,因此,m1Ψ 在mRNA 中的应用也越来越广泛。受自身RNA 在机体内不会被降解和病毒、细菌RNA 对人体的外源性的启发,研究人员发现了假尿苷修饰和其他核苷修饰的优势。通过核苷修饰,同时根据不同治疗目的控制mRNA 的免疫原性,让mRNA 疫苗的免疫原性处在一个相对平衡的位置,可以恰当地激活先天免疫和适应性免疫,降低机体对它表现出的抗病毒反应。
1.2 mRNA的体外合成
除了理论的进步,技术的进步也在为mRNA疫苗的诞生奠定基础。特别是前面提到的体外转录(in vitrotranscribed,ⅠVT)mRNA技术的进步,体外合成的mRNA可以通过模拟天然mRNA的结构,在核苷修饰的帮助下,在机体内瞬时表达蛋白质,发挥作用[23]。那么想要了解ⅠVT mRNA 的大规模产生,首先需要了解的是天然mRNA 具有什么样的结构。mRNA由5个关键结构元件构成:5' cap、5'非翻译区(5' untranslated regions,5' UTR)、编码序列(coding sequence region,CDS)、3'非翻译区(3' untranslated regions,3' UTR) 和poly(A)尾[24]。m7G 通 过5'-5'三 磷 酸 桥(ppp) 连 接 到mRNA的5',进而形成mRNA5' m7G帽的结构[25]。5' m7G 帽不仅介导真核翻译起始因子4E
(eukaryotic translation initiation factor 4E,elF4E)的结合,募集起始复合体启动帽依赖性翻译,而且可以保护mRNA,让mRNA免受5'-3'核酸外切酶的降解,使其可以稳定地在细胞质中进行翻译[18,24,26-27]。5' UTR 是核糖体启动翻译的起始位点,优化它可以提高mRNA 的稳定性,提高翻译效 率[24,28]。3' UTR 可 以 与miRNA 结 合,沉 默mRNA 的表达,若想增强mRNA 的表达,可以减短3' UTR[24]。同时它还可以稳定poly(A)结合蛋白与poly(A)尾的结合,防止mRNA 的脱多聚腺苷酸化[26]。开放阅读框(open reading frame,ORF)碱基的组成以及密码子的使用也会影响mRNA 的翻译活性和稳定性[24,26-27]。作为mRNA的最后一个元件,poly(A)尾的3'端有长的重复腺苷核苷酸。通过与poly(A)结合蛋白结合,它可以保护mRNA 免受3'-5'核酸酶的降解[24,26-27]。蛋白质表达的细胞类型,以及不同的mRNA 可能都会影响poly(A)尾长度的选择[24,26]。此外富含AU 序列的mRNA 促进二级结构的形成,会阻碍核糖体和其他调节因子的结合,控制基因的表达[24,29]。若mRNA 富含GC,该mRNA 的翻译效率会比富含AU 时高。GC 的增加,会让尿苷碱基的数量减少,那么TLR7/8 的激活也会减少,这与mRNA 的免疫原性降低密切相关,说明除了通过碱基修饰的途径以外,增加GC含量也是降低免疫原性的一个可行策略[24,29-31]。
设计和构建DNA 模板是制备mRNA 的第一步。该DNA 模板至少需要4 个元件:噬菌体启动子、UTR、ORF和poly(T)序列[26](图2)。为了提高mRNA 的表达和稳定性,在构建DNA 模板时,就应该对每一个元件进行相应的优化。体外转录反应的原料包括核糖核苷三磷酸、RNA 聚合酶和构建好的DNA 模板。针对前面提到的5' m7G帽,可以通过使用封端酶进行转录后修饰来封端,也可以通过在体外转录过程中添加封端类似物来封端[32]。所以如果采取的是共转录封端,那么帽类似物也应该作为原料出现在反应溶液中。针对poly(A)尾,同样具有两种策略,第一种是通过酶促反应将poly(A)尾添加到ⅠVT mRNA,第二种是通过在体外转录前将poly(T)添加到DNA 模板中,也就是本文中提到的构建DNA 模板的4 种基本原料之一。第二种方式得到的poly(A)尾通常比较均匀,并且它允许批量控制poly(A)尾mRNA的合成[26,33]。在ⅠVT过程中添加的核苷酸包括化学修饰核苷和未修饰核苷,具体的比例是可以调节的[26],使用的化学修饰核苷通常是m1Ψ和Ψ。体外转录完成以后,要进行纯化,去除残留在反应溶液中的核苷酸、酶、dsRNA和DNA模板等[26]。特别是dsRNA,其可以有效激活TLR3,引起免疫应答。针对大规模的纯化,目前最常用的方法是高效液相色谱法(high performance liquid chromatography,HPLC)。2011 年,Karikó 等[34]经过实验证明,使用HPLC纯化的mRNA可以降低其免疫原性,并且HPLC还能改善核苷修饰过的mRNA 的翻译效率。2019 年针对dsRNA的去除,Baiersdörfer等[35]又提出了纤维素色谱法,原理便是在含有乙醇的缓冲液中让dsRNA 与传统纤维素粉末选择性结合。这种方法与HPLC 比较起来,更加简单,且不需要特殊设备,成本更低,对于大规模生产有重要意义。纯化完成以后,ⅠVT mRNA的合成就完成了,通过这些步骤大规模生产的mRNA 可以根据开发者的目的去完成下一阶段的使用。
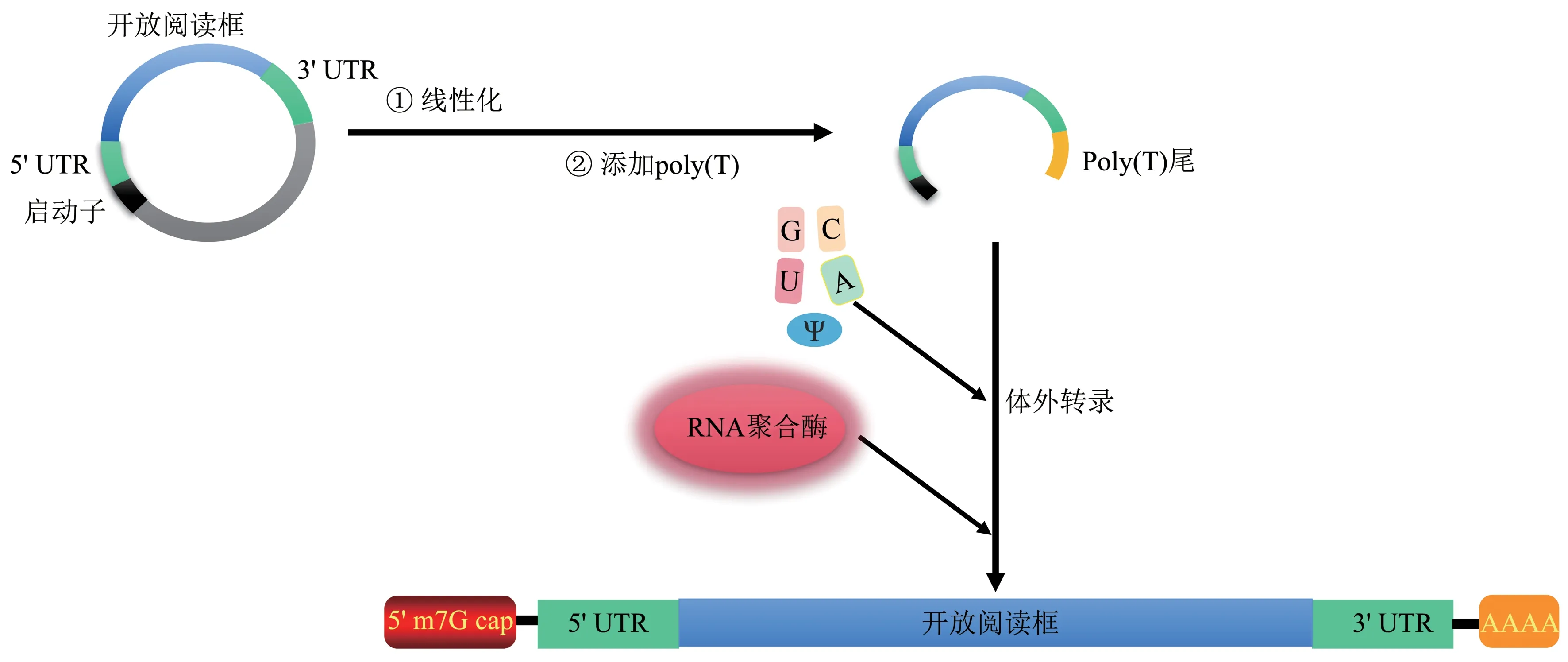
Fig.2 mRNA synthesis process in vitro图2 体外合成mRNA流程
2 mRNA疫苗的递送系统
2.1 脂质体纳米颗粒(LNPs)
正如Pardi 等[36]所描述,研发mRNA 疫苗需要克服4个障碍,提高翻译效率、提高mRNA稳定性、降低免疫原性、提高体内递送效率。前文已经提到,前面3个障碍可以通过序列优化、掺入修饰核苷、纯化解决。细胞摄取裸核酸的过程非常低效,mRNA 疫苗成功的最后障碍便是提高体内胞质递送效率[37]。针对基因疫苗存在的递送系统包括质粒DNA、病毒载体、胞内菌等[38],这对于mRNA 疫苗递送系统的研发提供了借鉴的例子。目前,针对mRNA 疫苗的递送系统可分为病毒和非病毒载体递送系统。针对病毒载体,可以将mRNA包装成RNA病毒[39],但是通过这种方式转染后的mRNA 表达难以控制,而且无论是时间成本还是经济成本都比较高[40],不适合需要大规模生产的mRNA 疫苗。非病毒载体递送系统,包括脂质或脂质材料以及聚合物递送系统等,其中脂质或脂质材料又包括脂质体复合物和脂质体纳米颗粒(liposome nanoparticles,LNPs)。脂质体复合物是由带正电荷的阳离子脂质和带负电荷的mRNA 通过静电相互作用聚集形成的多层囊性复合物。常见的聚合物递送系统包括聚酰胺胺(poly-amidoamine,PAMAM)、聚β 氨基酯(poly-beta aminoesters,PBAEs)和聚乙烯亚胺(polyethylenimine,PEⅠ)[41]。
递送系统有很多,但作为目前应用最广泛的LNPs递送脱颖而出。LNPs最初是用于siRNA的递送,但2015年Pardi等[36]通过实验证实了LNPs在mRNA 递送方面的卓越能力。LNPs 的主要成分包括可电离脂质、 磷脂酰胆碱(distearoyl phosphatidylcholine,DSPC)、胆固醇、PEG-脂质[42-43](图3)。可电离脂质在生理pH 下显中性,可以消除循环中的阳离子电荷,在酸性条件下会在内体中被质子化,促进内体释放。磷脂酰胆碱则有助于在PEG 表面下形成稳定的双层结构。胆固醇可以填补颗粒间隙,限制LNPs 与蛋白质的相互作用,促进膜融合[43]。LNP mRNA 的形成以及递送过程如下:先在pH 为4 的缓冲液中快速混合含有疏水性脂质的乙醇相和含有mRNA 的水相。溶液一旦混合,pH 会接近5.5,会让可电离脂质质子化,可电离脂质会结合mRNA的阴离子磷酸骨架,包绕在mRNA 周围,同时两者在水相中会具有疏水性,可以驱动囊泡形成和mRNA 封装。囊泡形成以后在溶液的稀释下,可电离脂质表面会在生理pH 下恢复为中性,变得更加疏水,从而驱动囊泡融合。此时可电离脂质与mRNA 进一步深入颗粒内部,两者形成电子致密的核心。亲水的PEG 会包裹颗粒,并且决定颗粒最后的尺寸大小。PEG-脂质不会让囊泡过度融合。前面提到的DSPC双层也位于PEG-脂质的下方。注意快速混合才可以将得到的颗粒尺寸限制在<100 nm,同时溶液中LNPs的组装和形成靠的是疏水力和静电力[42-45]。当LNP mRNA 被细胞内吞并在内体内被螯合和酸化时,可电离的脂质会带正电,接着与内涵体膜融合,将mRNA 释放到细胞质中[46]。到达细胞质后会在核糖体翻译成蛋白质,蛋白质作为内源性抗原被蛋白酶体降解成抗原肽。这些抗原肽通过主要组织相容性复合体 (major histocompatibility complex,MHC)Ⅰ类分子途径呈递给CD8+细胞毒性T 细胞,激活细胞介导的免疫反应,从而构成mRNA疫苗的关键优势。此外,翻译出的蛋白质可以分泌到细胞外环境中,从而进入循环系统,在循环系统中被APC 摄取。抗原肽作为外源性抗原通过MHC-ⅠⅠ类分子被提呈给CD4+T 细胞,通过分泌细胞因子诱导细胞免疫应答,激活B细胞产生高亲和力的病毒中和抗体,发挥体液免疫效应[47]。针对研制好的mRNA 疫苗的储存,Muramatsu 等[45]发现,冻干可以为mRNA 疫苗提供长期稳定性,并且冻干的mRNA 疫苗在室温下可储存12 周,在4℃条件下可以储存24周。这项发现对于疫苗的全球分发具有重要意义。Han 等[48]还开发了一种佐剂脂质体,它不仅可以作为LNPs 的结构成分,还可以发挥佐剂的效应,使得注射了LNP mRNA 疫苗的机体产生更有效的适应性免疫应答。
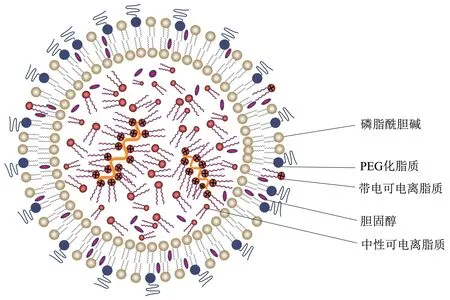
Fig.3 LNPs structure diagram图3 LNPs结构图
2.2 单组分可电离两亲性Janus树状大分子可靶向和均匀分布地向器官递送mRNA
尽管LNPs 递送已经应用于生产SARS-CoV-2疫苗,德鲁·韦斯曼和他的团队仍然在开发新的递送系统。毕竟LNPs 递送确实也存在不足,LNP mRNA的生成需要复杂的微流体技术,作为四组分的一个载体,四组分在LNPs 中的分布未知。与LNPs 结合的PEG 会增加LNPs 在血液的循环时间,会导致基因表达降级[49],所以递送的技术确实还有上升的空间。就在2021 年,Zhang 等[49]开发了一种单组分多功能可电离两亲性Janus 树状大分子(ionizable amphiphilic Janus dendrimer,ⅠAJD) 的递送系统。这个系统依赖由他们实验室开发的可电离两亲性Janus 树状大分子(Janus dendrimers,JDs) 和 糖 树 状 大 分 子(Janus glycodendrimers,JGD)。两亲性Janus树状大分子由功能性亲水性和疏水性树状分子结合而成。ⅠAJDs与mRNA可以共组装成树状大分子纳米颗粒(dendrimersome nanoparticles,DNPs),和LNPs 相比,DNPs 的合成更加简单,只需在乙酸盐缓冲液中简单注射即可[50]。虽然最开始的单组分ⅠAJD需要14步才能合成,但是Zhang等[50]通过消除连接在JD亲水性片段分支点上的甲氧基三乙二醇片段减少了构建ⅠAJDs 的步骤,大大提高了效率。同时和LNPs 相比,DNP 还可以更好地实现靶向递送的功能。Zhang 等[51]通过使用不同的烷基长度设计ⅠAJDs疏水区,发现mRNA 靶向递送的效率大大提高。筛选文库产生的一级结构分析还证明ⅠAJDs的亲水部分可以通过其电离胺的结构和序列决定靶器官,羟乙基哌嗪有利于靶向脾脏,甲基哌嗪有助于靶向肝脏,哌啶和二甲胺则有利于输送到肺部[52]。这些意味着ⅠAJDs 疏水区的一级结构具有重要的作用,所以选择合适的烷基长度、电离胺的结构和序列对于不同靶器官疫苗的研发有着重要的启示。
3 SARS-CoV-2 mRNA疫苗
SARS-CoV-2 是 一 种 正 链RNA 病 毒[53]。SARS-CoV-2基因组的长度约为30 kb,它至少编码29 个蛋白质,包括16 个非结构蛋白(NSP)、4 个结构蛋白和9个辅助蛋白[54]。4种结构蛋白包括刺突蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N)[47]。mRNA 疫苗将基于LNPs 疫苗载体的mRNA 传递给APC[55]。在内体内的酸性环境中,可电离脂质的头基被质子化到阳离子状态。在吸引并结合内膜磷脂的阴离子头基后,阳离子脂和磷脂的疏水尾部膨胀,稳定的磷脂双层结构被破坏,这反过来允许mRNA 逃逸内体,到达细胞质室并被核糖体翻译成蛋白质,作为内源性抗原被蛋白酶体降解成抗原肽。LNP-mRNA 疫苗中可电离的脂质组分和ⅠL-6细胞因子能诱导佐剂活性,这种由LNPs 驱动的佐剂活性可诱导强大的Tfh 细胞反应和体液免疫,从而增强基于mRNA 疫苗的效力[55]。
SARS-CoV-2 表面的三聚体S 蛋白在介导宿主细胞侵袭中起关键作用。因此,S蛋白被认为是疫苗设计的主要抗原[47]。目前,设计针对SARSCoV-2 S蛋白的疫苗通常采用两种策略:2P突变和S1/S2 裂 解 位 点。BioNTech 生 产 的BNT162b2 疫 苗和Moderna 生产的mRNA-1273 均是使用2P 突变策略。采用该策略,将S2 亚单位中心螺旋位置顶部的两个氨基酸替换为脯氨酸(K986P 和V987P),有效地提高了S蛋白在融合前构象中的稳定性。由Moderna 研发的mRNA1273 编码SARS-CoV-2 的全长预融合刺突蛋白,是基于南非首次发现的SARSCoV-2 Beta 变种开发的。疫苗有效率为94.1%,在青少年和成人中普遍具有良好的有效性、耐受性和安全性。mRNA-1273 对Alpha 和Beta 变体的有效性分别为100%和96.4%,而对Delta的有效性略低(73.1%)。有数据显示,接种三剂mRNA-1273 可提供对Delta 感染的高而持久的保护(95.2%),但对Omicron 的保护较低(62.5%)。BioNTech 研发的疫苗是基于核苷修饰的基因BNT162b2编码一个全长的峰糖蛋白,BNT162b1 编码三聚体峰蛋白RBD 的分泌形式。跨膜预融合峰(BNT162b2)、分泌型峰RBD(BNT162b1)疫苗提供的保护率为95.6%,带有BNT162b2 的疫苗增强剂可以增强Omicron 变体的中和作用[47]。根据一项以色列的研究数据,BNT162b2作为两剂计划的疫苗有效性为94%。然而,有证据表明,该疫苗与心肌炎风险的增加有关[56],其聚乙二醇添加剂也可能诱发过敏反应[57]。
4 展 望
mRNA 疫苗具有高效、快速开发、低成本生产和安全使用的潜力。目前mRNA 的测序和合成技术已经十分成熟,可以根据变异毒株快速对其mRNA 进行测序并合成相应的mRNA,经过核苷酸修饰和LNPs 的递送迅速发挥强大的免疫作用。但同时也存在许多问题,如疫苗接种会有不良反应,包括罕见的过敏反应和急性心包炎等[58]。且mRNA 对核酸外切酶具有较高的敏感性,对生产要求较高,需要在超低温条件下运输和储存mRNA 疫苗,mRNA 疫苗的稳定性和递送体系有待进一步探索和优化[47]。本文认为对mRNA 序列再进行更加细致的优化也许可以进一步提高其稳定性。也可以考虑修改其他辅助脂质成分或mRNALNPs 的结构或使用HPLC、快速蛋白质液相色谱(fast protein liquid chromatography,FPLC)、寡聚(DT) 纯化、切向流动过滤(tangential flow filtration,TFF) 等 方 式 进 一 步 改 善mRNA 的质量[55]。
无论是什么类型的疫苗,注射进入机体后,机体都会针对疫苗所包含的或者编码的抗原做出免疫应答。既然mRNA 疫苗可以用于预防传染病的感染,那么同理,针对肿瘤,也可以研发相应的mRNA 疫苗,mRNA 疫苗可以通过编码肿瘤相关抗原(tumor associated antigen,TAA)或者个性化新抗原(personalized neoantigens)来激活机体内的抗肿瘤免疫反应,诱导强大的细胞毒性CD8+T细胞来杀死癌细胞[59-60]。在肿瘤生长的过程中,肿瘤细胞会产生血管内皮生长因子(vascular endothelial growth factor,VEGF),诱导新生血管的生成[61]。因此,也可以通过合成能够编码抗VEGF抗体的mRNA,注射到患者体内,抑制肿瘤血管生成,最终达到抑制肿瘤生长的目的。针对VEGF,德 鲁·韦 斯 曼 团 队[62-63]已 经 发 现,VEGFA mRNA 可以促进胆管上皮向肝细胞转化,逆转脂肪变性和纤维化,核苷修饰的VEGFC mRNA 可以诱导器官特异性淋巴生长并且逆转实验性淋巴水肿。
mRNA 在再生医学中也具有巨大的应用潜力。再生医学的目的是为了创造、补充丢失的细胞、组织或者器官。再生医学的实现离不开功能蛋白质,包括生长因子、细胞因子和转录因子。可以将编码功能蛋白质的mRNA 递送到体内,翻译后产生功能蛋白质发挥相应的功能。直接注射功能蛋白质,会引起结构变形影响活性,但使用mRNA 就可以克服这一缺点,提高治疗效率[26]。当前的基因治疗多是通过递送正常的基因来替换有缺陷的基因,但无论是病毒介导的还是质粒DNA 的基因递送都各有缺陷。在这样一个阶段,mRNA 也为基因治疗带来了新的希望,mRNA 可以避免不必要的插入,具有更高的转染效率和稳定性[64]。
mRNA 对核酸外切酶具有较高的敏感性,且需要核苷酸修饰来提高其稳定性和降低免疫原性,对生产要求较高[65]。而环状RNA(circular RNA,circRNA)是一类没有5'或3'端的天然(生物)或合成的闭合RNA,由于其独特的环状结构不会被核酸外切酶降解而具有高度的稳定性,它们相对于目前的线性mRNA 具有更高的药物稳定性和生物稳定性[66]。并且circRNAs 能够通过滚环翻译产生不同大小的蛋白质,也可以利用有限的核苷酸序列来翻译更大的蛋白质[67]。有研究表明,对于SARS-CoV-2,circRNA 疫苗通过表达S 蛋白的三聚体RBD 诱导了强大的中和抗体和T 细胞反应,比m1ψ 修饰的mRNA 疫苗能够产生更高和更持久的抗原,并引发更高比例的中和抗体和明显的Th1扭曲免疫反应[68]。2022 年清华大学的一项研究表明,circRNA具有相对线性RNA较弱的免疫原性,能够同时作为免疫原和佐剂[69]诱导抗原特异性T细胞活化、抗体产生和抗肿瘤免疫。m6A RNA 对circRNA的修饰能够抑制先天性免疫,使其免疫基因激活和佐剂活性丧失[66]。在B16 原位黑色素瘤小鼠实验中发现, circRNA-LNPs 疫苗使SⅠⅠNFEKL-MHC-Ⅰ四聚体阳性细胞毒性T细胞的频率显著增加,表明其引发了强大的抗原特异性T细胞反应;进一步的研究发现,circRNA-LNPs 极大地抑制了免疫排斥肿瘤的进展,诱导免疫沙漠肿瘤的完全消退,并防止癌细胞转移,这表明癌症RNA 疫苗的有效性[70]。虽然目前技术还不成熟,可能会导致抗原或蛋白质积累失控[67]等后果,但circRNAs作为一种工具来编程抗原特异性T细胞反应,结合了编程简单、持久的抗原表达和安全给药的特点[69],其良好的特性很有可能推动传染病和癌症免疫治疗疫苗的突破性发展。
卡塔琳·卡里科和德鲁·韦斯曼开辟的mRNA核苷酸修饰技术奠定了mRNA 疫苗体系建立的基础,在COVⅠD-19疫情的严峻挑战中mRNA疫苗被迅速制造并取得了完整的胜利,他们的突破性发现从根本上改变了人们对mRNA 如何与免疫系统相互作用的理解,为疫苗的变革性发展做出了巨大贡献。
猜你喜欢
杂志排行
生物化学与生物物理进展的其它文章
- 光泵磁强计双轴探测听觉诱发脑磁信号的初步探索*
- Optically Pumped Magnetometer Lights up The Era of Vector Detection for Magnetoencephalography:an Experimental Evidence
- Prediction of m6A Methylation Sites in Mammalian Tissues Based on a Double-layer BiGRU Network*
- 人乳寡糖的结构及其分离分析*
- TRPM7生理病理学功能及其小分子调节剂的发现*
- GSDMs家族蛋白介导细胞焦亡在抗肿瘤免疫中的作用*