氯巴占片在中国健康成年受试者中的生物等效性研究
2024-01-02张学农王燕燕李莉娥张敏宋俐萍易梦娟吴先迪游辉
张学农,王燕燕,李莉娥,张敏,宋俐萍,易梦娟,吴先迪,游辉
(1.三峡大学第一临床医学院·宜昌市中心人民医院药学部,宜昌 443003;2.宜昌人福药业有限责任公司,宜昌 443003)
Lennox-Gastaut综合征(lennox-gastaut syndrome,LGS)是一种难治性癫痫综合征,除对因治疗外,最重要的是抗癫痫治疗。氯巴占是一种合成的1,5-苯二氮芯卓类药物,1975年作为抗焦虑药上市,此后不久被发现具有抗癫痫作用[1]。美国食品药品管理局(the US Food and Drug Administration,FDA)于2011年10月批准了氯巴占用于成人和年龄≥2岁的儿童期LGS患者癫痫发作的联合用药;在许多国家,氯巴占已被作为治疗包括LGS在内的儿科癫痫的一线药物[2]。
在我国,氯巴占属于第二类精神药品,需进行严格管理。虽然2017年国内公布的《第二批鼓励研发申报儿童药品建议清单》中纳入氯巴占,鼓励氯巴占制剂在国内的仿制研发,但直到2022年上半年,我国既无氯巴占进口药品上市,也无氯巴占仿制药品上市。因此,关于氯巴占在中国健康受试者中的药物代谢动力学相关研究报道较少。受宜昌人福药业有限责任公司委托,宜昌市中心人民医院I期临床试验研究室于2021年12月至2022年1月开展了国产与原研氯巴占片的人体生物等效性研究,现报道如下。
1 对象与方法
1.1试验药物 氯巴占片受试制剂(T),规格:20 mg,批号:YF55210502,含量:99.9%,有效期至:2025年4月,宜昌人福药业有限责任公司;氯巴占片参比制剂(R),商品名:ONFI®,规格:20 mg,批号:3279600A,含量:100.2%,有效期至:2022年5月,Catalant pharma solutions.LLC,宜昌人福药业有限责任公司提供。
1.2研究对象 本研究拟入组中国健康志愿者64例,其中空腹研究34例、餐后研究30例。主要入选标准:①年龄为18~55周岁男性和女性受试者;②男性受试者体质量不低于50 kg,女性受试者体质量不低于45 kg;③身体质量指数(body mass index,BMI)在19.0~26.0 kg(m2)-1。主要排除标准:①体格检查、生命体征、心电图、临床实验室检查等异常且经研究医生判断有临床意义者;②有严重疾病史者;③有药物过敏史或过敏体质者;④有药物滥用、酗酒或嗜烟者;⑤不能耐受静脉穿刺或晕血、晕针者;⑥试验前3个月献血者;⑦近14 d使用任何药物者;⑧近3个月参加其他临床试验者。本研究已取得国家药品监督管理局药物临床试验批准通知书(编号2021LP00148),药物临床试验登记与信息公示平台登记号为CTR20212387;经宜昌市中心人民医院临床试验伦理委员会审查(批号:2021-040-01)通过后开展,所有受试者在试验前均经过知情同意并自愿签署知情同意书。
1.3试验设计 参考国家药品监督管理局发布的《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》和原研氯巴占片药品说明书,本研究采用单中心、开放、随机、单剂量、两周期、两序列、双交叉试验设计。假设氯巴占PK参数个体内变异系数为20%,单侧α=0.05,β=0.1,受试制剂和参比制剂的几何均值比值=0.95~1.05,计算有效样本量为25例,考虑脱落率等因素,计划空腹研究入组34例、餐后研究入组30例受试者。所有受试者均随机分为两组(TR组和RT组),每周期在空腹或餐后状态下分别口服氯巴占片受试制剂或参比制剂一片(20 mg)。根据原研氯巴占药品说明书,氯巴占的活性代谢产物N-去甲基氯巴占体内平均消除半衰期较长(71~82 h),故清洗期(给药间隔)设定为28 d[3-4]。
受试者应于每周期给药前1天入住Ⅰ期病房,统一饮食和作息,晚餐后禁食不禁水10 h,给药前1 h禁水。给药当天,空腹研究受试者空腹10 h以上,在空腹状态下用240 mL温水送服相应研究药物;餐后研究受试者在服药前30 min进食一份高脂(提供食物中约50%的热量)高热量(3 344~4 180 kJ)标准餐,且需在30 min内食用完毕,之后在餐后状态下用240 mL温水送服相应研究药物。受试者服药后1 h内禁水,4 h后进食午餐。28 d后交叉给药进行第二周期研究,第二周期的服药时间及饮食饮水管理同第一周期保持一致。
1.4血液样本采集与处理 每周期给药0 h(给药前60 min内)和给药后0.33、0.67、1、1.33、1.67、2、2.33、2.67、3、3.33、3.67、4、4.5、5、6、12、24、36、48、72、96、144、192 h共24个时间点在受试者上肢采集静脉血,每次取血约4 mL至含EDTA-K2抗凝剂的真空采血管中,轻柔颠倒混匀后置于低温离心机(设置温度4 ℃),以2 000×g离心10 min,取上层血浆置于冻存管,在超低温冰箱中冻存待测。
1.5药物浓度检测与生物等效性评价 将冻存血浆样本经干冰冷链物流转运至第三方专业生物样本分析与检测单位,采用其自行开发验证的氯巴占及N-去甲基氯巴占血药浓度检测方法,使用液质联用仪(LC-MS/MS)对血浆样品中的氯巴占和N-去甲基氯巴占浓度进行分析测定。以时间为横坐标,血浆中氯巴占浓度为纵坐标,绘制氯巴占血药浓度-时间曲线和血药浓度-时间曲线半对数图。
参照国家药品监督管理局发布的《生物等效性研究的统计学指导原则》[5],将可纳入药动学参数集(PKPS)的受试者数据,采用Phoenix WinNonlin软件(8.3.4版本)进行非房室模型药动学(PK)参数的估算分析,计算氯巴占和N-去甲基氯巴占的PK参数:峰浓度(Cmax),血药浓度-时间曲线下面积(从0时至最后一个浓度可准确测定的样品采集时间t的AUC0-t和从0时至无限时间的AUC0-∞),达峰时间(Tmax)和消除半衰期(t1/2)。
根据美国FDA发布的氯巴占片《仿制药开发个药指导原则》[6],氯巴占片生物等效性研究需检测氯巴占及其活性代谢产物N-去甲基氯巴占的血药浓度,但等效性评价仅基于氯巴占的主要PK参数,即氯巴占的AUC0-t、AUC0-∞和Cmax。当氯巴占受试制剂和参比制剂的Cmax、AUC0-t、AUC0-∞几何均值比的90%置信区间(CI)在80.00%~125.00%范围内,则可判断两制剂生物等效。
1.6安全性评价 通过对受试者的生命体征监测、体格检查、实验室检查(血常规、血生化、尿常规、凝血功能)、12导联心电图(ECG)检查等,观察受试者在试验期间发生的不良事件(AE)或严重不良事件(SAE),并判断其与试验药物的相关性,从而评价口服氯巴占片在健康受试者中的安全性。
2 结果
2.1受试者一般资料 根据试验的入选标准和排除标准,空腹研究入组34例健康受试者,餐后研究入组30例健康受试者。空腹研究受试者中,男20例,女14例;年龄为(28.4±7.33)周岁,身高为(164.24±7.56) cm,体质量为(60.99±7.14) kg,BMI为(22.58±1.655) kg·(m2)-1。餐后研究受试者中,男22例,女8例;年龄为(24.6±4.83)周岁,身高为(166.37±8.08)cm,体质量为(61.70±6.93) kg,BMI为(22.28±1.862) kg·(m2)-1。空腹研究和餐后研究各有2例受试者提前退出,未完成全部研究。
2.2氯巴占和N-去甲基氯巴占血药浓度-时间曲线 本项目的样本检测单位建立了氯巴占和N-去甲基氯巴占血药浓度检测方法,并对其专属性、线性范围与定量下限、精密度及准确度、基质效应和样品稳定性等方面进行考察,结果表明其建立的检测方法专属性好、精密度和准确度等均符合相关要求;氯巴占线性范围3.00~1 200 ng·mL-1、定量下限3.00 ng·mL-1,N-去甲基氯巴占线性范围1.00 ng·mL-1至400 ng·mL-1、定量下限1.00 ng·mL-1。
健康受试者单次口服氯巴占片受试制剂或参比制剂20 mg后,空腹组受试者血浆中氯巴占的平均药物浓度-时间曲线及其半对数曲线如图1所示,餐后组受试者血浆中氯巴占的平均药物浓度-时间曲线及其半对数曲线如图2所示;空腹组N-去甲基氯巴占的平均药物浓度-时间曲线及其半对数曲线如图3所示,餐后组N-去甲基氯巴占的平均药物浓度-时间曲线及其半对数曲线如图4所示。由图可见,空腹和餐后状态下两种制剂的氯巴占和N-去甲基氯巴占的血药浓度-时间曲线变化趋势均较为一致。

图1 健康受试者空腹单次口服氯巴占片受试制剂或参比制剂后氯巴占平均血药浓度-时间曲线及其半对数曲线Fig.1 Mean and semilogarithmic plasma concentration-time curves of clobazam after single oral administration of clobazam tablet test preparation or reference preparation in healthy subjects under fasting

图2 健康受试者餐后单次口服氯巴占片受试制剂或参比制剂后氯巴占平均血药浓度-时间曲线及其半对数曲线Fig.2 Mean and semilogarithmic plasma concentration-time curves of clobazam after single oral administration of clobazam tablet test preparation or reference preparation in healthy subjects under fed

图3 健康受试者空腹单次口服氯巴占片受试制剂或参比制剂后N-去甲基氯巴占平均血药浓度-时间曲线及其半对数曲线Fig.3 Mean and semilogarithmic plasma concentration-time curves of N-desmethylclobazam after single oral administration of clobazam tablet test preparation or reference preparation in healthy subjects under fasting condition

图4 健康受试者餐后单次口服氯巴占片受试制剂或参比制剂后N-去甲基氯巴占平均血药浓度-时间曲线及其半对数曲线Fig.4 Mean and semilogarithmic plasma concentration-time curves of N-desmethylclobazam after single oral administration of clobazam tablet test preparation or reference preparation in healthy subjects under fed
对于氯巴占的PK参数:空腹研究中受试制剂阶段1例受试者Tmax和Cmax不纳入PKPS、2例受试者AUC0-t、AUC0-∞和t1/2不纳入PKPS,其相应受试者例数分别为33例和32例;参比制剂阶段1例受试者Tmax和Cmax不纳入PKPS、2例受试者AUC0-t、AUC0-∞和t1/2不纳入PKPS,其相应受试者例数分别为33例和32例。餐后研究中受试制剂阶段的Tmax、Cmax、AUC0-t、AUC0-∞和t1/2均纳入PKPS,其相应受试者例数均为30例;参比制剂阶段1例受试者Tmax和Cmax不纳入PKPS、2例受试者AUC0-t、AUC0-∞和t1/2不纳入PKPS,其相应受试者例数分别为29例和28例。氯巴占的主要PK参数结果见表1。
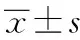
表1 健康受试者空腹或餐后状态下体内氯巴占的主要药代动力学参数Tab.1 Main pharmacokinetic parameters of clobazam in healthy subjects under fasting or fed condition
2.3药动学参数 本次试验空腹研究入组34例受试者,餐后研究入组30例受试者,但部分受试者因提前退出或样本采集时间点不足而无法计算相应PK参数,因此纳入PKPS的受试者例数存在差别。
对于氯巴占的活性代谢物N-去甲基氯巴占的PK参数,空腹研究中受试制剂阶段2例受试者Tmax和Cmax不纳入PKPS、3例受试者AUC0-t不纳入PKPS、9例受试者AUC0-∞和t1/2不纳入PKPS,其相应受试者例数分别为32例、31例和25例;参比制剂阶段3例受试者Tmax和Cmax不纳入PKPS、4例受试者的AUC0-t不纳入PKPS、10例受试者AUC0-∞和t1/2不纳入PKPS,其相应受试者例数分别为31例、30例和24例。餐后研究中受试制剂阶段4例受试者Tmax、Cmax和AUC0-t不纳入PKPS、11例受试者AUC0-∞和t1/2不纳入PKPS,其相应受试者例数分别为26例和19例;参比制剂阶段4例受试者Tmax和Cmax不纳入PKPS、5例受试者AUC0-t不纳入PKPS、12例受试者AUC0-∞和t1/2不纳入PKPS,其相应受试者例数分别为26例、25例和18例。N-去甲基氯巴占的主要PK参数结果见表2。
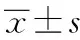
表2 健康受试者空腹或餐后状态下体内N-去甲基氯巴占的主要药代动力学参数Tab.2 Main pharmacokinetic parameters of N-desmethylclobazam in healthy subjects under fasting or fed condition
2.4生物等效性评价 健康受试者空腹或餐后状态下口服20 mg氯巴占片(T药、R药),氯巴占主要PK参数Cmax、AUC0-t、AUC0-∞几何均数的比值(T/R)均完全落在80.00%~125.00%之间;个体内变异系数均相对较低。结果见表3。

表3 空腹或餐后条件下氯巴占片受试制剂和参比制剂的生物等效性评价结果Tab.3 Bioequivalence results of clobazam tablet between test preparation and reference preparation under fasting or fed state
综合以上试验结果,本研究中氯巴占片受试制剂和参比制剂在空腹和餐后条件下均生物等效。
2.5安全性评价 本次试验依据CTCAE(Common Terminology Criteria for Adverse Events)5.0标准判断AE严重程度,并将与研究药物相关的AE按系统器官分类/首选词(SOC/PT)汇总,比较受试者服用受试制剂阶段和服用参比制剂阶段发生的不良反应类型及其发生率。
空腹研究入组34例受试者,其中23例受试者发生41例次与试验药物可能有关的不良反应;受试制剂给药阶段发生12例26例次不良反应,参比制剂给药阶段发生12例15例次不良反应;3例次受试者不良反应的严重程度为2级,其余均为1级。
餐后研究入组30例受试者,其中17例受试者发生35例次与试验药物可能有关的不良反应;受试制剂给药阶段发生10例19例次不良反应,参比制剂给药阶段发生11例16例次不良反应;1例次受试者不良反应的严重程度为2级,其余均为1级。
受试制剂和参比制剂不良反应类型相当,不良反应发生率接近,不良反应严重程度较低(不超过2级);多数不良反应无需采取措施即可自行痊愈,少数不良反应采取常规的对症治疗即可痊愈。试验期间未出现严重程度为3级及以上的不良事件,受试制剂和参比制剂整体不良反应轻微,安全性良好。
3 讨论
癫痫在全世界范围内的发病率约0.7%,其中30%~40%的患者即使经长期药物干预,仍反复发作,进而成为难治性癫痫[1]。难治性癫痫包括Lennox-Gastaut(LGS)、Dravet综合征和肌阵挛-失张力癫痫等,在儿童期即可发病且常常持续至成年期,给患者身心健康及其家庭带来严重影响;2011年美国FDA批准上市的氯巴占,可用于2岁及以上LGS综合征癫痫患者的辅助治疗,且在另外两种难治性癫痫的治疗中也有一定的应用[7]。
本次氯巴占片生物等效性试验,空腹研究入组34例受试者,其中1例受试者(给药系列RT)给药后1.67 h发生AE(过敏性皮炎)退出试验,无有效PK参数,不纳入PKPS集;1例受试者(给药系列TR)第一周期给药后血样采集至96 h后因家中有事未返院采集余下血样,第二周期全部完成,受试制剂阶段缺失PK参数AUC0-t、AUC0-∞和t1/2;1例受试者(给药系列TR)第二周期给药后血样采集至96 h后提前退出试验,参比制剂阶段缺失PK参数AUC0-t、AUC0-∞和t1/2。餐后研究入组30例受试者,其中1例受试者(给药系列TR)完成第一周期研究后提前退出,参比制剂阶段的PK参数均缺失;1例受试者(给药系列TR)第二周期给药后血样采集至96 h后提前退出试验,参比制剂阶段缺失PK参数AUC0-t、AUC0-∞和t1/2。另外,由于N-去甲基氯巴占半衰期较长,其纳入PKPS的受试者例数除因上述原因减少外,还有部分受试者在N-去甲基氯巴占的Tmax之后少于3个可测浓度、部分受试者第二周期N-去甲基氯巴占给药前的浓度高于其Cmax的5%。因N-去甲基氯巴占的PK参数不作为生物等效性评价指标,且其对整体试验结果影响较小,故该品种生物等效性试验仍可参考本研究的试验设计。若不考虑成本,对本试验设计进行优化,可在192 h采血点后增加240 h采血点,并可增加试验清洗期至30天。
本研究首次报道了中国健康受试者口服氯巴占片的药代动力学参数,且氯巴占Tmax、t1/2等参数与原研产品已报道的参数基本一致[2];同时,也首次对中国健康受试者口服氯巴占片的安全性进行了评价。结果显示,空腹研究受试制剂阶段不良反应发生率36.4%(12/33),参比制剂阶段不良反应发生率35.3%(12/34);餐后研究受试制剂阶段不良反应发生率33.3%(10/30),参比制剂阶段不良反应发生率37.9%(11/29);主要不良反应包括实验室检查值异常(如白细胞计数降低、中性粒细胞计数降低、丙氨酸氨基转移酶升高、总胆红素升高、血红蛋白降低、尿潜血阳性等)、心率降低、血压降低、头晕、嗜睡、咳嗽、过敏、口咽疼痛等。其中1例次受试者口咽疼痛和1例次受试者过敏的不良反应为2级,使用药物对症治疗后痊愈;1例受试者白细胞计数降低合并中性粒细胞计数降低的不良反应为2级,未采取措施即痊愈;其余不良反应均为1级,无需采取措施即自行痊愈。上述不良反应与参比制剂已报道的不良反应类型基本吻合。
通过本次生物等效性研究,表明宜昌人福药业有限责任公司仿制研发的氯巴占片,与原研氯巴占片在空腹和餐后状态下均能达到生物等效,总体安全性良好,二者在临床上可相互替代。经国家药品监督管理局优先审评审批通道审评,宜昌人福药业有限责任公司生产的氯巴占片于2022年9月作为化学药品注册分类第3类获得NMPA批准在我国上市,成为该品种的国内首仿上市厂家。国产氯巴占仿制药的上市进一步保障了国内相关癫痫患者的用药可及性。
