芍药苷抑制子宫内膜癌迁移侵袭及其作用机制
2024-01-02肖慧覃鸿恩姚姿羽周辉马荣河
肖慧 覃鸿恩 姚姿羽 周辉 马荣河
作者单位:445000 恩施1恩施土家族苗族自治州中心医院药剂科;2湖北民族大学附属民大医院药剂科
子宫内膜癌好发于绝经后的中老年妇女,易发生阴道不规则出血,临床主张手术切除子宫、卵巢或输卵管,并以化疗进行辅助[1]。但对于中晚期子宫内膜癌患者,化疗易耐药,治疗效果并不理想,晚期患者5年总生存率约为30%[2-3]。因此,寻找更安全有效的药物和生物标志物对子宫内膜癌治疗具有重要的临床意义。芍药苷(Paeoniflorin)是一类具有镇痛、镇静、解痉、抗炎等多种活性作用的天然化合物[4],同时也具有良好的抗肿瘤作用,在结直肠癌中发现其能抑制恶性肿瘤增殖和迁移[5-6]。然而,目前关于芍药苷在子宫内膜癌中的药理活性及其作用并未明确。本研究通过生物信息学分析以及体内和体外实验观察芍药苷干预子宫内膜癌细胞对细胞增殖、迁移和侵袭的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 主要材料与试剂
人子宫内膜癌细胞株HEC108 和Ishikawa 分别购于上海传秋生物科技有限公司,武汉普诺赛生命科技有限公司;芍药苷标准品(纯度:98%)购于上海纯优生物科技有限公司;RPMI 1640 培养基购于上海经科化学科技有限公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒(生产批号:PD-BCA-500)、十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶配制试剂盒(生产批号:P0012A)购自北京伊塔生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(生产批号:C57-C0017-500)购于上海吉至生化科技有限公司;AURKA 和空载质粒购于上海柯雷生物科技有限公司;基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)、E-钙黏蛋白(E-cadherin)、波形蛋白(vimentin)、N-钙黏蛋白(N-cadherin)、锌指蛋白(Snail)、极光激酶A(aurora kinase A,AURKA)和Ki-67 多克隆抗体以及辣根过氧化物酶标记的羊抗兔免疫球蛋白G(H+L)二抗购自上海科敏生物科技有限公司;ST-360型酶标仪购自上海晚成医疗器械有限公司。
1.2 生物信息学分析
利用TargetNet 和Swiss target prediction 在线数据库预测芍药苷靶基因后进行交叉分析,即得该药物的可能作用靶点。利用UALCAN数据库[7](https://ualcan.path.uab.edu/)分析芍药苷的靶点在子宫内膜癌中的表达水平,并通过TCGA(版本:unc.edu_UCEC_IlluminaHiSeq_RNASeqV2.geneExp)在线数据库下载子宫内膜癌的临床样本数据,比较靶基因在不同临床病理特征间的表达情况。
1.3 细胞培养及分组
将HEC108和Ishikawa 细胞接种至含10%胎牛血清的RPMI 1640培养液,在37 ℃、5% CO2饱和湿度条件下培养,细胞为贴壁生长,胰酶消化液消化后传代培养,取用对数生长期细胞进行实验。
根据LipofectamineTM2000说明书将AURKA和空载质粒转染至细胞(HEC108 和Ishikawa)中,实验分组:对照组(Control 组/Vector 组,细胞不处理,即正常培养细胞);AURKA 组(转染AURKA 质粒),芍药苷组(0.5 mg/mL 芍药苷处理细胞),芍药苷+ AURKA 组(0.5 mg/mL 芍药苷处理细胞并转染AURKA 质粒),转染48 h 后收集各组细胞,采用Western blot检测AURKA蛋白水平,以评估转染效率。
1.4 CCK-8实验检测细胞活性
HEC108 和Ishikawa 细胞消化离心重悬,以密度为5×103个/孔接种于96 孔板。将细胞置于培养箱进行培养24 h,以不同浓度芍药苷(0、0.5、1.0、2.0 mg/mL)作用于细胞,分别于0、24、48、72、96 h 对细胞增殖活性进行检测。每孔加入10µL CCK-8 溶液于37 ℃环境中继续孵育2 h,用酶标仪检测450 nm 的吸光度,以各组吸光度的平均值反映细胞增殖活性。
1.5 CCK-8实验检测细胞增殖能力
将HEC108和Ishikawa细胞以密度为5×103个/孔接种于96 孔板。分别于0、24、48、72、96、120、144 h对细胞增殖能力进行检测。每孔加入10µL CCK-8溶液于37 ℃环境中继续孵育2 h,用酶标仪检测450 nm处的吸光度值,根据吸光度值绘制细胞生长曲线。
1.6 Transwell实验检测细胞迁移和侵袭能力
迁移实验:在24孔板中,将密度为5×104个/mL 的细胞悬液接种于不含Matrigel基质胶的Transwell小室上层,下层添加含10%胎牛血清的培养液,于37 ℃、5% CO2培养箱中培养12 h,去除Transwell 小室并吸弃24 孔板中的培养液,4%多聚甲醛固定10 min,结晶紫染色15 min,用PBS 洗3 次,用无菌棉签移除未迁移细胞,在倒置显微镜下观察,拍照统计细胞数量。侵袭实验:将细胞悬液接种于内铺Matrigel 基质胶的Transwell小室上层,下层添加含10%胎牛血清的培养液,在37 ℃、5% CO2培养箱中培养48 h,其余步骤同迁移实验。
1.7 LDH活性检测
将HEC108 和Ishikawa 细胞接种于6 孔板(细胞浓度为2×105个/mL),加入0.5 mg/mL 浓度的芍药苷2 mL,消化离心,加入裂解液后再离心取上清液。按照LDH试剂盒说明书中的操作步骤分别进行加样后,用酶联免疫检测仪在波长为440 nm时测定光密度(OD)值,计算出LDH活性。
1.8 裸鼠移植瘤实验检测瘤体生长
8 周龄健康雌性C57BL/6 裸鼠16 只,体质量(22±2)g,购自湖北省实验动物研究中心,许可证号:SCXK(鄂)2015-0018。所有小鼠均在标准环境中饲养,并自由采食饮水。将Control组、芍药苷组对数生长期的子宫内膜癌细胞HEC108 重悬,接种于裸鼠腋下脂肪垫,每组8只。每隔1 d 经皮下注射1 次药物质量浓度为50 mg/mL 的芍药苷溶液,每天1 次,共2 周。待成瘤后,每2 d 测量一次瘤体体积。成瘤第14 天后处死所有裸鼠,取出瘤体测量瘤体体积及重量。所有实验动物均遵循3R 原则,经湖北民族大学附属民大医院动物实验伦理审查通过(审批号:KEH20220805)。
1.9 免疫组化染色检测肿瘤组织中Ki-67的表达水平
处死裸鼠后取出肿瘤组织,常规包埋切片,用PBS 冲洗3 次,每次5 min;微波修复15 min,切片用过氧化酶抑制剂室温处理10 min,PBS 冲洗3 次,每次3 min;滴加CBL 抗体(1∶100),4 ℃孵育过夜;PBS 冲洗3次,每次3 min;滴加HRP-羊抗小鼠IgG,室温孵育10 min;PBS充分淋洗后,滴加H2O2-DAB显色液显色;复染,脱水透明,封片。阴性对照用PBS 代替一抗。在显微镜下观察,拍照。
1.10 Western blot检测蛋白表达
收集各组对数生长期的HEC108 和Ishikawa 细胞,Control 组和芍药苷组加入SDS 上样缓冲液,沸水浴中煮沸10 min,电泳后转至PVDF膜,用5%脱脂牛奶室温封闭1 h。加入用封闭液稀释的抗体(1∶5 000),4 ℃孵育过夜。次日PBST洗涤6 min,重复3 次,然后加入封闭液稀释的HRP标记的羊抗兔二抗(1∶1 000),室温孵育60 min,PBST 洗涤6 min,重复3 次,ECL 化学发光液进行显影,以β-actin 作为内参,利用BCA 蛋白检测试剂检测蛋白浓度。
1.11 统计学方法
采用SPSS 22.0 软件分析数据,计量资料用均数±标准差()表示,两组间比较采用独立样本t检验,采用单因素方差分析各组细胞增殖、迁移和侵袭的差异,组间两两比较采用LSD-t检验。采用Kaplan-Meier法分析患者总生存期(从确诊为恶性肿瘤至因任何原因引起死亡的时间)和无病生存期(从治疗开始至肿瘤复发或因任何原因死亡的时间),生存率差异比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 芍药苷靶基因及其与子宫内膜癌临床不良表型之间关系
通过网络药理学分析得到芍药苷的41 个作用靶点。UALCAN 在线分析显示有29 个基因表达上调。TCGA数据库分析结果显示,在这29个基因中,有2个基因的表达水平与子宫内膜癌的总生存期相关,且只有AURKA与肿瘤分期相关(图1A),因此选择AURKA进行后续研究。
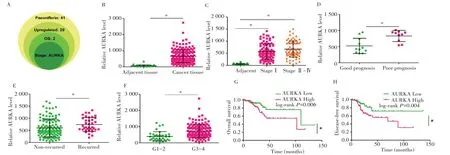
图1 芍药苷的靶基因AURKA及其与子宫内膜癌临床特征的关系Fig.1 Paeoniflorin target gene AURKA and its relationship with clinical features of endometrial carcinoma
TCGA数据库结果显示,AURKA 在子宫内膜癌组织中的表达明显高于癌旁组织(图1B,P=0.002),亚组分析显示临床分期Ⅰ期以及Ⅱ-Ⅳ期的子宫内膜癌组织中AURKA 表达均高于癌旁组织(图1C,P=0.001),预后不良患者中AURKA 表达高于预后良好患者(图1D,P=0.003),复发患者中AURKA的表达高于非复发患者(图1E,P=0.009),G3~4分级的子宫内膜癌组织中AURKA表达高于G1~2分级患者(图1F,P=0.005)。生存分析显示,AURKA高表达患者的总生存期和无病生存期均小于AURKA 低表达患者(图1G~H,P=0.006、0.004)。
2.2 芍药苷体外抑制子宫内膜癌细胞增殖
CCK-8 检测显示,不同浓度芍药苷(0.5、1.0、2.0 mg/mL)作用于HEC108和Ishikawa细胞72 h后,与对照组相比,芍药苷可以显著提高细胞抑制率且呈浓度依赖性(图2A~B,P=0.011、0.015)。72 h时,0.5 mg/mL浓度芍药苷作用于HEC108 和Ishikawa 细胞,其细胞抑制率基本达50%,因此选择0.5 mg/mL 浓度的芍药苷处理细胞进行体外功能实验。0.5 mg/mL 浓度芍药苷作用于HEC108和Ishikawa 细胞后,细胞增殖活性低于Control组(图2C~D,P=0.015、0.019);LDH 活性高于Control 组(图2E,P=0.008、0.012),Ki-67 蛋白表达水平低于Control组(图2F,P=0.010、0.013)。
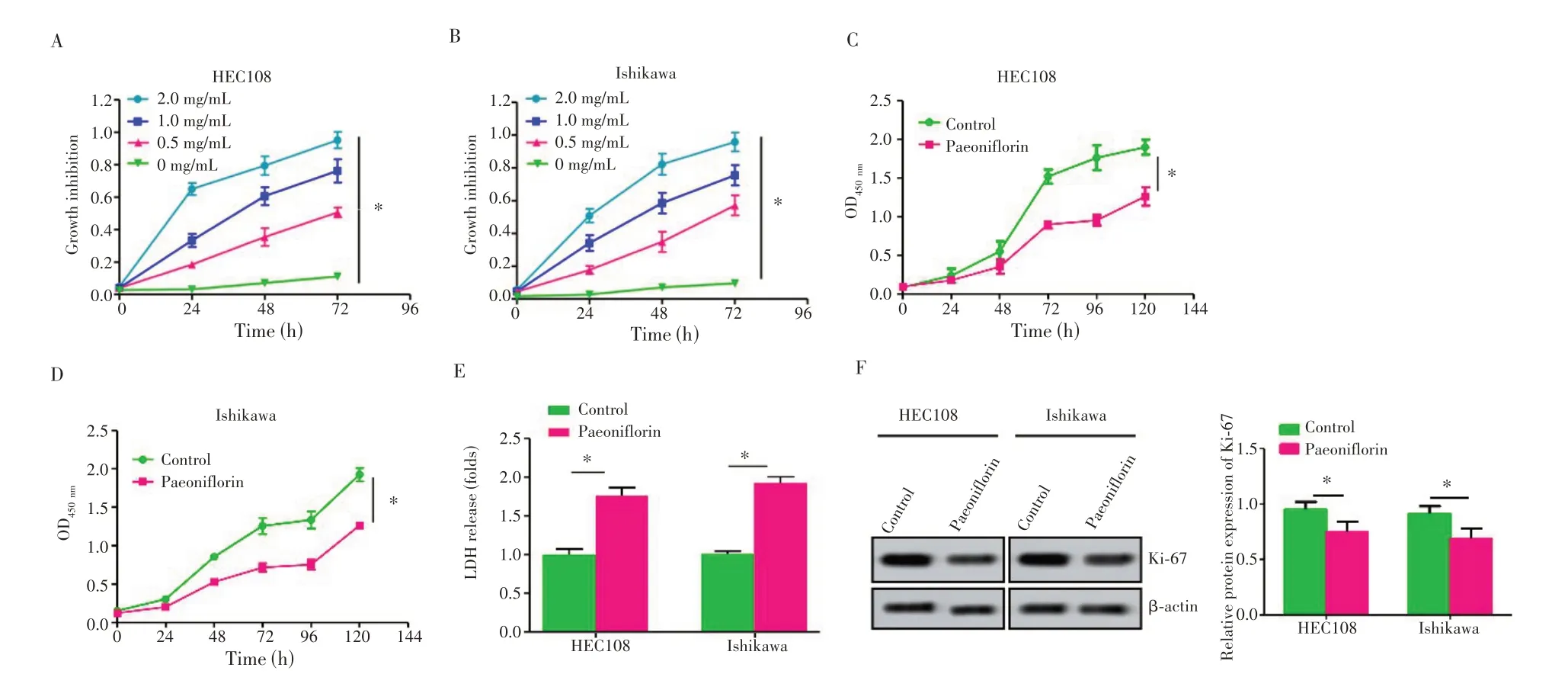
图2 芍药苷抑制子宫内膜癌HEC108和Ishikawa细胞增殖Fig.2 Paeoniflorin inhibited the proliferation of HEC108 and Ishikawa cells
2.3 芍药苷抑制子宫内膜癌细胞迁移、侵袭和EMT
Transwell 实验结果显示,0.5 mg/mL 浓度芍药苷作用于HEC108 和Ishikawa 细胞后,芍药苷组迁移细胞数低于Control组(图3A,P=0.032、0.039),侵袭细胞数也低于Control 组(图3B,P=0.023、0.025)。Western blot 实验结果(图3C)显示,与Control 组相比,芍药苷组细胞中MMP2(P=0.027、0.029)、MMP9(P=0.031、0.032)蛋白表达水平均降低。另外,与Control 组相比,芍药苷组细胞中Vimentin(P=0.022、0.024)、N-cadherin(P=0.023、0.025)、Snail(P=0.026、0.028)蛋白表达水平均降低,而E-cadherin(P=0.021、0.019)蛋白水平升高,见图3D。
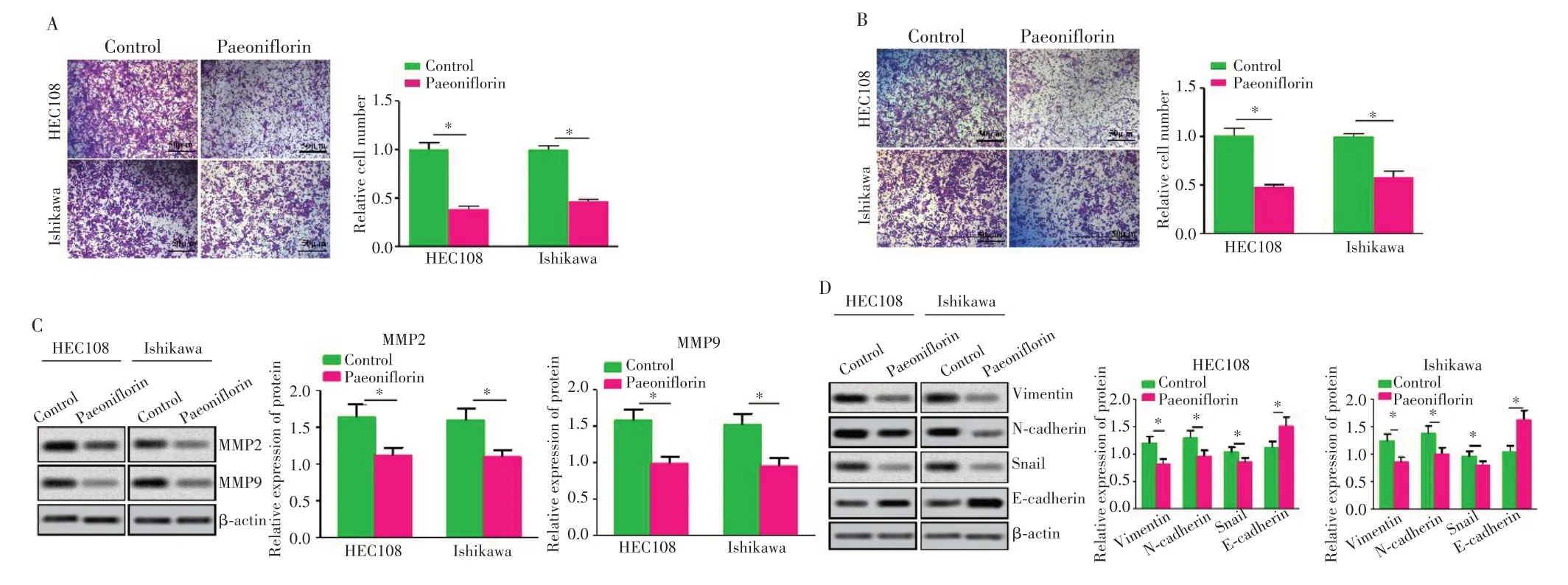
图3 芍药苷抑制子宫内膜癌细胞迁移、侵袭和EMT Fig.3 Paeoniflorin inhibited migration, invasion and EMT of endometrial cancer cells
2.4 芍药苷体内抑制子宫内膜癌细胞增殖
裸鼠建模完成后均未出现意外死亡现象,所有移植瘤瘤体表面皮肤完整,无破溃缺损。裸鼠移植瘤实验2周后成瘤,而且随着时间的推移,移植瘤体积不断增大,但是芍药苷组增长速度明显小于对照组(图4A,P=0.021),移植瘤体积和重量小于对照组(图4B~C,P=0.003、0.006)。免疫组织化学结果显示,芍药苷组中Ki-67 相对表达量低于对照组(图4D,P=0.012)。
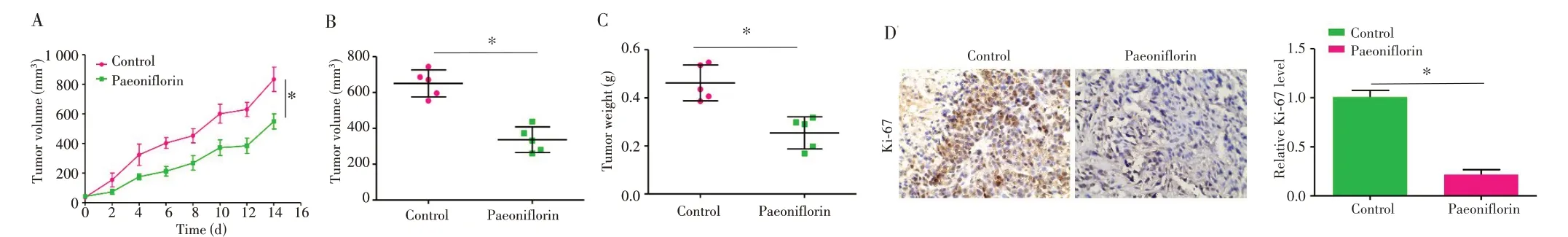
图4 芍药苷体内抑制子宫内膜癌细胞增殖Fig.4 Paeoniflorin inhibited proliferation of endometrial cancer cells in vivo
2.5 不同浓度芍药苷对AURKA蛋白表达的影响
Western blot 检测结果显示,随着芍药苷浓度增加,HEC108和Ishikawa 细胞中AURKA蛋白表达逐渐减少,呈浓度依赖性(图5A,P=0.001、0.003);随着芍药苷作用时间的增加,HEC108 和Ishikawa 细胞中AURKA 蛋白表达逐渐减少,呈时间依赖性(图5B,P=0.004、0.005);AURKA 组中AURKA 蛋白表达水平高于Vector 组(图5C,P=0.011、0.014)。细胞增殖实验显示,HEC108和Ishikawa 细胞中,AURKA组的OD 值明显高于Vector 组(图5D~E,P=0.014、0.018)。AURKA 组细胞LDH 活性低于对Vector 组(图5F,P=0.024、0.027)。
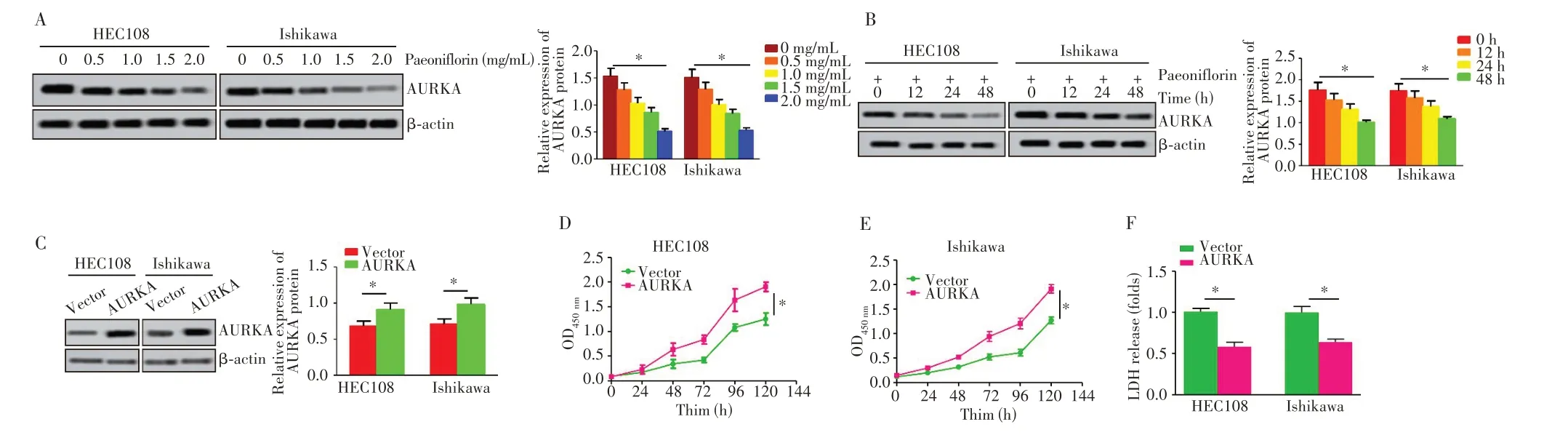
图5 AURKA促进子宫内膜癌细胞增殖Fig.5 AURKA promoted proliferation of endometrial cancer cells
2.6 芍药苷通过AURKA抑制子宫内膜癌细胞增殖
Western blot 实验结果显示(图6A),与对照组相比,HEC108 和Ishikawa 细胞中AURKA 组的AURKA蛋白表达增加(P=0.016、0.019);与AURKA 组相比,芍药苷组中AURKA 蛋白表达减少(P=0.020、0.022);与芍药苷组相比,芍药苷+AURKA 组中AURKA 蛋白表达增加(P=0.002、0.006)。细胞增殖实验显示(图6B~C),与对照组相比,AURKA 组中细胞活性增加(P=0.005、0.008);与AURKA 组相比,芍药苷组中细胞活性减少(P=0.006、0.007);与芍药苷组相比,芍药苷+AURKA 组中细胞活性增加(P=0.009、0.012)。LDH 活性检测实验结果显示(图6D),与对照组相比,AURKA组中LDH活性减少(P=0.018、0.020);与AURKA组相比,芍药苷组中LDH 活性增加(P=0.004、0.006);与芍药苷组相比,芍药苷+AURKA 组中LDH 活性减少(P=0.007、0.009)。

图6 芍药苷通过AURKA抑制子宫内膜癌细胞增殖Fig.6 Paeoniflorin inhibited the proliferation of endometrial cancer through AURKA
3 讨论
本研究采用不同浓度的芍药苷作用子宫内膜癌细胞,观察其对子宫内膜癌细胞活力的影响并筛选出合适浓度的芍药苷进行后续功能试验。研究结果显示,不同浓度的芍药苷作用子宫内膜癌细胞,其细胞存活率均明显下降,且浓度越大,细胞存活率越低,呈浓度依赖趋势。有研究[8]采用芍药苷处理人子宫内膜癌细胞系RL95-2 后发现其对细胞有明显抑制作用,且呈剂量和时间依赖性,这与本研究结果部分相同,说明芍药苷可能以浓度依赖性的方式抑制子宫内膜癌细胞增殖。体外功能实验显示,经芍药苷处理后的细胞活力降低,LDH 活性升高,Ki-67 蛋白水平降低。本研究结果提示芍药苷干预子宫内膜癌细胞可明显抑制细胞活力和调节LDH活性。
裸鼠移植瘤实验进一步支持芍药苷对子宫内膜癌细胞增殖的抑制作用,本研究发现经芍药苷干预裸鼠后,芍药苷组移植瘤体积和重量均小于对照组,裸鼠移植瘤组织中Ki-67蛋白表达也低于对照组。既往研究已证实,肿瘤细胞中Ki-67 增高往往反映肿瘤细胞的增殖活性增强[9],说明芍药苷抑制了裸鼠移植瘤生长。同时本研究还通过生物信息学分析芍药苷的作用靶点,发现并验证了AURKA 与子宫内膜癌临床不良表型有关。基于此,本研究进一步通过体外细胞实验进行验证芍药苷是否通过靶向调节AURKA 进而影响子宫内膜癌生物学行为,结果发现随着芍药苷浓度和时间的增加,AURKA 蛋白表达逐渐减少,呈浓度和时间依赖性,且AURKA 高表达可促进肿瘤细胞增殖,降低LDH 活性,提示AURKA 可以浓度和时间依赖性的方式促进肿瘤细胞增殖;将AURKA 质粒转染至子宫内膜癌细胞,发现芍药苷可以通过下调AURKA蛋白表达抑制子宫内膜癌细胞增殖和增加LDH活性。
本研究还发现,经芍药苷干预子宫内膜癌细胞后细胞迁移和侵袭能力被抑制;并且细胞中MMP2、MMP9、Vimentin、N-cadherin、Snail 蛋白水平降低,E-cadherin 蛋白水平升高。MMP9 与肿瘤侵袭转移有关,MMP2 也能促进肿瘤细胞迁移[10]。MMP9 和MMP2 是一种基质金属蛋白酶,可以靶向许多胞外蛋白,能降解Ⅳ型胶原蛋白等细胞外基质,从多方面、多层次参与肿瘤进展的机制及通路调控,目前已被发现与直肠癌、膀胱癌、乳腺癌、非小细胞肺癌等肿瘤进展密切相关[11-12]。EMT 是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型[13-14]。N-cadherin属于Ⅰ类钙黏蛋白,其表达上调与细胞增殖迁移呈正相关;E-cadherin 也是在上皮细胞膜表达的跨膜糖蛋白,能够介导上皮细胞间的黏附连接,对维持正常上皮细胞形态和结构完整具有重要作用[15-17]。为了探索芍药苷抑制子宫内膜癌转移的作用机制,本研究从EMT出发,观察芍药苷对子宫内膜癌细胞中EMT 相关蛋白Vimentin、N-cadherin、Snail 和E-cadherin 表达的影响,研究结果说明芍药苷可能通靶向AURKA 的方式调节子宫内膜癌细胞EMT 相关蛋白表达,抑制EMT发生,进而抑制肿瘤增殖、侵袭和迁移。
综上所述,本研究初步发现芍药苷可以降低子宫内膜癌细胞增殖、迁移和侵袭能力,抑制EMT,下调MMP2 和MMP9 蛋白表达,且其作用机制可能与下调AURKA 表达有关,说明芍药苷可能是子宫内膜癌潜在的治疗药物,而靶向AURKA 为研究子宫内膜癌治疗提供了新的途径。
