外源脯氨酸对棉花根际土壤微生物碳源利用和酶活性的影响
2024-01-01赵卫松李社增鹿秀云崔钠淇郭庆港马平









摘要:【目的】研究外源脯氨酸对棉花根际土壤微生物碳源利用和土壤酶活性的影响,深入了解脯氨酸防病促生的生态机制。【方法】设置施用不同浓度(0、50、100、200和400 mmol·L-1)脯氨酸处理,以感黄萎病棉花品种鄂荆1号为试验材料,利用Biolog-ECO平板法评价不同处理的根际土壤微生物群落功能多样性和碳源利用情况;采用主成分分析比较不同处理的根际土壤微生物的碳源利用特征,测定棉花根际土壤中脲酶、β-葡萄糖苷酶、中性磷酸酶和芳基硫酸酯酶的活性;通过冗余分析解析土壤酶活性与土壤微生物对不同类型碳源利用能力的相关性。【结果】除400 mmol·L-1脯氨酸处理的土壤微生物McIntosh指数显著上升外,施用脯氨酸处理的土壤优势度指数、香农-维纳多样性指数、均匀度指数及丰富度指数与空白对照均无显著差异。培养6~20 d,50~200 mmol·L-1脯氨酸处理的土壤微生物代谢活性均低于空白对照,但差异均不显著;400 mmol·L-1脯氨酸处理的土壤微生物代谢活性显著高于空白对照。土壤微生物对氨基酸类、羧酸类和碳水化合物类具有较高的利用能力。50~400 mmol·L-1脯氨酸处理下,土壤微生物对L-苯丙氨酸、D-半乳糖酸内酯、β-甲基-D-葡萄糖苷、糖原的利用能力显著提高,对L-精氨酸、D-半乳糖醛酸、D-木糖、i-赤藓糖醇的利用能力显著降低。与空白对照相比,施用脯氨酸处理导致土壤β-葡萄糖苷酶和脲酶活性显著降低,对中性磷酸酶活性无显著影响;芳基硫酸酯酶活性随脯氨酸浓度升高呈现先下降后上升趋势。冗余分析表明,脲酶活性与土壤微生物对L-精氨酸、D-半乳糖醛酸、γ-羟基丁酸、D-木糖和i-赤藓糖醇的利用能力正相关;β-葡萄糖苷酶活性与土壤微生物对L-精氨酸、丙酮酸甲酯、D-木糖和i-赤藓糖醇的利用能力正相关;中性磷酸酶活性与土壤微生物对L-天冬酰胺酸、D-半乳糖醛酸、γ-羟基丁酸、糖原和β-甲基-D-葡萄糖苷的利用能力正相关;芳基硫酸酯酶活性与土壤微生物对L-苯丙氨酸、L-丝氨酸、L-苏氨酸、甘氨酰-L-谷氨酸、D-氨基葡萄糖酸、D-半乳糖酸内酯、衣康酸和D-甘露醇的利用能力正相关。以碳水化合物为碳源时,β-葡萄糖苷酶和脲酶活性与土壤微生物对糖原的利用能力负相关。【结论】施用外源脯氨酸改变根际土壤微生物的碳代谢活性,导致土壤中β-葡萄糖苷酶和脲酶活性显著降低。以碳水化合物为碳源时,这2种酶活性与土壤微生物对D-木糖和i-赤藓糖醇的利用能力存在正相关性,与土壤微生物对糖原的利用能力存在负相关性。
关键词:脯氨酸;棉花;根际微生物;土壤酶;Biolog-ECO;碳源利用;冗余分析
Effects of proline on microbial carbon source utilization and enzyme activity in cotton rhizosphere microorganisms
Zhao Weisong, Li Shezeng, Lu Xiuyun, Cui Naqi, Guo Qinggang*, Ma Ping
(Plant Protection Institute, Hebei Academy of Agriculture and Forestry Sciences/Key Laboratory of IPM on Crops in Northern Region of North China, Ministry of Agriculture and Rural Affairs/IPM Centre of Hebei Province/International Science and Technology Joint Research Center on IPM of Hebei Province, Baoding, Hebei 071000, China)
Abstract: [Objective] The objective of this study is to study the effects of exogenous application of proline on carbon source utilization by soil microorganisms in the cotton rhizosphere and soil enzyme activities, and deeply understand the ecological mechanism of proline in disease prevention and cotton growth promotion. [Methods] In this study, the application of different proline concentrations (0, 50, 100, 200 and 400 mmol·L-1) were set, with a cotton Verticillium wilt-susceptible variety Ejing 1 as the experimental material, and the Biolog-ECO plate method was used to evaluate the functional diversity and carbon source utilization of rhizosphere soil microbial communities under different treatments. Principal component analysis was used to compare the carbon source utilization characteristics of rhizosphere soil microorganisms under different treatments. The activities of neutral phosphatase (NP), arylsulfatase (ASF), urease (UE), and β-glucosidase (β-GC) in cotton rhizosphere soil of different treatments were determined, respectively. Redundancy analysis was used to analyze the correlation between soil enzyme activities and the utilization ability of soil microorganisms for different types of carbon sources. [Results] The McIntosh index of soil microorganisms treated with 400 mmol·L-1 proline increased significantly, while there were no significant differences in the Simpson index, Shannon-Wiener index, Richness index, and Pielou index of soil microorganisms treated with proline compared with control. The soil microbial metabolic activities treated with 50-200 mmol·L-1 proline were all lower than that of the blank control after incubating for 6 to 20 days, while the soil microbial metabolic activity treated with 400 mmol·L-1 proline was significantly higher than that of the blank control. Soil microorganisms treated with proline have higher utilization ability for amino acids, carboxylic acids, and carbohydrates. The utilization ability of soil microorganisms treated with 50-400 mmol·L-1 proline was significantly enhanced for L-phenylalanine, D-galactonolactone, β-methyl-D-glucoside, and glycogen; while the utilization ability for L-arginine, D-galacturonic acid, D-xylose, and i-erythritol was significantly reduced. Compared with the blank control, proline treatments significantly reduced the activities of soil β-GC and UE, and had no significant effect on the activity of NP. The activity of ASF showed a trend of first decreasing and then increasing with the increase of proline concentration. Redundancy analysis shows that UE activity was positively correlated with the utilization ability of soil microorganisms for L-arginine, D-galacturonic acid, γ-hydroxybutyric acid, D-xylose, and i-erythritol; β-GC activity was positively correlated with the utilization ability of soil microorganisms for L-arginine, pyruvic acid methyl ester, D-xylose, and i-erythritol; NP activity was positively correlated with the utilization ability of soil microorganisms for L-asparagine," D-galacturonic acid, γ-hydroxybutyric acid, glycogen, and β-methyl-D-glucoside; ASF activity was positively correlated with the utilization ability of soil microorganisms for L-phenylalanine, L-serine, L-threonine, glycyl-L-glutamic acid, D-glucosaminic acid, D-galactonolactone, itaconic acid, and D-mannitol, respectively. With carbohydrates as carbon source, the activities of β-GC and UE are negatively correlated with the utilization ability of soil microorganisms for glycogen. [Conclusion] The proline treatments can change the soil microbial metabolic activities, leading to a significant decrease in the activities of soil β-GC and UE. With carbohydrates as carbon source, the activities of β-GC and UE are positively correlated with the utilization ability of soil microorganisms for D-xylose and i-erythritol, but negatively correlated with the utilization ability of soil microorganisms for glycogen.
Keywords: proline; cotton; rhizosphere microorganism; soil enzyme; Biolog-ECO; carbon utilization; redundancy analysis
根系分泌物是植物-土壤系统中信息传递和物质交换的重要载体物质,其在调节植物-土壤-微生物的互作过程、根际微生态结构与功能方面具有重要作用[1]。根系分泌物能够通过植物自身化感作用[2]、招募有益根际微生物[3-5]和改变根际微生态环境[6-7]等影响植物土传病害的发生。
目前,关于根系分泌物与寄主、生防微生物和病原微生物互作方面开展了大量的研究[8-11]。已有研究表明,黄瓜根系分泌物中色氨酸能够招募并且提高解淀粉芽孢杆菌(Bacillus amyloliquefaciens)SQR9在黄瓜根部的定殖能力[10];棉花根系分泌物中脯氨酸能够招募枯草芽孢杆菌(B. subtilis)NCD-2生物膜的形成,并提高菌株的定殖能力[11]。植物根系分泌物的组成十分复杂,许多学者采用外源添加标准溶液模拟根系分泌物,以阐明根系分泌物对微生物群落的调控作用[12-16]。田晴等[14]研究表明外源添加小麦根系分泌物能够降低西瓜根际土壤中尖孢镰刀菌(Fusarium oxy-
sporum)的丰度,增加有益微生物毛壳菌属(Chaetomium sp.)和顶孢霉属(Acremonium sp.)的相对丰度。严文辉等[15]研究表明添加外源丁香酸和苹果酸可明显改变土壤细菌群落结构和潜在功能。杨章明等[16]研究表明,施用外源有机酸(如肉桂酸)能够显著刺激青枯劳尔氏菌(Ralstonia solanacearum)的定殖与侵染,并加重烟草青枯病的发生,但对烟草植株生长影响不明显。此外,根系分泌物对土壤微生物的影响在一定程度上与物质浓度有关[17],根系分泌物中低浓度的有机酸和酚酸类物质对植物种子萌发、幼苗生长、病菌菌丝生长和孢子萌发主要表现为促进作用,而高浓度则主要是抑制作用[18-19]。然而,关于根系分泌物对土壤微生物生态功能变化情况关注较少。
棉花是我国重要的经济作物,其根系分泌物中含有较高比例的脯氨酸,在调控棉花植株健康生长及棉花-土壤微生物互作过程中发挥了重要作用[11, 20],然而脯氨酸对棉花根际土壤微生物碳源利用和土壤酶活性的影响尚不明确。前期研究表明施用脯氨酸能够有效降低棉花黄萎病的发生[20],然而脯氨酸如何影响棉花根际土壤微生物的微生态尚不清晰。本研究以施用外源脯氨酸处理的棉花根际土壤为研究对象,利用Biolog-ECO平板分析脯氨酸处理下土壤微生物的功能多样性和碳源利用能力,同时从生理生化水平研究脯氨酸处理对土壤营养元素循环相关酶活性的影响,探究脯氨酸处理下土壤微生物的酶活性与微生物代谢的关系,初步解析外源脯氨酸对棉花根际土壤微生物的微生态效应,进而揭示脯氨酸防病促生的生态机制。
1 材料与方法
1.1 试验材料
供试棉花材料是感黄萎病品种鄂荆1号,由河北省农林科学院植物保护研究所提供。L-脯氨酸(简称脯氨酸,CAS:147-85-3,纯度≥99.0%)购自北京索莱宝科技有限公司,使用时用蒸馏水进行稀释。
次氯酸钠溶液(分析纯,有机氯含量≥10.0%)购自天津市富宇精细化工有限公司,使用时用蒸馏水稀释至1%。
1.2 试验设计
挑选饱满、均匀一致的棉花种子,先用70%(体积分数)乙醇浸泡3 min,再用1%次氯酸钠消毒10 min,用无菌水冲洗3次,最后播种于含有1 kg培养基质(营养土∶土壤=1∶1)的花盆(上直径13.5 cm、下直径9 cm、高11.5 cm)中,每个花盆中播种10粒种子,每盆保证8株棉苗。将花盆置于日光温室中进行培养,待棉苗生长至两叶一心时,分别浇施5 mL浓度为50、100、200和400 mmol·L-1的脯氨酸溶液(记作L50、L100、L200和L400),以浇施相同体积的蒸馏水为空白对照(CK), 然后每盆灌施蒸馏水200 mL。每7 d浇施1次,共浇施3次。每个处理3次重复,每个重复各1盆。
1.3 根际土壤的收集
采用抖根法收集根际土壤样品[20]。具体操作步骤如下:将培养60 d的棉花植株整个根系完整挖出,轻抖根系,弃去与根系结合不紧密的土壤,用毛刷清理、收集与根系紧密结合的土壤,将采集的根际土壤过筛(孔径2 mm)后4 ℃保存,用于后续分析。
1.4 不同处理的根际土壤微生物代谢特征分析
参考赵卫松等[21]方法稍作修改,具体操作如下:将4 ℃保存的土壤样品放在培养箱于25 ℃活化24 h,准确称取3 g土壤样品加到27 mL无菌的0.85 mol·L-1 NaCl溶液,于25 ℃、180 r·min-1振荡培养45 min,然后用上述无菌的0.85 mol·L-1 NaCl溶液稀释1 000倍制备成接种液并转移至储液槽中,利用8孔道排枪向Biolog-ECO平板孔加入150 μL接种液,对照孔加入相同体积的无菌的0.85 mol·L-1 NaCl溶液。将平板置于25 ℃培养箱中进行培养,在培养0、2、4、6、8、10、12、14、16、18和20 d,利用ELxS08-Biolog微孔板读数仪测定样品在590 nm和750 nm的吸收值(分别用A590和A750表示),试验重复3次。采用培养20 d的检测结果计算下列参数,以对不同脯氨酸处理下根际土壤微生物代谢特征进行分析,计算公式如下:
平均颜色变化率(average well color development,AWCD),用来评价不同脯氨酸处理下土壤微生物对碳源的利用能力。微生物代谢活性用A590-A750计算,若数值小于0.06则记作0。
AWCD=" " (1)
式中,Ci和K分别表示第i孔和对照孔的微生物代谢活性,n为碳源种类数,本研究中为31。
优势度指数(Simpson index, D)用来评估土壤微生物群落的物种优势度。
D=1-∑Pi2 (2)
Pi= (3)
香农-维纳多样性指数(Shannon-Wiener index, H)用来评估群落中物种的多样性。
H=-∑(Pi×lnPi) (4)
McIntosh指数(McIntosh index, U)是基于群落物种多维空间上的欧氏距离多样性指数。
U=" (5)
式中,ni为第i孔的相对吸光值即Ci-K。
均匀度指数(Pielou index, J):
J= (6)
式中,S为能被利用的碳源总数。
丰富度指数(Richness index, R),表示可被利用的碳源总数目,本研究中为相对吸光值大于0.06的孔数。
土壤微生物对碳源的相对利用率,以所有处理中最大AWCD值为基准,其他处理的AWCD与基准值之比。
1.5 土壤酶活性测定
按照参考文献[21]的方法分别测定与土壤氮、磷循环相关的土壤脲酶(urease, UE)活性和中性磷酸酶(neutral phosphatase, NP)活性。按照参考文献[22]的方法测定与碳、硫循环相关的β-葡萄糖苷酶(β-glucosidase, β-GC)和芳基硫酸酯酶(arylsulfatase, ASF)活性。
1.6 数据分析
采用Microsoft Excel 2010和Origin 8.6对试验数据进行整理和作图,利用SPSS 17.0统计分析软件对试验结果进行单因素方差分析,采用邓肯新复极差法多重比较不同处理间的显著性差异。采用Canoco 4.5软件和CanoDraw软件分别进行主成分分析和冗余分析。
2 结果与分析
2.1 外源脯氨酸对棉花根际土壤微生物功能多样性的影响
根际土壤微生物功能多样性分析结果表明,除400 mmol·L-1脯氨酸处理下土壤微生物的McIntosh指数显著上升外,其他脯氨酸处理下土壤微生物优势度指数、McIntosh指数、香农-维纳多样性指数、均匀度指数及丰富度指数与空白对照之间不存在显著差异(表1)。
2.2 外源脯氨酸对土壤微生物代谢活性的影响
从图1可以看出,培养0~6 d,土壤微生物的AWCD很低,说明微生物的代谢活性较低;随着培养时间的延长,不同处理的AWCD均呈上升趋势,其中400 mmol·L-1脯氨酸处理的土壤微生物代谢活性显著高于空白对照,50~200 mmol·L-1脯氨酸处理的土壤微生物代谢活性均低于空白对照,但无显著差异(图1)。
2.3 外源脯氨酸处理的根际土壤微生物的碳源利用分析
2.3.1 外源脯氨酸处理的根际土壤微生物对碳源利用的主成分分析。主成分分析结果表明,除50 mmol·L-1脯氨酸处理外,其他浓度脯氨酸处理的土壤微生物的碳源与空白对照在主成分坐标中位于不同的象限,表明与空白对照相比,100~400 mmol·L-1脯氨酸处理下根际土壤微生物对碳源的利用存在差异。第一主成分(PC1)和第二主成分(PC2)分别解释所有变量的94.2%和2.9%,2个主成分方差累积贡献率为97.1%,说明其能够表征土壤微生物的碳源利用特征(图 2)。
2.3.2 外源脯氨酸处理下根际土壤微生物对碳源的利用特征分析。通过相对利用率比较不同处理下根际土壤微生物的碳源利用能力,从图3可以看出,棉花根际土壤微生物对氨基酸类、羧酸类和碳水化合物类碳源的利用率较高。脯氨酸处理下土壤微生物对不同碳源的利用能力存在不同程度的差异。400 mmol·L-1脯氨酸处理显著提高了土壤微生物对羧酸类、氨基酸类和碳水化合物类碳源的利用能力,显著降低了土壤微生物对聚合物类和双亲类化合物的利用能力,土壤微生物对胺类物质的利用能力与空白对照差异不显著。脯氨酸浓度为200 mmol·L-1和100 mmol·L-1处理显著提高了土壤微生物对羧酸类物质的利用能力,显著降低了土壤微生物对碳水化合物类、聚合物类和双亲类化合物的利用能力,土壤微生物对胺类和氨基酸类物质的利用能力与空白对照差异不显著。50 mmol·L-1脯氨酸处理显著降低了土壤微生物对胺类、聚合物类和双亲类化合物的利用能力,对氨基酸类、羧酸类和碳水化合物类物质的利用能力与空白对照差异不显著。
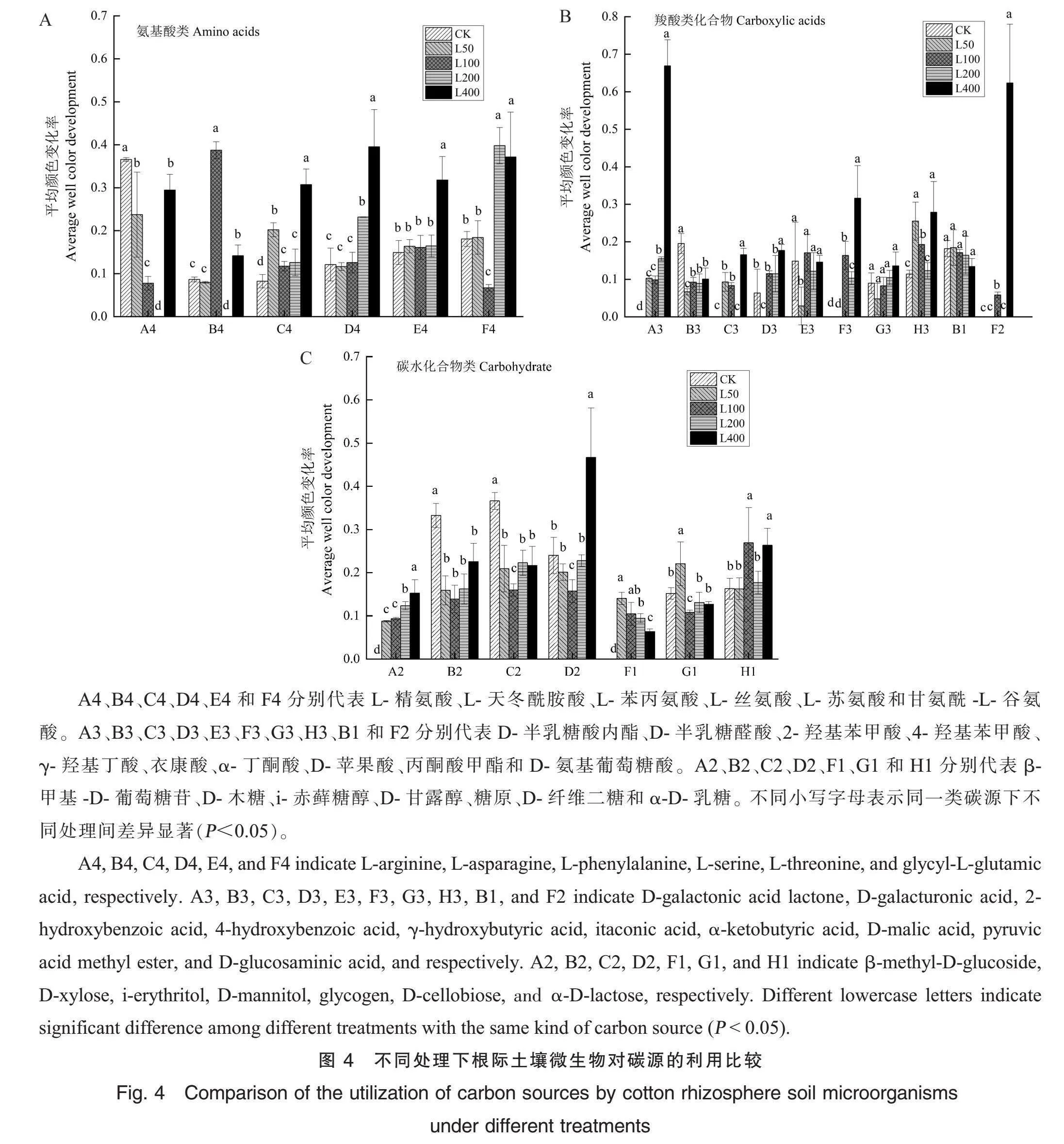
2.3.3 外源脯氨酸处理下根际土壤微生物对主要碳源的利用比较。进一步分析比较脯氨酸处理下根际土壤微生物对氨基酸类、碳水化合物类和羧酸类碳源的具体利用情况(图4)。在氨基酸类方面(图4A),不同脯氨酸处理不同程度地显著降低土壤微生物对L-精氨酸的利用能力。脯氨酸浓度为200 mmol·L-1的处理显著降低了土壤微生物对L-天冬酰胺酸的利用能力,脯氨酸浓度为100 mmol·L-1和400 mmol·L-1的处理显著提高了土壤微生物对L-天冬酰胺酸的利用能力,而脯氨酸浓度为50 mmol·L-1的处理下土壤微生物对L-天冬酰胺酸的利用能力与空白对照差异不显著。施用脯氨酸处理显著提高了土壤微生物对L-苯丙氨酸的利用能力;200 mmol·L-1和400 mmol·L-1脯氨酸处理显著提高土壤微生物对L-丝氨酸和甘氨酰-L-谷氨酸的利用能力;400 mmol·L-1脯氨酸处理显著提高土壤微生物对L-苏氨酸的利用能力,而其他浓度处理对土壤微生物对L-苏氨酸的利用能力与空白对照无显著差异。
在羧酸类方面(图4B),50 mmol·L-1脯氨酸处理下土壤微生物对衣康酸、α-丁酮酸、丙酮酸甲酯和D-氨基葡萄糖酸的利用能力与空白对照差异不显著,但土壤微生物对D-半乳糖醛酸、4-羟基苯甲酸和γ-羟基丁酸的利用能力显著降低,对D-半乳糖酸内酯、2-羟基苯甲酸和D-苹果酸的利用能力则显著提高。100 mmol·L-1脯氨酸处理显著提高了土壤微生物对D-半乳糖酸内酯、2-羟基苯甲酸、衣康酸、D-苹果酸和D-氨基葡萄糖酸的利用能力,显著降低了土壤微生物对D-半乳糖醛酸的利用能力,未显著影响微生物对其他羧酸类物质的利用能力。200 mmol·L-1脯氨酸处理显著提高了土壤微生物对D-半乳糖酸内酯和衣康酸的利用能力,显著降低了土壤微生物对D-半乳糖醛酸的利用能力,未显著影响微生物对其他羧酸类物质的利用能力。脯氨酸浓度为400 mmol·L-1处理下,土壤微生物对D-半乳糖酸内酯、2-羟基苯甲酸、4-羟基苯甲酸、衣康酸、D-苹果酸和D-氨基葡萄糖酸的利用能力显著提高,对D-半乳糖醛酸的利用能力显著降低,对γ-羟基丁酸、α-丁酮酸和丙酮酸甲酯的利用能力与空白对照差异不显著。
在碳水化合物类方面(图4C),脯氨酸浓度为50 mmol·L-1和200 mmol·L-1的处理显著提高土壤微生物对β-甲基-D-葡萄糖苷和糖原的利用能力,显著降低壤微生物对D-木糖和i-赤藓糖醇的利用能力,未显著影响土壤微生物对D-甘露醇和α-D-乳糖的利用能力。脯氨酸浓度为100 mmol·L-1和400 mmol·L-1的处理显著提高了土壤微生物对β-甲基-D-葡萄糖苷、糖原和α-D-乳糖的利用能力,显著降低对D-木糖和i-赤藓糖醇的利用能力,100 mmol·L-1脯氨酸处理还显著降低土壤微生物对D-甘露醇和D-纤维二糖的利用能力。
2.4 施用脯氨酸对根际土壤酶活性的影响
研究结果(表2)表明,施用不同浓度脯氨酸对棉花根际土壤酶活性产生不同程度的影响。施用脯氨酸显著降低了β-葡萄糖苷酶活性和脲酶活性,而对中性磷酸酶活性无显著影响。50 mmol·L-1和100 mmol·L-1脯氨酸处理显著降低了芳基硫酸酯酶的活性,而200 mmol·L-1和400 mmol·L-1脯氨酸处理下芳基硫酸酯酶活性与空白对照差异不显著。
2.5 土壤酶活性与碳源利用能力的相关性分析
施用脯氨酸处理的土壤酶活性与土壤微生物对氨基酸类、羧酸类和碳水化合物类碳源利用能力的冗余分析结果(图5)表明,对于氨基酸类碳源,脲酶和β-葡萄糖苷酶活性与土壤微生物对L-精氨酸的利用能力存在正相关性,与土壤微生物对L-苯丙氨酸、L-苏氨酸、L-丝氨酸和甘氨酰-L-谷氨酸的利用能力存在负相关性;中性磷酸酶活性与土壤微生物对L-天冬酰胺酸的利用能力存在正相关性;芳基硫酸酯酶活性与土壤微生物对L-苯丙氨酸、L-苏氨酸、L-丝氨酸和甘氨酰-L-谷氨酸的利用能力存在正相关性,而与土壤微生物对L-天冬酰胺酸的利用能力存在负相关性(图5A)。
对于羧酸类碳源,脲酶和中性磷酸酶活性与土壤微生物对D-半乳糖醛酸和γ-羟基丁酸的利用能力存在正相关性;β-葡萄糖苷酶活性与土壤微生物对丙酮酸甲酯的利用能力存在正相关性;芳基硫酸酯酶活性与土壤微生物对丙酮酸甲酯的利用能力存在负相关性,而与土壤微生物对D-半乳糖酸内酯、D-氨基葡萄糖酸、衣康酸、α-丁酮酸和4-羟基苯甲酸的利用能力存在正相关性(图5B)。
对于碳水化合物类碳源,脲酶和β-葡萄糖苷酶活性与土壤微生物对D-木糖和i-赤藓糖醇的利用能力存在正相关性,而与土壤微生物对糖原的利用能力存在负相关性;中性磷酸酶活性与土壤微生物对糖原和β-甲基-D-葡萄糖苷的利用能力存在正相关性;芳基硫酸酯酶活性与土壤微生物对D-甘露醇的利用能力存在正相关性,而与土壤微生物对D-纤维二糖的利用能力存在负相关性(图5C)。
3 讨论
根系分泌物是1把“双刃剑”,在调控植物病害发生方面具有重要作用[23-29]。已有研究表明,感黄萎病橄榄品种产生的根系分泌物能显著诱导病菌分生孢子和微菌核的萌发[23];烟草根系分泌物苯甲酸和3-苯基丙酸能够促进烟草青枯病菌(R. solanacearum)的生长并加重病害发生程度[30]。然而,番茄植株根系分泌的苹果酸能吸引有益菌解淀粉芽孢杆菌(B. amyloliquefaciens)T-5[26],西瓜根系分泌物的苹果酸和柠檬酸能够招募多粘类芽孢杆菌(Paenibacillus polymyxa)SQR-21在寄主根际定殖发挥防病促生作用[27]。本团队前期研究表明,外源施用低浓度脯氨酸促进黄萎病的发生,而高浓度脯氨酸能够降低黄萎病发生[20]。
Biolog方法是基于微生物群落对不同碳源的利用程度来表征微生物功能的动态变化,广泛应用于土壤微生物群落功能多样性的研究[21, 31-32]。土壤微生物功能多样性是描述土壤微生物群落特征的1个重要指标[33-34],其与土壤营养元素(如碳、氮、磷等)循环转化的生物化学过程存在密切关系[35]。土壤微生物功能多样性和植物健康状况有一定相关性,土壤微生物多样性能够影响植物土传病害的发生[21, 36-37]。根系分泌物介导的土壤微生物群落结构与功能变化对寄主的生长发育能够产生重要的影响[1, 38-39]。沈凤英等[38]研究表明,高浓度的根系分泌物能够显著改变夹竹桃根际土壤微生物群落功能多样性。严文辉等[15]研究表明添加外源苹果酸能显著提高番茄植株根际细菌群落的短链有机酸降解能力,添加外源丁香酸可降低细菌生物膜的形成能力并提高细菌群落对芳香族化合物的降解能力。本研究结果表明,与空白对照相比,脯氨酸处理下土壤微生物群落功能多样性指数无显著差异(400 mmo·L-1脯氨酸处理下的McIntosh指数除外),但大部分处理下土壤微生物的优势度指数、香农-维纳多样性指数、均匀度指数和丰富度指数呈上升趋势。推测脯氨酸能改变土壤微生物群落功能多样性,降低土传病害的发生,与前人研究的观点相似[1," 38-39]。通过对不同类型碳源物质的相对利用率分析发现,施用脯氨酸对棉花根际土壤微生物的碳源利用存在不同程度的影响,其中400 mmol·L-1脯氨酸处理显著提高土壤微生物对氨基酸类、羧酸类和碳水化合物类碳源的利用能力,显著降低对聚合物类和双亲化合物类碳源的利用能力。进一步分析表明,400 mmol·L-1脯氨酸处理显著提高了土壤微生物对L-天冬酰胺酸、L-苯丙氨酸、L-丝氨酸、L-苏氨酸、甘氨酰-L-谷氨酸、D-半乳糖酸内酯、2-羟基苯甲酸、4-羟基苯甲酸、衣康酸、D-苹果酸、D-氨基葡萄糖酸、β-甲基-D-葡萄糖苷、D-甘露醇、糖原和α-D-乳糖的利用能力。值得注意的是,植物根系分泌物成分复杂,基于上述对土壤微生物碳代谢特征的研究结果,将脯氨酸与不同类型氨基酸、碳水化合物或者羧酸类物质联合使用是否改变棉花农艺性状以及黄萎病的发生,有待进一步研究。
土壤微生物是生态系统养分循环和转化的动力,其潜在的生物化学活性对土壤生态功能具有重要意义。已有研究表明,植物根系分泌物能够对土壤酶活性产生不同程度的影响,改善土壤肥力进而影响植物的健康生长[40-42]。彭雪梅等[40]研究发现空心莲子草根系分泌物改变了土壤酶活性,使土壤微生物群落结构组成和功能向着有利于植物生长的方向转化。刘泽淼等[42]研究表明低浓度外源芍药内酯苷处理能提高芍药根中可溶性蛋白和脯氨酸含量,改善土壤酶活性,促进芍药的生长发育;高浓度芍药内酯苷处理则抑制芍药生长、降低成花率。本团队前期研究表明外源施用脯氨酸降低土壤铵态氮含量,而对速效磷含量无显著影响,对棉花株高和地上部鲜物质质量 具有促进作用[20]。本研究结果表明,与空白对照相比,施用脯氨酸显著降低β-葡萄糖苷酶和脲酶活性,对中性磷酸酶活性无显著影响。随着脯氨酸浓度升高,芳基硫酸酯酶活性呈现先下降后上升趋势,且400 mmol·L-1脯氨酸处理与空白对照的酶活性不存在显著差异。由此推测,外源施用脯氨酸能够通过降低土壤脲酶活性,改变土壤铵态氮含量,在一定程度上发挥防病促生作用。
根系分泌物是调控根际微生态功能的重要因素,也是植物与土壤交流的主要媒介[43]。根系分泌物成分复杂,根际微环境受到多种因素影响。本研究通过浇灌不同浓度的脯氨酸对根际土壤酶活性、土壤微生物群落结构及其代谢功能产生不同程度的影响,表明根际土壤微环境与植物根系分泌物浓度有密切关系。此外,棉花抗/感黄萎病品种产生的根系分泌物种类及浓度不同,导致根际微生物结构和功能存在差异[44]。本研究仅以棉花感病品种为试验材料开展研究,对于棉花抗病品种根际微生物的微生态效应的影响,有待进一步研究。
同时,已有研究表明,脯氨酸在缓解植物逆境(盐胁迫、干旱、重金属污染、冻害等)损伤方面具有重要的作用[45-49]。曾钰等[45]研究认为外源施用脯氨酸能够促进缺硼条件下棉花植株生长;戴茂华等[46]研究认为干旱条件下棉花叶片的脯氨酸含量增加能够抵御植株干旱胁迫;杨艳兵等[47]研究表明棉花在盐胁迫下,植株体内脯氨酸含量显著增加。高彦强等[48]研究发现叶面喷施适宜浓度的脯氨酸能够有效缓解盐胁迫下芹菜株高、茎粗及叶片叶绿素含量的降低,促进根系形态建成及生物量的积累,增强光合作用。陈奋奇等[49]研究表明外源脯氨酸能够通过调节抗氧化酶活性、渗透溶质及营养离子平衡能力来缓解盐胁迫对玉米幼苗的伤害作用。然而,在病原菌胁迫下脯氨酸处理对棉花植株氧化酶活性产生何种影响以及内生微生物如何变化有待进一步研究。
4 结论
培养6~20 d,50~200 mmol·L-1脯氨酸处理对棉花根际土壤微生物的代谢活性无显著影响,而400 mmol·L-1脯氨酸处理显著提高土壤微生物代谢活性。空白对照和外源脯氨酸处理下,棉花根际土壤微生物对羧酸类、氨基酸类和碳水化合物类物质的平均相对利用率较高,施用脯氨酸处理影响根际微生物对上述化合物的利用能力:50~400 mmol·L-1脯氨酸处理显著提高了土壤微生物对L-苯丙氨酸、D-半乳糖酸内酯、β-甲基-D-葡萄糖苷、糖原的利用能力,显著降低了土壤微生物对L-精氨酸、D-半乳糖醛酸、D-木糖、i-赤藓糖醇的利用,未显著影响微生物对α-丁酮酸和丙酮酸甲酯的利用能力。施用脯氨酸处理显著降低土壤β-葡萄糖苷酶和脲酶活性;在以碳水化合物为碳源时,这2种酶的活性与土壤微生物对D-木糖和i-赤藓糖醇的利用能力存在正相关性,而与土壤微生物对糖原的利用能力存在负相关性。
参考文献:
[1] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J/OL]. 植物生态学报, 2014, 38(3): 298-310[2024-05-01]. https://doi.org/10.3724/SP.J.1258.
2014.00027.
Wu Linkun, Lin Xiangmin, Lin Wenxiong. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J/OL]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310[2024-05-01]. https://doi.org/10.3724/SP.J.1258.2014.00027.
[2] 袁婷婷, 董坤, 郭增鹏, 等. 阿魏酸诱导蚕豆枯萎病发生及根系组织结构损伤的化感效应[J/OL]. 植物营养与肥料学报, 2020, 26(5): 914-923[2024-05-01]. https://doi.org/10.11674/zwyf.
19388.
Yuan Tingting, Dong Kun, Guo Zengpeng, et al. Allelopathic effects of ferulic acid inducing Fusarium wilt occurrence and abnormal root tissue structure of faba bean[J/OL]. Journal of Plant Nutrition and Fertilizers, 2020, 26(5): 914-923[2024-05-
01]. https://doi.org/10.11674/zwyf.19388.
[3] Yuan J, Zhao J, Wen T, et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J/OL]. Microbiome, 2018, 6(1): 156[2024-05-01]. https://doi.org/10.1186/s40168-
018-0537-x.
[4] Wen T, Yuan J, He X M, et al. Enrichment of beneficial cucumber rhizosphere microorganisms mediated by organic acid secretion[J/OL]. Horticulture Research, 2020, 7(1): 154[2024-05-01]. https://doi.org/10.1038/s41438-020-00380-3.
[5] Ren G D, Meng T Z, Ma Y. Sugars altered fungal community composition and caused high network complexity in a Fusarium wilt pathogen-infested soil[J/OL]. Biology and Fertility of Soils, 2020, 56(3): 395-409[2024-05-01]. https://doi.org/10.1007/
s00374-019-01424-0.
[6] Wu H M, Qin X J, Wang J Y, et al. Rhizosphere responses to environmental conditions in Radix pseudostellariae under continuous monoculture regimes[J/OL]. Agriculture, Ecosystems and Environment, 2019(270/271): 19-31[2024-05-01]. https://
doi.org/10.1016/j.agee.2018.10.014.
[7] Gu Y A, Wang X F, Yang T J, et al. Chemical structure predicts the effect of plant-derived low-molecular weight compounds on soil microbiome structure and pathogen suppression[J/OL]. Functional Ecology, 2020, 34(10): 2158[2024-05-01]. https://
doi.org/10.1111/1365-2435.13624.
[8] Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J/OL]. Annual Review of Plant Biology, 2006, 57: 233-266[2024-05-
01]. https://doi.org/10.1146/annurev.arplant.57.032905.105159.
[9] Al-Ali A, Deravel J, Krier F, et al. Biofilm formation is determinant in tomato rhizosphere colonization by Bacillus velezensis FZB42[J/OL]. Environmental Science and Pollution Research International, 2018, 25: 29910-29920[2024-05-01]. https://doi.org/10.1007/s11356-017-0469-1.
[10] Liu Y P, Chen L, Wu G W, et al. Identification of root-secreted compounds involved in the communication between cucumber, the beneficial Bacillus amyloliquefaciens, and the soil-borne pathogen Fusarium oxysporum[J/OL]. Molecular Plant-
Microbe Interactions, 2017, 30(1): 53-62[2024-05-01]. https://
doi.org/10.1094/MPMI-07-16-0131-R.
[11] 赵卫松, 郭庆港, 董丽红, 等. L-脯氨酸对枯草芽胞杆菌NCD-2菌株生物膜形成的影响[J/OL]. 植物病理学报, 2021, 51(1): 115-122[2024-05-01]. https://doi.org/10.13926/j.cnki.apps.000513.
Zhao Weisong, Guo Qinggang, Dong Lihong, et al. Effect of L-proline on biofilm formation of Bacillus subtilis NCD-2[J/OL]. Acta Phytopathologica Sinica, 2021, 51(1): 115-122[2024-05-01]. https://doi.org/10.13926/j.cnki.apps.000513.
[12] Chen S C, Yu H J, Zhou X G, et al. Cucumber (Cucumis sativus L.) seedling rhizosphere Trichoderma and Fusarium spp. communities altered by vanillic acid[J/OL]. Frontiers in Microbio-
logy, 2018, 9: 2195[2024-05-01]. https://doi.org/10.3389/fmicb.
2018.02195
[13] Wang Z L, Zhang J H, Wu F Z, et al. Changes in rhizosphere microbial communities in potted cucumber seedlings treated with syringic acid[J/OL]. PLoS One, 2018, 13(6): e0200007[2024-05-01]. https://doi.org/10.1371/journal.pone.0200007.
[14] 田晴, 高丹美, 李慧, 等." 小麦根系分泌物对西瓜连作土壤真菌群落结构的影响[J/OL]. 中国农业科学, 2020, 53(5): 1018-1028[2024-05-01]. https://doi.org/10.3864/j.issn.0578-
1752.2020.05.013.
Tian Qing, Gao Danmei, Li Hui, et al. Effects of wheat root exudates on the structure of fungi community in continuous cropping watermelon soil[J/OL]. Scientia Agricultura Sinica, 2020, 53(5): 1018-1028[2024-05-01]. https://doi.org/10.3864/j.issn.0578-1752.2020.05.013.
[15] 严文辉, 李志丹, 邓逐流, 等. 番茄根系分泌物苹果酸和丁香酸对土壤细菌群落结构和潜在功能的影响[J/OL]. 江苏农业学报, 2022, 38(5): 1340-1347[2024-05-01]. https://doi.org/10.3969/j.issn.1000-4440.2022.05.021.
Yan Wenhui, Li Zhidan, Deng Zhuliu, et al. Effects of malic acid and syringic acid from tomato root exudates on soil bacterial community structure and potential function[J/OL]. Jiangsu Journal of Agricultural Sciences, 2022, 38(5): 1340-1347[2024-
05-01]. https://doi.org/10.3969/j.issn.1000-4440.2022.05.021.
[16] 杨章明, 王姣, 李石力, 等. 施用外源有机酸对早期烟草青枯病菌的影响[J/OL]. 植物医生, 2018, 31(10): 41-44[2024-05-
01]. https://doi.org/10.13718/j.cnki.zwys.2018.10.028.
Yang Zhangming, Wang Jiao, Li Shili, et al. Effect of applying exogenous organic acids on early tobacco bacterial wilt[J/OL]. Plant Health and Medicine, 2018, 31(10): 41-44[2024-05-01]. https://doi.org/10.13718/j.cnki.zwys.2018.10.028.
[17] Zhou X G, Zhang J H, Pan D D, et al. p-Coumaric can alter the composition of cucumber rhizosphere microbial communities and induce negative plant-microbial interaction[J/OL]. Biology and Fertility of Soils, 2018, 54(3): 363-372[2024-05-01]. https://
doi.org/10.1007/s00374-018-1265-x
[18] Lü J X, Xiao J X, Guo Z P, et al. Nitrogen supply and intercropping control of Fusarium wilt in faba bean depend on organic acids exuded from the roots[J/OL]. Scientific Reports, 2021, 11(1): 9598[2024-05-01]. https://doi.org/10.1038/s41598-021-
89109-3.
[19] Lin Z M, Muhammad U K, Fang C X, et al. Crop allelopathy types: current research status and prospects in China[J/OL]. Chinese Journal of Eco-Agriculture, 2022, 30(3): 343-355[2024-05-01]. https://doi.org/10.12357/cjea.20210418.
[20] 赵卫松, 郭庆港, 崔钠淇, 等. 外源添加L-脯氨酸对棉花黄萎病发生及其根际土壤微生物群落的影响[J/OL]. 中国农业科学, 2024, 57(11): 2143-2160[2024-06-01]. https://doi.org/10.3864/j.issn.0578-1752.2024.11.008.
Zhao Weisong, Guo Qinggang, Cui Naqi, et al. Effects of exogenous addition of L-proline on the occurrence of cotton Verticillium wilt and its soil microbial community in rhizosphere[J/OL]. Scientia Agricultura Sinica, 2024, 57(11): 2143-
2160[2024-06-01]. https://doi.org/10.3864/j.issn.0578-1752.
2024.11.008.
[21] 赵卫松, 郭庆港, 李社增, 等. 土壤添加西兰花残体对棉花根际土壤酶活性的影响及其与碳代谢特征的关系[J/OL]. 中国农业科学, 2023, 56(11): 2092-2105[2024-05-01] https://doi.org/10.3864/j.issn.0578-1752.2023.11.005.
Zhao Weisong, Guo Qinggang, Li Shezeng, et al. Effect of broccoli residues on enzyme activity of cotton rhizosphere soil and relationships between enzyme activity and carbon metabolism characteristics[J/OL]. Scientia Agricultura Sinica, 2023, 56(11): 2092-2105[2024-05-01] https://doi.org/10.3864/
j.issn.0578-1752.2023.11.005.
[22] Feng Y X, Hu Y Y, Wu J S, et al. Change in microbial communities, soil enzyme and metabolic activity in a Torreya grandis plantation in response to root rot disease[J/OL]. Forest Ecology and Management, 2019, 432: 932-941[2024-05-01]. https://doi.org/10.1016/j.foreco.2018.10.028.
[23] Lopez-Moral A, Sanchez-Rodrguez A R, Trapero A, et al. Establishment of a method to collect root exudates from olive plants and its validation by determining the effect of root exudates against Verticillium dahliae[J/OL]. Plant and Soil, 2023, 483: 625-642[2024-05-01]. https://doi.org/10.1007/s11104-
022-05770-1.
[24] Ochola J, Cortada L, Nganga M, et al. Mediation of potato-
potato cyst nematode, G. rostochiensis interaction by specific root exudate compounds[J/OL]. Frontiers in Plant Science, 2020, 11: 649[2024-05-01]. https://doi.org/10.3389/fpls.2020.
00649.
[25] Yang R X, Gao Z G, Liu X, et al. Effects of phenolic compounds of muskmelon root exudates on growth and pathogenic gene expression of Fusarium oxysporum f. sp melonis[J]. Allelopathy Journal, 2015, 35(2): 175-186.
[26] Tan S Y, Yang C L, Mei X L, et al. The effect of organic acids from tomato root exudates on rhizosphere colonization of Bacillus amyloliquefaciens T-5[J/OL]. Applied Soil Ecology, 2013, 64(1):15-22[2024-05-01]. https://doi.org/10.1016/j.apsoil.
2012.10.011.
[27] Ling N, Raza W, Ma J H, et al. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere[J/OL]. European Journal of Soil Biology, 2011, 47(6): 374-379[2024-05-01]. https://doi.org/10.1016/j.ejsobi.2011.08.009.
[28] Lakshmanan V, Kitto S L, Caplan J L, et al. Microbe-associated molecular patterns-triggered root responses mediate beneficial rhizobacterial recruitment in Arabidopsis[J/OL]. Plant Physio-
logy, 2012, 160: 1642-1661[2024-05-01]. https://doi.org/10.
2307/41694020.
[29] Lü H F, Cao H S, Muhammad A N, et al. Wheat intercropping enhances the resistance of watermelon to Fusarium wilt[J/OL]. Frontiers in Plant Science, 2018, 9: 696[2024-05-01]. https://
doi.org/10.3389/fpls.2018.00696.
[30] Liu Y X, Li X, Cai K, et al. Identification of benzoic acid and 3-phenylpropanoic acid in tobacco root exudates and their role in the growth of rhizosphere microorganisms[J/OL]. Applied Soil Ecology, 2015, 93: 78-87[2024-05-01]. https://doi.org/10.1016/j.apsoil.2015.04.009.
[31] Du L S, Zhu Z K, Qi Y Y, et al. Effects of different stoichiometric ratios on mineralisation of root exudates and its priming effect in paddy soil[J/OL]. Science of the Total Environment, 2020, 743: 140808[2024-05-01]. https://doi.org/10.1016/j.scitotenv.2020.140808.
[32] Feng X Y, Wang Q L, Sun Y H, et al. Microplastics change soil properties, heavy metal availability and bacterial community in a Pb-Zn-contaminated soil[J/OL]. Journal of Hazardous Materials, 2022, 424: 127364[2024-05-01]. https://doi.org/10.1016/j.jhazmat.2021.127364.
[33] Hofman J, Vihalek J, Holoubek I. Evaluation of functional diversity of soil microbial communities a case study[J]. Plant and Soil Environment, 2004, 50(4): 141-148.
[34] Wang G H, Jin J, Chen X L, et al. Biomass and catabolic diversity of microbial communities with long-term restoration, bare fallow and cropping history in Chinese Mollisols[J/OL]. Plant and Soil Environment, 2007, 53 (4): 177-185[2024-05-01]. https://
doi.org/10.17221/2313-PSE.
[35] Giller K E, Beare M, Lavelle P, et al. Agricultural intensification, soil biodiversity and agroecosystem function[J/OL]. Applied Soil Ecology, 1997, 6: 3-16[2024-05-01]. https://doi.org/10.1016/
S0929-1393(96)00149-7.
[36] Gorissen A, Van Overbeek L S, Van Elsas J D. Pig slurry reduces the survival of Ralstonia solanacearum biovar 2 in soil[J/OL]. Canadian Journal of Microbiology, 2004, 50: 587-593[2024-05-01]. https://doi.org/10.1139/w04-042.
[37] 李胜华, 谷丽萍, 刘可星, 等. 有机肥配施对番茄土传病害的防治及土壤微生物多样性的调控[J/OL]. 植物营养与肥料学报, 2009, 15(4): 965-969[2024-05-01]. https://doi.org/10.11674/
zwyf.2009.0435.
Li Shenghua, Gu Liping, Liu Kexing, et al. Effects of combined application of organic fertilizers on the control of soilborne diseases and the regulation of soil microbial diversity[J/OL]. Journal of Plant Nutrition and Fertilizers, 2009, 15(4): 965-969[2024-05-01]. https://doi.org/10.11674/zwyf.2009.0435.
[38] 沈凤英, 吴伟刚, 李亚宁, 等. 不同浓度植物根系分泌物微生态效应研究[J/OL]. 生态环境学报, 2021, 30(2): 313-319[2024-05-01]. https://doi.org/10.16258/j.cnki.1674-5906.2021.
02.010.
Shen Fengying, Wu Weigang, Li Yaning, et al. Study on microecological effects of root exudates of garden plants with different concentrations[J/OL]. Ecology and Environmental Sciences, 2021, 30(2): 313-319[2024-05-01]. https://doi.org/10.16258/j.cnki.1674-5906.2021.02.010.
[39] Zhou X G, Wu F Z. P-Coumaric acid influenced cucumber rhizosphere soil microbial communities and the growth of Fusarium oxysporum f. sp. cucumerinum Owen[J/OL]. PLoS One, 2012, 7: e48288[2024-05-01]. https://doi.org/10.1371/
journal.pone.0048288.
[40] 彭雪梅, 敖检玲, 郝守鲜, 等. 外来入侵植物空心莲子草根系分泌物对土壤微生物和酶活性的影响研究[J/OL]. 贵州师范学院学报, 2022, 38(6): 14-19[2024-05-01]. https://doi.org/10.13391/j.cnki.issn.1674-7798.2022.06.001.
Peng Xuemei, Ao Jianling, Hao Shouxian, et al. Study on the effects of extracts from the root system of invasive plant hollow lotus grass on soil microorganisms and enzyme activities[J/OL]. Journal of Guizhou Education University, 2022, 38(6): 14-19[2024-05-01]. https://doi.org/10.13391/j.cnki.issn.1674-7798.
2022.06.001.
[41] 忙顺兰, 罗晓蔓, 丁贵杰. 马尾松幼苗根系分泌物对土壤酶活性和养分的影响[J/OL]. 中南林业科技大学学报, 2021, 41(12): 53-59[2024-05-01]. https://doi.org/10.14067/j.cnki.1673-
923x.2021.12.007.
Mang Shunlan, Luo Xiaoman, Ding Guijie. Effects of root exudates of Pinus massoniana seedlings on enzyme activity and nutrient in soil[J/OL]. Journal of Central South University of Forestry and Technology, 2021, 41(12): 53-59[2024-05-01]. https://doi.org/10.14067/j.cnki.1673-923x.2021.12.007.
[42] 刘泽淼, 王海燕, 李洋, 等. 外源芍药内酯苷对芍药生长发育及根际土壤的影响[J/OL]. 植物生理学报, 2022, 58(5): 873-
888[2024-05-01]. https://doi.org/10.13592/j.cnki.ppj.100043.
Liu Zemiao, Wang Haiyan, Li Yang, et al. Effect of exogenous paeoniflorin on the growth and development of peony and the rhizosphere soil[J/OL]. Plant Physiology Journal, 2022, 58(5): 873-888[2024-05-01]. https://doi.org/10.13592/j.cnki.ppj.100043.
[43] 丁娜, 林华, 张学洪, 等. 植物根系分泌物与根际微生物交互作用机制研究进展[J/OL]. 土壤通报, 2022, 53(5): 1212-1219[2024-05-01]. https://doi.org/10.19336/j.cnki.trtb.2022010201.
Ding Na, Lin Hua, Zhang Xuehong, et al. Interaction mechanism between root secretion and rhizosphere microorganisms: a review[J/OL]. Chinese Journal of Soil Science, 2022, 53(5): 1212-1219[2024-05-01]. https://doi.org/10.19336/j.cnki.trtb.2022010201
[44] 赵卫松, 郭庆港, 李社增, 等. 花铃期棉花黄萎病抗病与感病品种对土壤细菌群落结构的影响[J/OL]. 中国农业科学, 2020, 53(5): 942-954[2024-05-01]. https://doi.org/10.3864/j.issn.0578-1752.2020.05.007.
Zhao Weisong, Guo Qinggang, Li Shezeng, et al. Effect of wilt-resistant and wilt-susceptible cotton on soil bacterial community structure at flowering and boll stage[J/OL]. Scientia Agricultura Sinica, 2020, 53(5): 942-954[2024-05-01]. https://
doi.org/10.3864/j.issn.0578-1752.2020.05.007.
[45] 曾钰, 闫磊, 刘亚林, 等. 外源脯氨酸对缺硼下棉花幼苗生长、生理特性以及脯氨酸代谢的影响[J/OL]. 棉花学报, 2020, 32(3): 258-268[2024-05-01]. https://doi.org/10.11963/1002-
7807.zyjcc.20200509.
Zeng Yu, Yan Lei, Liu Yalin, et al. Effects of exogenous proline on the growth, physiological characteristics, and proline metabolism of cotton seedlings under boron deficiency stress[J/OL]. Cotton Science, 2020, 32(3): 258-268[2024-05-01]. https://doi.org/10.11963/1002-7807.zyjcc.20200509.
[46] 戴茂华, 刘丽英, 庞昭进, 等. 不同棉花品种对干旱胁迫的生理响应及抗旱性评价[J/OL]. 中国农学通报, 2015, 31(21): 98-101[2024-05-01]." https://doi.org/10.11924/j.issn.1000-
6850.casb15020068.
Dai Maohua, Liu Liying, Pang Zhaojin, et al. Evaluations of drought resistance among different cotton varieties[J/OL]. Chin-
ese Agricultural Science Bulletin, 2015, 31(21): 98-101[2024-
05-01]." https://doi.org/10.11924/j.issn.1000-6850.casb15020068.
[47] 杨艳兵, 姜艳丽, 尹晓斐, 等." NaCl胁迫对棉花幼苗生理特性的影响[J/OL]. 山西农业大学学报(自然科学版), 2013, 33(4): 290-294[2024-05-01]. https://doi.org/10.13842/j.cnki.issn1671-
8151.2013.04.011.
Yang Yanbing, Jiang Yanli, Yin Xiaofei, et al. Effect of NaCl stress on the physiological characteristics of cotton[J/OL]. Journal of Shanxi Agricultural University (Nature Science Edition), 2013, 33(4): 290-294[2024-05-01]. https://doi.org/10.13842/j.cnki.issn1671-8151.2013.04.011.
[48] 高彦强, 颉建明, 王成, 等. 外源脯氨酸对盐胁迫下芹菜生长及光合特性的影响[J/OL]. 江西农业大学学报, 2023, 45(2): 322-336[2024-05-01]. https://doi.org/10.13836/j.jjau.2023032.
Gao Yanqiang, Xie Jianming, Wang Cheng, et al. Effects of exogenous proline on growth and photosynthetic characteristics of celery under salt stress[J/OL]. Acta Agriculturae Universitatis Jiangxiensis, 2023, 45(2): 322-336[2024-05-01]. https://doi.org/10.13836/j.jjau.2023032.
[49] 陈奋奇, 方鹏, 白明兴, 等. 外源脯氨酸缓解玉米幼苗盐胁迫的效应[J/OL]. 草业科学, 2022, 39(4): 747-755[2024-05-01]. https://doi.org/10.11829/j.issn.1001-0629.2021-0492.
Chen Fenqi, Fang Peng, Bai Mingxing, et al. Mitigation of salt stress in maize seedlings by exogenous proline application[J/OL]. Pratacultural Sciences, 2022, 39(4): 747-755[2024-05-
01]. https://doi.org/10.11829/j.issn.1001-0629.2021-0492.
(责任编辑:王国鑫 责任校对:秦凡)
