不同清洗剂对金黄色葡萄球菌和铜绿假单胞菌混合物种生物膜的清除作用
2024-01-01祝司霞
祝司霞
摘要:目的 分析金黃色葡萄球菌(Staphylococcus aureus,SA)和铜绿假单胞菌(Pseudomonas aeruginosa,PA)混合物种生物膜的形成及不同清洗剂对医用硅胶膜表面混合物种生物膜的清除效果。方法 利用医用硅胶膜为载体建立SA+PA混合物种体外生物膜模型。采用扫描电子显微镜对SA+PA混合物种生物膜的形成过程进行形态学观察,使用结晶紫法半定量检测生物膜并测定医用硅胶膜表面SA+PA混合物种生物膜黏附曲线,采用菌落计数法定量检测SA+PA混合物种生物膜。使用Zen生物膜特效清洗剂、Intercept生物膜特效清洗剂、鲁沃夫多酶清洗剂(RUHOF)3种清洗剂清洗生物膜,利用上述方法对比分析其对SA+PA混合物种生物膜的清除效果。结果 培养1 d已有菌体黏附于医用硅胶膜表面,3 d时“微菌落”形成,5 d时成熟的SA+PA混合物种生物膜体系形成,且以PA为主要菌种。在3种清洗剂中Zen、Intercept生物膜特效清洗剂对1、3和 5 d的SA+PA混合物种生物膜均有相似的清除作用;RUHOF多酶清洗剂对1和3 d有效,对培养5 d的生物膜清除不佳。结论 培养5 d医用硅胶膜表面形成成熟的SA+PA混合物种生物膜体系,其中PA为优势竞争菌种。Zen、Intercept生物膜特效清洗剂对SA+PA混合物种生物膜的清除效果最佳。
关键词:生物膜清洗剂;铜绿假单胞菌;金黄色葡萄球菌;生物膜;清除
中图分类号:R978.1 文献标志码:A
Scavenging effects of different cleaning agents on mixed biofilms of Staphylococcus aureus and Pseudomonas aeruginosa
Zhu Sixia
(School of Basic Medicine, Panzhihua University, Panzhihua 617000)
Abstract Objective To analyze the formation of mixed biofilms of Staphylococcus aureus (SA) and Pseudomonas aeruginosa (PA) and the removal effects of different cleaning agents on mixed biofilms on the surface of medical silica gel membrane. Methods The in vitro biofilm model of SA+PA mixture was established by using the medical silica gel membrane as the carrier. The formation process of SA+PA mixed biofilm was observed by scanning electron microscope. Semi quantitative detection of biofilm by the crystal violet method, and the adhesion curve of SA+PA mixed biofilm on the surface of the medical silicone membrane was measured. The SA+PA mixed biofilm was quantitatively detected by the colony count method. The biofilm was cleaned with Zen biofilm special cleaning agent, Intercept biofilm special cleaning agent, and RUHOF multi enzyme cleaning agent (RUHOF) respectively, and their removal effects on SA+PA mixture biofilm were compared and analyzed by the above methods. Results After one-day culture, bacteria adhered to the surface of the medical silica gel membrane. The “micro colony” was formed after three-day culture. The mature SA+PA mixture biofilm system was formed after five-day culture, and PA was the main strain. Among the three cleaning agents, Zen and Intercept biofilm special cleaning agents had similar scavenging effects on SA+PA mixture biofilm on 1, 3, and 5 d; RUHOF multi enzyme detergent was effective on 1 and 3 d, but it was not good for biofilm removal after five-day culture. Conclusion A mature SA+PA mixed biofilm system was formed on the surface of the medical silica gel membrane after five-day culture, in which PA was the dominant competitive strain. Zen and Intercept special cleaning agents for biofilm had the best removal effects on SA+PA mixed biofilm.
Key words Biofilm cleaner; Pseudomonas aeruginosa; Staphylococcus aureus; Biofilm; Clean up
医用硅胶材料广泛应用于静脉导管、胃管、导尿管、呼吸机管路和人工关节等医疗器械的同时,也导致生物材料植入感染(biomaterial centered infection,BCI)的发生[1]。定植于机体皮肤、黏膜表面的条件致病菌,常随医用硅胶材料进入机体,医用硅胶材料为细菌提供黏附位点,细菌黏附其表面后形成生物膜。由于生物膜是复杂的多微生物群落,机体免疫系统和抗生素容易杀灭游离的病原菌,却很难杀灭生物膜群体内的病原菌[2],因此生物材料表面生物膜的存在成为BCI等慢性难治性感染的根源。目前,大多数研究集中在单种生物膜,但其实混合物种生物膜才是细菌的主要生活方式,生物膜群落的结构、发育和功能均会受物种间相互作用的影响[3]。因此研究混合物种生物膜更能为解决临床感染问题奠定基础。
有研究发现,金黄色葡萄球菌(Staphylococcus aureus,SA)和铜绿假单胞菌(Pseudomonas aeruginosa,PA)引起的临床混合感染较常见,如姜永广等[4]在骨伤科感染病灶中检测到SA+PA的混合感染(占36.5%),吕柏成等[5]报道在呼吸机相关性肺炎(VAP)患者中常检测出PA、鲍曼不动杆菌、SA和肺炎克雷伯菌等的混合感染。然而有关医用硅胶材料引发的SA+PA混合物种生物膜感染的研究鲜见报道。而且生物材料表面的生物膜黏附力极强,很难用普通清洗方法去除[6],从而导致植入感染的发生。因此,本研究通过建立医用硅胶膜表面SA+PA混合物种生物膜体外模型,探讨混合物种生物膜形成的规律、特点;通过对比不同清洗剂对生物膜的清除效果,为生物材料植入引发的生物膜感染的防治提供经验。
1 材料与方法
1.1 材料
1.1.1 菌株来源
铜绿假单胞菌ATCC27853标准菌株、金黄色葡萄球菌ATCC29213标准菌株,均来自攀枝花市中心医院检验科。
1.1.2 主要试剂
Zen生物膜特效清洗剂(楷腾医疗设备有限公司);Intercept生物膜特效清洗剂(Cantel medical company);鲁沃夫(RUHOF)全效型多酶清洗剂(杭州鲁沃夫货物进出口有限公司);LB营养琼脂(青岛高科技工业园海博生物技术有限公司);胰蛋白胨大豆肉汤(TSB)(上海广锐生物科技有限公司)。
1.1.3 主要仪器
场发射扫描电子显微镜(Sigma 500,美国Sigma);气浴恒温振荡器(THZ-82B,常州市国旺仪器制造有限公司);净化工作台(SW-CJ-2FD,苏州博莱尔净化设备有限公司);恒温恒湿箱(BSC-250,上海博讯实业有限公司医疗设备厂);医用硅胶膜(深圳市嘉杰橡塑有限公司);酶标仪(RT-6100,南京华东电子集团医疗装备有限责任公司);可见分光光度计(722N,上海菁华科技仪器有限公司)。
1.2 方法
1.2.1 建立SA+PA混合物种体外生物膜模型
参照夏京津等[7]方法并加以适当改进,将SA标准株和PA标准株分别用TSB稀释制备成菌悬液,分光光度计测定其A值为0.1(约1×107 CFU/mL)后,两组菌液1:1混合制成混合菌液(SA+PA),放4 ℃冰箱储存备用。设6个复孔,每孔菌液2 mL接种于无菌24孔板,用无菌镊夹取无菌医用硅胶膜片(载体)(0.8 cm×0.8 cm)浸入孔板菌液中。37 ℃培养,隔天更换一次培养液,分别培养0.5、1、2、3、4、5和7 d后,观察或测定生物膜。
1.2.2 扫描电子显微镜观察SA+PA混合物种生物膜
参考张国婧等[8]方法将培养1、3、5和7 d的医用硅胶膜片取出,用2 mL PBS轻轻洗3次,加2.5%戊二醛于室温固定2 h,PBS溶液洗3次。用乙醇梯度脱水,20%、40%、60%、80%、100%、100%和100%梯度各20 min。取出医用硅胶膜片自然干燥,真空喷金。在扫描电镜下观察医用硅胶膜表面SA+PA生物膜形成情况。
1.2.3 结晶紫半定量法检测SA+PA混合物种生物膜
参考邵菊芳等[9]方法,吸弃菌液,用PBS清洗医用硅胶膜片3次,将2%结晶紫染液400 μL加入孔板,轻摇使染色均匀,静置30 min。用PBS清洗载体并取出放入新的孔板。吸取400 μL二甲基亚砜加入孔板,脱色15 min。另取一块96孔板每孔加入100 μL脱色液,用酶标仪在570 nm处分别测量0.5、1、2、3、4、5和7 d的A值。以培养天数为横坐标,A值为纵坐标,绘制SA+PA混合物种生物膜黏附量曲线。
1.2.4 菌落计数法定量检测SA+PA混合物种生物膜
参考任伟等[10]方法,无菌PBS缓冲液清洗培养1、3和5 d医用硅胶膜片,去除浮游菌,将医用硅胶膜片放入含有5 mL PBS的PE管中浸没,置于试管架上,恒温振荡器中22.7 ℃、300 r/min震荡10 min。吸取1 mL震荡菌液用PBS系列10倍稀释,选择稀释度为10-1、10-2和10-3的菌液各1 mL加入无菌平皿(每个浓度3个平皿,按菌落报告原则和方法进行菌落计数),倾注冷却至45 ℃的LB琼脂培养液20 mL,在桌面摇匀,37 ℃恒温恒湿箱培养24 h,进行菌落计数。实际菌落数(CFU/cm2)=肉眼可见菌落计数×稀释倍数/面积,取实际菌落计数的常用对数(lgCFU/cm2)为标准菌落计数单位。
1.2.5 SA+PA混合物种生物膜的清洗
参考倪朝荣、任伟等[11-12]方法,选取培养1、3和5 d的细菌进行清洗實验,从24孔板中取出医用硅胶膜片分别放入装有10 mL不同清洗剂的试管中,实验分4组,Zen生物膜特效清洗剂组(Zen组)、鲁沃夫多酶清洗剂组(RUHOF组)、Intercept生物膜特效清洗剂组(Intercept组)、无菌水组。恒温振荡器中22 ℃、100 r/min清洗5 min,取出医用硅胶膜片放入新的24孔板,PBS清洗3次,洗去残余清洗剂,无菌纱布擦干备用。观察或检测清洗后的医用硅胶膜片表面的生物膜,方法同上(扫描电子显微镜法、结晶紫半定量法、菌落计数法)。
1.2.6 数据处理
应用SPSS 17.0软件分析数据,符合正态分布的计量资料以(x±s)表示,两组计量资料的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 清洗前及清洗后SA+PA混合物种生物膜形态
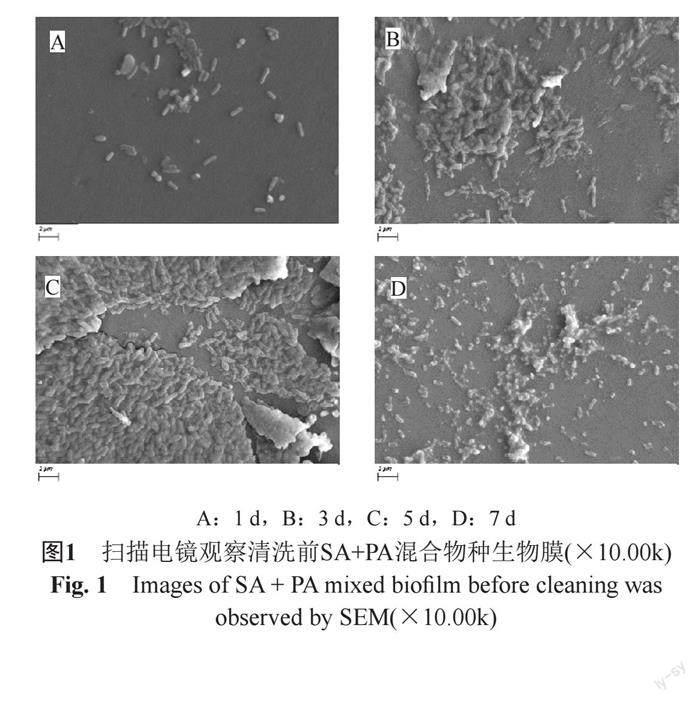
扫描电镜(SEM)下,1 d少量菌体黏附在医用硅胶膜表面,菌体零散分布。3 d“微菌落”形成,菌体分泌胞外多聚物质,彼此黏附簇集。5 d“微菌落”增多,菌体被胞外多聚物质包裹,形成大片厚厚的生物膜牢固黏附在硅胶膜表面,成熟的生物膜体系已经形成,且在整个生物膜体系中PA占有绝对优势,比SA数量多,SA大多被PA包裹。7 d菌体外面的胞外多聚物质基本消失,细菌脱离“微菌落”,散在分布,某些菌体固缩变形。见图1。
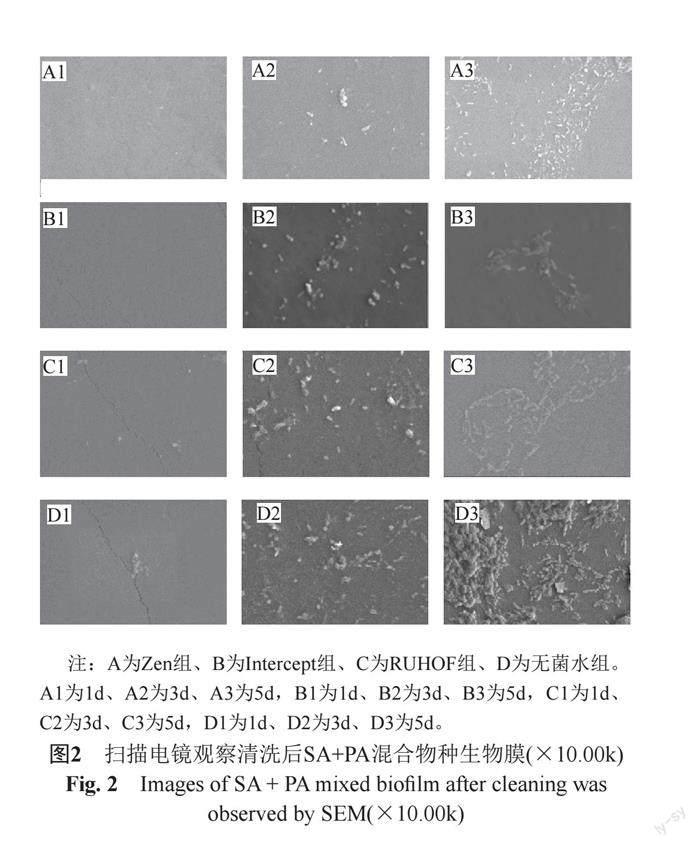
各组清洗剂对1 d生物膜的清洗均较彻底,对3 d生物膜的清洗效果较好,但有少量菌体残留。Zen、Intercept组清洗剂对5 d的生物膜大部分有破坏,但菌体有崩解变形或残留。RUHOF组对5 d的生物膜清洗后有较多的菌体残留。无菌水组虽能部分清除3 d和5 d的生物膜,但与其它清洗剂组相比效果较差。见图2。
2.2 清洗前SA+PA混合物种生物膜黏附量曲线及清洗后半定量检测
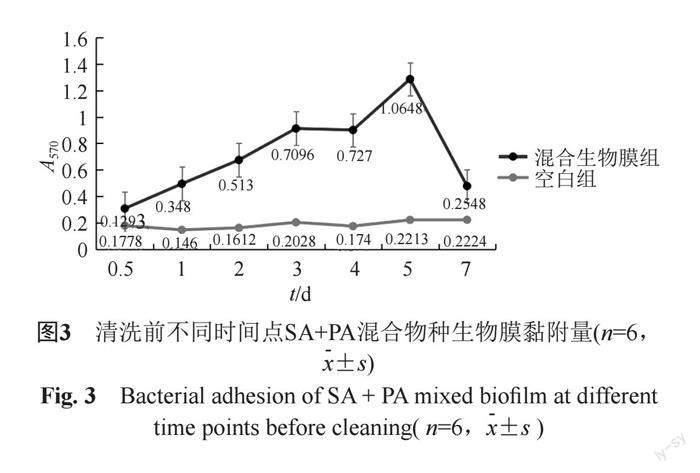
分析清洗前不同时间点SA+PA生物膜黏附量。与空白组比较,1和7 d无显著性差异,其余天数均有显著性差异。生物膜黏附曲线显示生物膜产量呈现逐渐递增的趋势,5 d达到最大生长量,之后急剧下降。具体情况如下:0.5与1 d之间有显著性差异,表明从1 d开始,已有菌体黏附于硅胶膜表面。1与2 d、2与3 d之间无显著性差异。1与3 d之间有显著性差异,生物膜黏附量曲线呈现上升趋势,硅胶膜表面黏附的菌体数量平稳增长。3与4 d之间无显著性差异。4与5 d之间有显著性差异,菌体数量剧增。5与7 d之间有显著性差异,生物膜产量明显下降。见图3。
同种清洗剂对培养1、3和5 d SA+PA生物膜清除作用比较。无菌水组1与3、5 d之间有显著性差异,说明无菌水组只在1 d有效(结合电镜结果)。RUHOF组1与3 d无差异、1和5 d之间有显著性差异,说明RUHOF组在第1、3 d有效。Intercept组和Zen组1、3 和5 d之间比较无显著性差异,Intercept组和Zen组对培养1、3和5 d的SA+PA生物膜均有清除作用。
分析相同培养时间各组清洗剂对SA+PA生物膜细菌量的影响。1 d各清洗剂组与无菌水组比较无显著性差异,说明各组清洗剂还未体现出优于无菌水的清洗效果。3 d Zen、Intercept、RUHOF组与无菌水组比较均有显著性差异,提示清洗剂清洗生物膜效果明显优于无菌水,而3组清洗剂两两比较无显著性差异,说明三者清洗效果相差不大。5 d Intercept、Zen组与无菌水组比较均有显著性差异,但两组清洗剂比较无显著性差异,说明两者清洗效果均优于无菌水组且效果相差不大;RUHOF组对5 d SA+PA生物膜的清除无效。见表1。
2.3 清洗前及清洗后SA+PA混合物种生物膜活菌计数
通过定量实验再次验证,洗前1 d SA+PA混合物种生物膜标准菌落计数为1.9565±0.2324,3 d为2.0808±0.1191,5 d为2.5645±0.5346,提示生物膜细菌数量随培养时间呈现上升趋势。
1 d各清洗剂组与无菌水组比较及各清洗剂组组间比较,SA+PA生物膜菌落计数无显著性差异,说明各组清洗剂对1d的SA+PA生物膜清除效果与无菌水相差不大。
3 d各清洗剂组与无菌水组比较,SA+PA生物膜菌落计数均有显著性差异(P<0.01),说明各组清洗剂对培养3 d的SA+PA生物膜清除效果强于无菌水;但Zen、Intercept、RUHOF组两两比较无显著性差异,提示3组清洗剂对3 d的SA+PA生物膜的清除效果相似。
5 d Zen、Intercept组与无菌水组比较,对SA+PA生物膜清除效果强于无菌水(P<0.05),但两组清洗剂之间比较无显著差异;RUHOF组与无菌水组比较无显著性差异,说明RUHOF组对5d的生物膜清除效果不佳。见表2。
综合电镜观察、结晶紫半定量及菌落计数定量实验分析,各组清洗剂与无菌水组对1 d的SA+PA生物膜清除均有效。除此之外,Intercept、Zen组对
3 d和5 d的SA+PA生物膜均有清除作用且效果相似,RUHOF组对3 d的生物膜清除有效,但对5 d的生物膜清除无效。
3 讨论
本实验突破传统的单一菌种生物膜模型,选择SA+PA混合物种生物膜模型,其原因如下:条件致病性PA菌有单生鞭毛,是生物膜研究的顶尖模式生物之一[13],广泛分布在医院环境中,是医院内感染的重要病原菌之一[14]。此外,近年医疗活动中SA的检出率有升高的趋势,SA可引起皮肤与软组织感染(SSTIs)、肺炎、败血症等多种疾病,是医院获得性感染和社区感染中最重要的致病菌之一[15-16]。研究还发现,PA和SA是临床医疗中常见的共存生物膜菌,Cendra等[17]发现PA和SA是肺部或伤口生物膜中共同生长的主要病原菌。Chew等[18]报道PA和SA形成生物膜共同感染囊性纤维化患者的肺部以及糖尿病和慢性伤口,微生物能建立生物膜联盟,依靠各种不同的策略与其他物种进行社会互动,并获取资源优化生长。李敏等[19]发现多种微生物共同作用会表现出与单菌种不同的致病行为。基于以上原因,本实验选择SA和PA作为实验菌株,建立混合物种生物膜模型。
电镜观察和生物膜黏附量曲线显示,SA+PA生物膜黏附量随培养时间不断增长,培养5 d成熟的SA+PA生物膜体系形成,生物膜厚度和面积均最大化,牢固黏附于载体。需要特别引起注意的是在整个生物膜体系中PA占有绝对优势,PA数量多,覆盖和包裹SA,这与Chew等[18]研究的PA可拮抗SA的生长具有相似性;另有Ozer等[13]在研究生物膜成熟过程中发现野生型的PA生物膜结构与鞭毛敲除菌株相比,更强一个数量级,推测鞭毛在生物膜结构中可能具有支架作用;Magalh?es等[20]发现SA在占主导地位的PA双物种联合体中经历了活的非可培养(Viable but non-culturable,VBNC)狀态;徐瑞瑞[21]报道在混合生物膜中,PA集中在混合生物膜的上层,SA富集在混合生物膜的底层,最终PA能杀灭生物膜中的SA,但杀灭需要一定的时间。上述报道或许能解释本实验中PA为SA+PA混合物种生物膜体系中的优势菌种,但PA如何杀灭或抑制SA需要后续实验进一步探索。本实验还显示,5 d后生物膜产量明显下降,至7 d时细菌生物膜已经崩解,菌体散在分布,固缩变形(电镜)。有研究表明[22],由于细菌被包裹于生物膜内,营养吸收受限制,生物膜成熟后其中的细菌繁殖会减慢,细菌数量亦会相对减少,生物膜也随之老化,黏附力下降。
生物膜的形成给临床抗感染带来诸多不便,李敏等[19]认为顽固生物膜可造成伤口愈合过程中断,是伤口愈合的主要障碍,为了促进伤口愈合,必须清除或破坏生物膜。李文涛等[23]认为医疗机构中复用的医疗器械,因清洁消毒不规范或因长期使用出现磨损等,生物膜的形成概率更高,极易导致病人难治性感染的发生,因此如何有效去除生物膜极为重要。近年来医疗机构广泛关注生物膜的去除,各种清洗、消毒产品被普遍使用。经查阅文献[24-25],本实验选2种生物膜特效清洗剂(Zen和Intercept)和1种多酶清洗剂(RUHOF),比较目前医疗机构常用的这3种内镜清洗剂对生物膜的清除效果,以期对医用硅胶膜表面生物膜去除制剂的选择提供依据。
根据上述生物膜形成实验结果,本实验选择1、3和5 d进行清洗实验。结合形态观察、半定量和定量实验结果,分析如下:各组清洗剂对1 d的SA+PA生物膜清洗均较彻底,可能与1 d生物膜形成少,黏附不牢固有关;Zen、Intercept、RUHOF组对3 d生物膜清除有效,但细菌有少量残留,可能由于随着培养时间延长,细菌繁殖增多,分泌胞外多聚物质增多,生物膜逐渐形成,黏附硅胶膜牢固有关;Zen、Intercept组对5 d生物膜清除有效,而RUHOF清洗剂对5 d生物膜清除效果不佳,仍有大量完整细菌残留,说明对医用硅胶膜表面SA+PA成熟生物膜体系的清除需要更强力的清洗剂。有文献报道[25],生物膜特效清洗剂,能迅速渗透、瓦解和剥离污染物,有效去除或抑制植入医疗器材表面生物膜。而普通多酶清洗剂难以穿透生物膜杀死被黏液性多聚胞外物质包裹的细菌,导致清洗和消毒失败。总之,对5 d成熟生物膜的清除,选择生物膜特效清洗剂比多酶清洗剂和无菌水效果更好。
本实验的局限性及未来研究方向在于:对影响混合物种相互作用和感染的诸多因素知之甚少。对包裹细菌的主要胞外多聚物及其调节剂如何促进或抑制种间行为的机制研究欠缺。后续实验对混合物种生物膜中的SA与PA需单独分离定量分析,进一步探究二者竞争的机制。需深入探索稳定生物膜中SA+PA体外共存的最佳培养条件和环境。临床诊疗中植入患者体内的医用硅胶材料表面生物膜的形成比体外实验要复杂的多,清除的难易程度自然也会有所不同,因此后续将继续跟进研究提供更多的相关数据。
参 考 文 献
李民杰. 大肠杆菌运动调控在生物材料植入感染中的作用研究[D]. 昆明: 昆明医科大学, 2021: 1-26.
阮文鹏. 表皮葡萄球菌agrC特异结合多肽对大鼠中心静脉插管感染作用研究[D]. 昆明:昆明医科大学, 2018: 1-15.
陈萍, 王敬敬, 洪斌, 等. 副溶血性弧菌和单增李斯特菌共培养的混合生物膜的特性//.中国食品科学技术学会第十六届年会暨第十届中美食品业高层论坛论文摘要集[C]. 武汉, 2019: 55-56.
姜永广, 刘文良, 王子伟. 探讨骨伤科混合感染的常见病原菌的分布和耐药性分析[J].世界最新医学信息文摘, 2013, 13(11): 277-277.
吕柏成, 黄嘉正, 冯文聪, 等. 呼吸机相关性肺炎的病原微生物与耐药性分析[J]. 河北医药, 2021, 43(7): 1100-1102.
张波, 单秋实, 刘佳妮, 等. 一元过氧乙酸清除消化内镜生物膜的效果[J]. 中华医院感染学杂志, 2021, 31(4): 607-610.
夏京津, 张海月, 许瑞, 等. 维氏气单胞菌生物膜体外模型的建立及影响因素的研究[J]. 中国兽药杂志, 2015, 49(10): 10-14.
张国婧, 万子琳, 王小燕, 等. 表皮葡萄球菌胞间黏附素基因操纵子对细菌与真菌混合生物膜相关炎症作用影响的体内研究[J]. 中国修复重建外科杂志, 2021, 35(10): 1328-1335.
邵菊芳, 龚春生, 方婷婷, 等. 银杏叶黄酮对大肠杆菌生物膜的抑制作用[J]. 北京化工大学学报(自然科学版), 2021, 48(6): 57-63.
任伟, 黄茜, 石彩晓, 等. 不同培养时间对大肠埃希菌生物膜形成影响[J]. 中国公共卫生, 2013, 29(2): 242-244.
倪朝荣, 朱子福, 吴跃进, 等. 不同清洗剂对消化内镜生物膜的清除效果研究[J]. 中国消毒学杂志, 2019, 36(2): 84-86.
任伟, 黄茜, 周立平, 等. 不同清洗剂对内镜生物膜清除的效果评价[J]. 中华医院感染学杂志, 2011, 21(7): 1382-1384.
Ozer E, Yaniv K, Chetrit E, et al. An inside look at a biofilm: Pseudomonas aeruginosa flagella biotracking[J]. Sci Adv, 2021, 7(24): e8581.
王玉沐, 王麗萍, 杨宝春. 2017—2020年某医院感染铜绿假单胞菌对碳青霉烯类药物耐药情况及其危险因素分析[J]. 中国消毒学杂志, 2022, 39(4): 294-297.
冉德琳, 张朝霞, 吴梅, 等. 2018—2020年皮肤科住院患者金黄色葡萄球菌感染状况及MRSA与MSSA耐药性分析[J]. 中国麻风皮肤病杂志, 2022, 38(7): 430-433.
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241.
Cendra M D M, Blanco C N, Pedraz L, et al. Optimal environmental and culture conditions allow the in vitro coexistence of Pseudomonas aeruginosa and Staphylococcus aureus in stable biofilms[J]. Sci Rep, 2019, 9(1): 16284.
Chew S C, Yam J K H, Matysik A, et al. Matrix polysaccharides and Sia D diguanylate cyclase alter community structure and competitiveness of Pseudomonas aeruginosa during dual-species biofilm development with Staphylococcus aureus[J]. Mbio, 2018, 9(6): e00585-18.
李敏, 吴佳倩, 黄素群. “早期生物膜治疗策略应对难愈伤口: 伤口卫生”国际专家共识解读[J]. 护理研究, 2021, 35(08): 1317-1321.
Magalh?es A P, Grainha T, Sousa A M, et al. Viable but non-cultivable state: a strategy for Staphylococcus aureus survivable in dual-species biofilms with Pseudomonas aeruginosa[J]? Environ Microbiol, 2021, 23(9): 5639-5649.
徐瑞瑞. 环境因素对群体微生物中铜绿假单胞菌与其他微生物相互作用的影响及机理探究[D]. 华南: 华南理工大学, 2020: 100-107.
景春娥, 李萍, 杜欣军, 等. 硅胶表面阪崎克罗诺杆菌生物膜的形态观察[J]. 食品研究与开发, 2016, 37(14): 144-148.
李文涛, 孙志红. 过氧乙酸类消毒剂对生物膜消毒清除效果[J]. 中华医院感染学杂志, 2021, 31(4): 602-606.
沈瑾, 段弘扬, 邱侠, 等. 碱性电解水与医用清洗剂去除细菌生物膜的研究[J]. 中华医院感染学杂志, 2018, 28(7): 979-982.
王淑芳. Intercept生物膜特效清洗剂与普通酶洗液在内镜消毒中的应用效果比较[J]. 当代医学, 2015, 21(19): 147-148.
