Sox9在四氯化碳(CCl4)诱导的肝纤维化模型中的机制研究
2024-01-01吴钟英周国琴李鹏
吴钟英 周国琴 李鹏
(贵阳市公共卫生救治中心,贵州 贵阳 550004)
肝脏因受到诸如酒精、药物或者病毒感染等引起的慢性损伤不能及时的再生性修复时便会形成以纤维化为主要特征的病理性修复[1]。在这个过程中,肝脏中纤维组织过度沉积、降解减少,从而导致纤维增生和分解不平衡的结果。反复或持续的慢性肝实质损伤、炎症可使细胞外基质(Extracellular matrix,ECM)— 主要成分为胶原纤维合成过多而降解相对不足而最终形成肝纤维化,甚至还可能发展为肝硬化、肝功能衰竭和肝癌[2]。Sox9是一种高度保守的转录因子,因其与性别决定基因Y DNA结合位点具有高度相似性而得名[3]。在正常的肝脏中表达Sox9的肝祖细胞会逐渐分化成替代肝脏内的成熟肝细胞[4]。Sox9除作为肝脏祖细胞的特征性分子之外,在多个器官(包括睾丸、胰腺、肠道、大脑、肾脏和心脏)的发育过程中起重要作用[5-7]并调控多种生物学过程,比如促进细胞增殖和癌症的发生等[8]。本研究从CCl4诱导的肝纤维化中分离出肝细胞,并检测到肝细胞中的Sox9在肝脏纤维化过程中的增加,在细胞水平探讨Sox9在四氯化碳(CCl4)诱导的肝纤维化模型中的作用机制。现报告如下。
1 材料与方法
1.1动物 SPF级雄性C57小鼠40只,4周龄,体质量(20±2)g;本研究的动物实验程序经贵州医科大学动物实验伦理委员会批准(批准号2001161)。所有动物饲养在贵州医科大学动物实验中心恒温22~24℃,相对湿度50%~60%,光照/黑暗周期12 h的特定无病原体条件下。
1.2主要药物与试剂 四氯化碳(CCl4,规格:500 ml,批号:201986,徐州天鸿化工有限公司);抗Sox9(1:50 00,ab185966,Abcam,美国)。玉米油(规格:500 ml,批号:1020B053,北京索莱宝科技有限公司)。
1.3主要仪器 仪器SN267839连续波长酶标仪,美国BioTek公司产品;DYY-BC电泳仪、北京六一生物科技有限公司,CFX96荧光定量聚合酶链反应(Polymerase chain reaction,PCR)仪,美国伯乐公司产品,C600凝胶成像系统,Azure公司。
1.4方法
1.4.1分组与造模 将40只4周龄C57小鼠适应性饲养7 d后,随机分为空白组(10只)和模型组(30只)。造模方法参考文献[9-10],模型组腹腔注射体积分数为10%的CCl4溶液(按照玉米油:CCl4=9∶1配制而成),每次注射剂量5ml/kg,3次/w,持续5 w,制造HF模型。空白组,经腹腔注射等体积生理盐水,3次/w,持续5 w。3~4w后,每组随机抽取3只小鼠,对其进行肝组织染色检验,显示建立CCl4诱导小鼠HF模型成功。
1.4.2动物一般状态 实验过程中每日观察并记录各组小鼠的精神、饮食、活动、体质量、皮毛等情况。
1.4.3小鼠肝组织形态学变化 取出小鼠部分肝脏组织,以4%多聚甲醛固定24 h,流水冲洗数小时(3~8 h),浓度梯度酒精法进行脱反复脱水、二甲苯透明、浸蜡、组织包埋、组织切片、贴片、化蜡、封闭、孵育一抗、二抗等按标准流程进行。然后镜下观察,并染色观察肝组织病理学变化。
1.4.4Western印迹检测小鼠肝组织中Sox9蛋白表达量 用全蛋白提取试剂盒,提取C57小鼠肝组织蛋白,经二喹啉甲酸(Bicinchoninic acid,BCA)蛋白含量检测试剂盒,测定小鼠肝脏组织中蛋白浓度。每孔加18μg样品,数小时后蛋白分离,取胶并切割胶块,随后将转膜液润湿的海绵、滤纸、胶、PVDF膜、滤纸、海绵的依次入在转膜夹板中夹紧,放置于转膜槽倒入转膜液,将电泳槽整体泡在冰水混合物中,转膜成功后,经5%脱脂奶粉在常温下进行封闭4 h,再进行洗膜3次后,5 min/次。后加入兔抗-Sox9(1∶1 000)、兔抗-GAPDH(1∶1 000),4℃过夜,次日收取一抗,后洗膜3次,5 min/次。加入山羊抗兔的二抗(1∶1 000),室温孵育2 h,洗膜3次后,图像采集,Image J软件分别计算Sox9与GAPDH灰度值的比值。
1.4.5实时荧光定量PCR法检测小鼠肝组织中Sox9的表达水平 取小鼠肝组织80~100 mg,加入TRIzol后,用剪刀剪碎,放在-80 ℃冰箱预冷并转入研磨器中,加入氯仿,12 000 g的离心力离心,可见EP管中出现分层,上层为透亮色,下层为粉红色,将上层吸取液体转移至另一个EP管中,滴加氯仿,加入冰箱预冷的异丙醇,剧烈震荡使其充分混匀,离心力离心10 min,加入70%乙醇震荡,离心力离心弃上清液,加入DEPC水溶解RNA,1μl溶解的RNA,超微量紫外分光光度计上测量RNA的浓度和纯度。严格按照试剂盒要求及说明书合成cDNA,设计引物,反应条件:预变性95℃ 30 s变性95℃ 10 s退火65 ℃ 10s延伸72 ℃ 30 s,其中变性95 ℃ 10 s退火65 ℃ 10 s延伸72 ℃ 30 s这个过程循环40次。以GAPDH为内参进行PCR扩增。
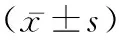
2 结 果
2.1一般情况 正常对照组小鼠生长状态良好,毛色光亮,双眼有神,反应敏锐,饮食正常,体质量逐增,无死亡情况。而模型组小鼠,皮毛发黄且造模,2~3W后小鼠大部分出现炸毛现象,双眼乏神,行动缓慢、反应迟钝,食量减退,较同时期空白组小鼠体质量减轻。
2.2Sox9在四氯化氮诱导的肝纤维化模型中表达升高 通过qRT-PCR的使用,检测CCl4诱导的肝纤维化小鼠模型中Sox9的表达,结果表明CCl4诱导后肝组织中Sox9显著增加,并在肝纤维化发展中保持高水平(图1)。如图所示:CCl4诱导后肝组织中Sox9的表达在1W、2W、3W后逐渐升高,而正常对照组变化不明显。
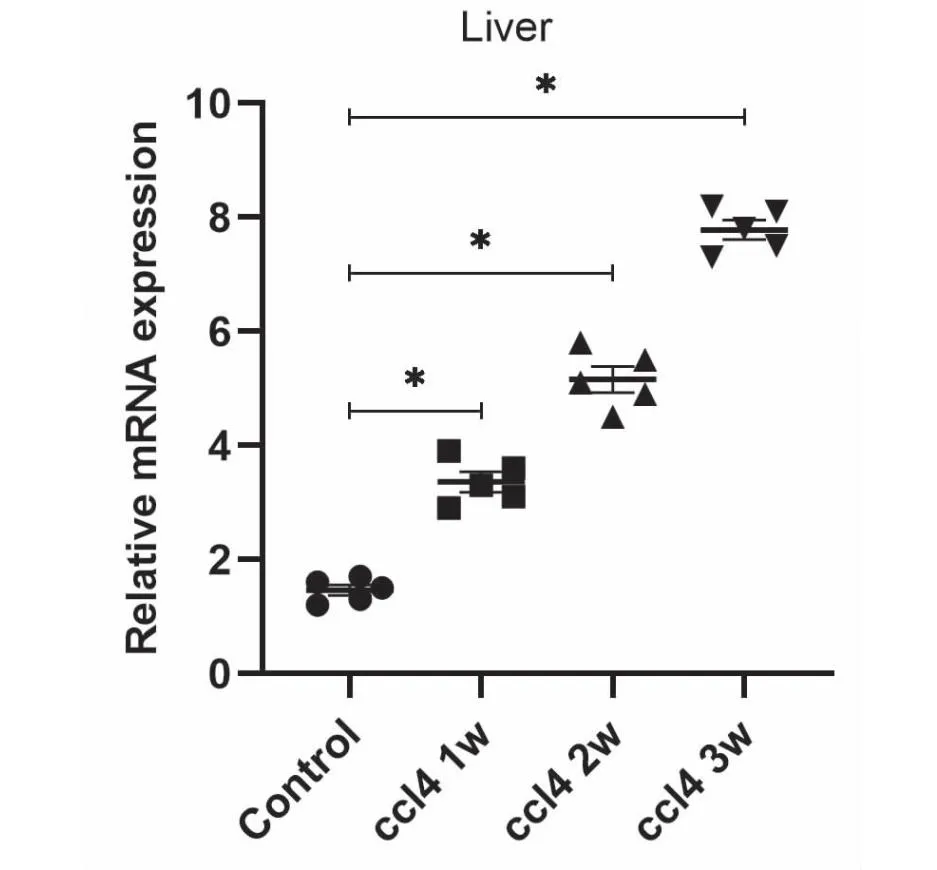
图1 Sox9在四氯化氮诱导的肝纤维化模型中表达升高
2.3Western印迹检测小鼠肝组织中Sox9蛋白表达量升高 提取3W、4W的肝脏组织,经Western 印迹检测发现,Sox9的蛋白表达量升高明显,明显高于正常对照组(图2)。可见在肝纤维化过程中,Sox9发挥重要作用。
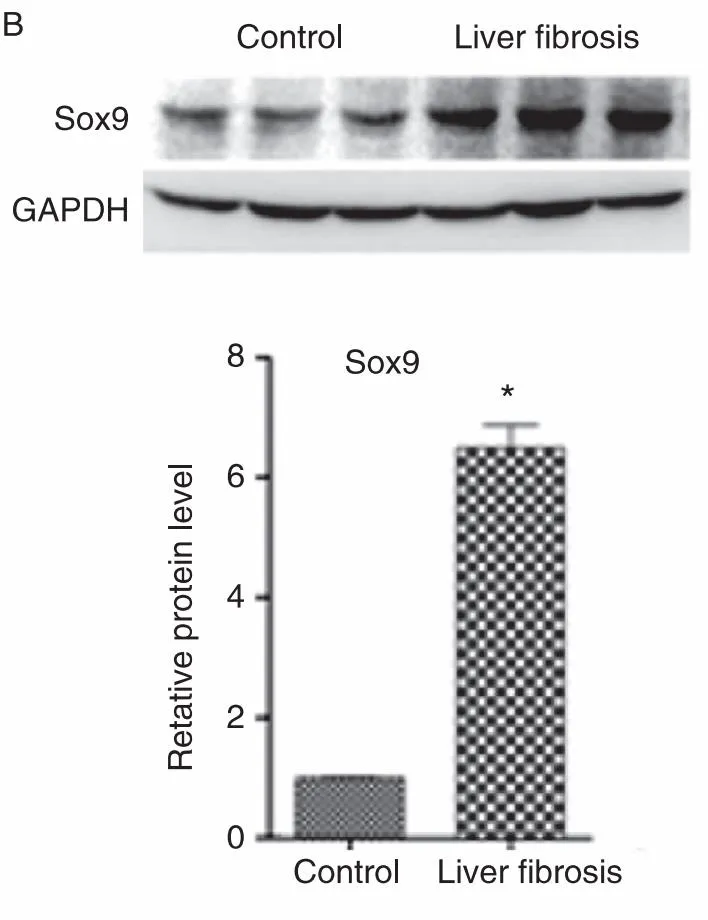
图2 Western印迹中,正常肝组织与CCl4诱导的纤维化肝脏中Sox9分子的表达
2.4经免疫组化验证四氯化氮诱导的肝纤维化模型中Sox9表达量升高。然后,我们用Sox9特异性抗体对纤维化肝脏进行染色,并证实了纤维化肝脏不同细胞成分中Sox9的增加(图3)。
图3 免疫组化中,对照组与四氯化氮诱导的肝组织中Sox9分子的表达
3 讨 论
肝纤维化是以肝内纤维组织过度沉积、降解减少为主要病理特征的疾病,这主要是因为肝脏受到慢性损伤时不能及时修复而引起的病理性修复。在肝纤维化形成的过程中,即有肝星状细胞(Hepatic stellate cell,HSC)的活化,也有免疫细胞的募集和表型的改变,并伴随着肝实质细胞上皮向间质细胞的转变(Epithelial-mesenchymal transition,EMT)。目前对肝纤维化的研究均集中在HSC的激活、肝内免疫细胞的功能改变以及肝实质细胞EMT的分子调控机制,并有可能通过干预这些过程达到逆转和缓解肝纤维化进程的目的。作为肝脏结构和功能的主要细胞,肝细胞在受到损伤后,一部分细胞会凋亡坏死,另外一部分会在损伤的肝脏微环境境中发生特异性的细胞表型转变,即EMT的发生,而肝细胞向间质细胞转变会促进肝纤维化的形成,这个过程往往受多种促纤维化分子(比如:TGF-β)的调节[12]。Sox9是一种高度保守的转录因子,被认为与肝纤维化过程中细胞外基质产生关系密切。正常肝内胆管存在表达Sox9的肝祖细胞,通过细胞谱系示踪显示,在正常的肝脏中表达Sox9的肝祖细胞会逐渐分化成替代肝脏内的成熟肝细胞,在CCl4和胆管结扎两种损伤模型中,表达Sox9的肝祖细胞就会增殖分化为肝实质细胞来修复损伤的肝脏[13]。Sox9除作为肝脏祖细胞的特征性分子之外,在多个器官的发育过程中起重要作用并调控多种生物学过程,比如在神经嵴细胞的迁移过程中起到调节EMT24-26和促进细胞增殖和癌症的发生等[14]。但在不同发育阶段, Sox9的任何不正常的表达量或异位表达都可能导致疾病[15]。另外,在损伤的修复过程中需要干细胞的活化,Sox9可能通过影响干细胞的功能导致组织细胞的恶变,如Sox9在膀胱癌中的表达是明显上调的,但在在膀胱损伤修复中是激活的[16]。沉默或降低细胞中Sox9的水平后,细胞分裂和细胞的增殖有关的磷酸化组蛋白3 表达量均明显减少[17]。Sox9作为一种转录因子,在不同器官的纤维化发展过程中调节成纤维细胞中的骨桥蛋白(Osteopontin,OPN)和胶原。最新报告显示,通过对Sox9缺失的HSC的转录组学和实验分析和功能分析,超过30%的Sox9调控的基因与ECM有关[18]。我们已证明,在CCl4诱导的肝纤维化模型中,Sox9的蛋白浓度会随着纤维化的严重程度而改变。到目前为止,肝细胞Sox9在肝纤维化进展中的失调仍有许多待确定。在这里,我们从CCl4诱导的肝纤维化中分离出肝细胞,并检测到肝细胞中的Sox9在肝脏纤维化过程中的增加。那么,Sox9在小鼠肝纤维化中的作用能否在人类身上表达一致:人类肝损伤后Sox9的检测结果与在小鼠身上观察到的结果是否相同;在我们的研究者中发现,小鼠肝脏中Sox9表达的量与纤维化的严重程度密切相关;那么,Sox9在疾病早期的表达量,是否与预测人类肝纤维化的进展程度有关。同时,Sox9表达量,与其他纤维化风险指标比较是否更有优势、表现更好,不得而知。并且可能有助于肝纤维化患者的分层,如肝纤维化、肝硬化风险评分,需要更多的研究及关注。
