不同类型DNA提取试剂盒提取牦牛乳粉DNA效果的比较
2023-12-31燕妮杨莉彭兰兰段鹏郭娇娇

doi:10.3969/j.issn.1672-6375.2023.11.007
摘 要:以牦牛乳粉为材料,采用了细胞/组织/血液基因组提取试剂盒、植物基因组提取试剂盒及食物核酸提取试剂盒3种不同类型的DNA提取试剂盒提取牦牛乳粉的基因组DNA,使用核酸和蛋白质分析仪检测后表明3种提取方法获得的DNA浓度相近;使用牦牛线粒体中细胞色素b的DNA序列特异性探针引物对所得的3种DNA进行实时荧光PCR,都获得了特异性扩增。结果表明3种类型的DNA提取试剂盒提取的牦牛乳粉基因组DNA都可以用于牦牛乳粉的分子特异性研究,综合提取操作的难易程度、耗时长短、成本高低及提取DNA的浓度分析,细胞/组织/血液基因组提取试剂盒为最佳选择。但食物核酸提取试剂盒的提取步骤简单,消解更彻底,更适用于一次性提取较多样本的基因组DNA。
关键词:牦牛乳粉;基因组;DNA提取
中图分类号:TS252" " " " " " " " " " " " " " " " " " " " " " " " " " " " " " 文献标志码:A
随着人们生活质量的提高,乳及乳制品逐渐成为人们主要膳食组成,主要包括牛乳、羊乳等,近年来随着人们需求的不断增长,又开发了牦牛乳、骆驼乳、绵羊乳、驴乳等类型产品[1]。牦牛多分布在我国西藏、四川、青海一带高海拔地区,耐寒、耐低温、耐缺氧等特质与得天独厚的生长环境优势,使其产出的乳品有着“天然浓缩奶”之称。各种乳及乳制品中的主要营养成分大致相同,其含量可能会因其种类不同存在一定的差异。牦牛乳中富含各种氨基酸、钙、铁、锌、维生素等营养物质,与普通牛乳相比,牦牛乳含有更高水平的功能性脂肪酸和蛋白质,此外牦牛乳中还含有多种活性物质,如共轭亚油酸、二十碳四烯酸、二十二碳六烯酸等不饱和脂肪酸,免疫球蛋白、乳铁蛋白等免疫因子及溶菌酶、乳糖酶等生物活性酶,具有高蛋白、低过敏源性和易吸收等特点[2-3]。除此之外,牦牛种群特殊的生长环境使得牦牛乳还具有一定的耐缺氧、抗疲劳和抗氧化等功能。总的来说,牦牛乳是一种优质的乳制品,随着人们对健康营养的重视程度不断增加,牦牛乳含有的丰富营养成分使它逐渐成为消费者所青睐的选择之一[4-5]。
近年来,针对牦牛乳制品分子生物学层面的鉴别、溯源等研究逐渐增多,然而由于牦牛乳粉在加工过程当中经过了巴氏杀菌、均质、浓缩、喷雾干燥以及二次干燥等多道工序,因此经过湿法工艺或是干法工艺加工而成的乳粉成品中所含的蛋白质、脂肪含量较高,DNA含量较少,并且片段破碎比较严重,基因组DNA的提取存在一定难度。目前常用的牦牛乳粉基因组DNA提取方法包括酚/氯仿法、十六烷基三甲基溴化铵法(CTAB法)及商品化试剂盒等,为提高提取效率科研人员通常会选择试剂盒法来提取基因组DNA,因此选择合适的快速提取牦牛乳粉基因组的DNA提取试剂盒将为后续基因检测、基因鉴定、分子溯源等分子生物学实验提供有效的技术支持。
1 材料与方法
1.1 材料与仪器
牦牛乳粉样品,购自市场;血液/细胞/组织基因组DNA提取试剂盒、植物基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;食物核酸提取试剂盒(Dneasy mericon Food Kit),购自凯杰企业管理(上海)有限公司;Premix Ex TaqTM(Probe qPCR),购自宝生物工程(大连)有限公司。
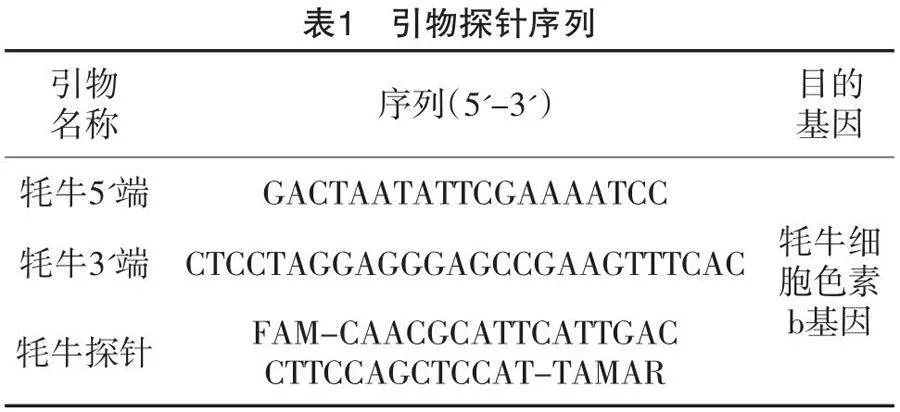
参考SN/T 4397—2015《出口食品中牦牛源性成分的检测方法实时荧光PCR法Dneasy mericon》[6],以牦牛的线粒体细胞色素b基因作为靶基因,合成特异性引物和探针,引物探针序列详见表1,由擎科生物合成。
电子天平 Mettler Toledo;全波长超微量分光光度计 Thermo;ViiA7 实时荧光PCR仪(美国ABI公司)。
1.2 实验方法
1.2.1 样品制备
分别使用细胞/组织/血液基因组提取试剂盒、植物基因组提取试剂盒及食物核酸提取试剂盒3种不同类型的DNA提取试剂盒提取样品基因组DNA,以500 mg 牦牛乳粉样本作为样本起始,利用上述 3 种基因组提取试剂盒分别进行基因组DNA的提取,最后使用 80 μL洗脱液进行洗脱,其他具体提取步骤按照试剂盒所提供的操作步骤进行。
1.2.2 DNA浓度测定
采用全波长超微量分光光度计对提取的基因组DNA进行浓度和纯度测定,以不同试剂盒的洗脱液为各自的空白对照,吸取1 μL待测基因组DNA样品进行测定,记录每个样品的DNA浓度值(ng/μL),每个样品做3个平行,并将提取好的基因组DNA置于-20 ℃ 冰箱保存备用。
1.2.3 实时荧光PCR实验
以牦牛的线粒体细胞色素b基因作为靶基因,用提取的牦牛乳粉基因组DNA作为模板进行实时荧光PCR实验,反应体系为:Premix Ex TaqTM(Probe qPCR)预混液10 μL,牦牛5’ 端及3’端引物(10 μmol/L)各0.8 μL,探针(10 μmol/L)1 μL,模板 5 μL,RoxⅡ0.4 μL,ddH2O 2 μL,总体积共20 μL。
扩增程序为:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,57 ℃ 延伸30 s,运行40个循环。
2 结果与分析
2.1 DNA浓度比较
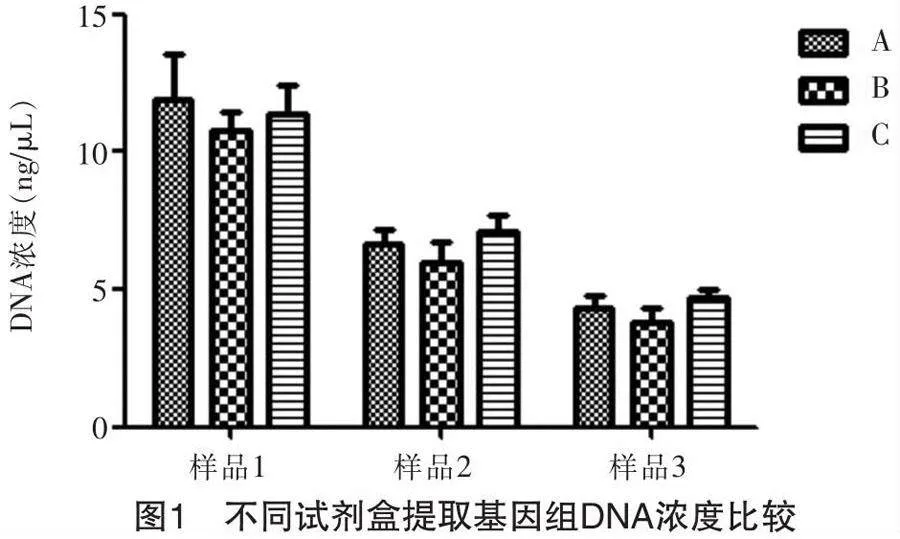
试剂盒A(细胞/组织/血液基因组提取试剂盒,下同)、试剂盒B(植物基因组提取试剂盒,下同)及试剂盒C(食物核酸提取试剂盒,下同)3种不同类型的试剂盒提取牦牛乳粉基因组DNA 的浓度比较,如图1所示。
结果表明:样品一试剂盒A提取结果为11.87 ng/μL,A260/A280值为1.76;试剂盒B为10.80 ng/μL,A260/A280值为1.63;试剂盒C为11.40 ng/μL,A260/A280为1.83。样品二试剂盒A提取结果为6.67 ng/μL,A260/A280值为1.85;试剂盒B为6.00 ng/μL,A260/A280值为1.77;试剂盒C为7.07 ng/μL,A260/A280值为1.89。样品三试剂盒A提取结果为4.30 ng/μL,A260/A280值为1.79;试剂盒B为3.83 ng/μL,A260/A280值为1.65;试剂盒C为4.73 ng/μL,A260/A280值为1.87。从结果看出,针对同一样品,试剂盒B提取的DNA浓度较试剂盒A、C的低。DNA的纯度常由A260/A280的比值表示,比值在1.8~2.0范围内,说明DNA纯度较高,比值小于1.8说明可能有蛋白质污染,比值大于2.0则说明可能有RNA污染。本实验采用全波长超微量分光光度计测量所提取基因组DNA发现,上述实验中提取的基因组DNA中部分DNA样品A260/A280的比值低于1.8,表明所提取的DNA可能有蛋白质污染,这可能是由于牦牛乳粉中含有大量的蛋白质,这些蛋白质很难从基因组DNA中分离出来,最终与基因组DNA共同沉淀导致的。
综上所述,细胞/组织/血液基因组提取试剂盒及食物核酸提取试剂盒对同一样本提取的基因组DNA浓度较高,植物基因组提取试剂盒提取的基因组DNA浓度较低;食物核酸提取试剂盒提取的基因组DNA 纯度较好。
2.2 实时荧光PCR实验
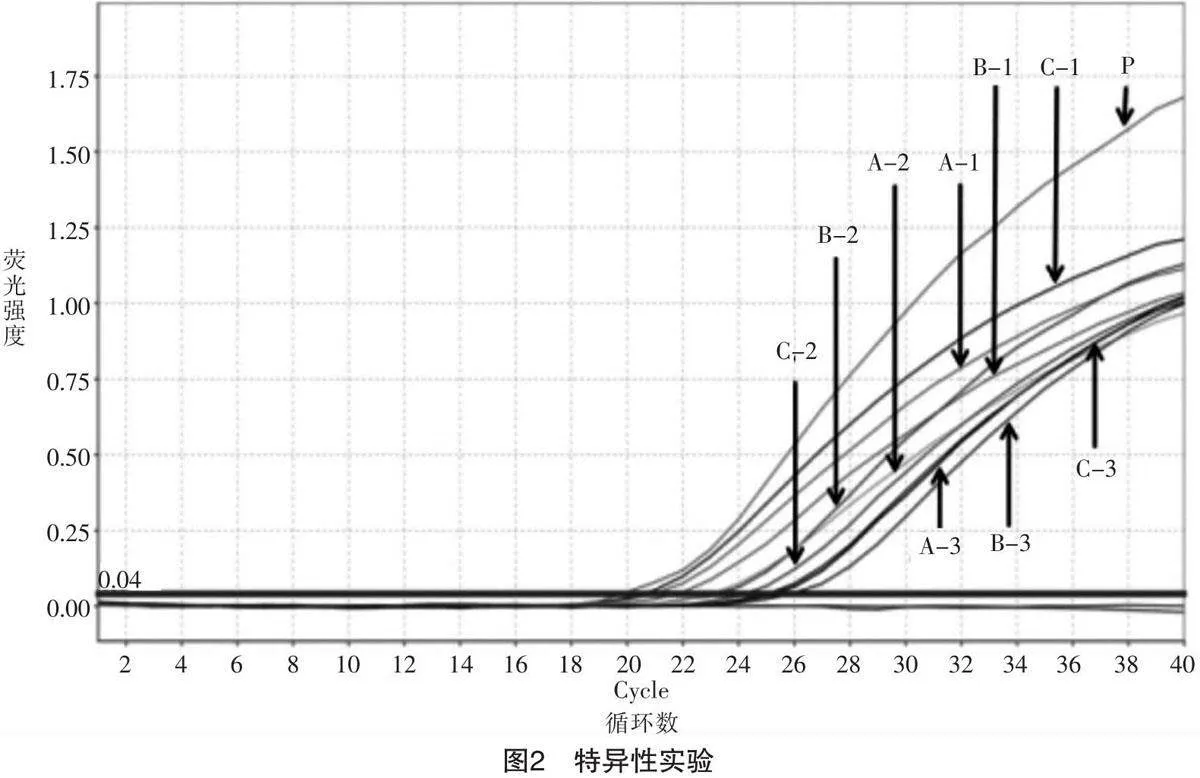
用牦牛特异性引物探针对A组、B组及C组3种不同类型的试剂盒提取的牦牛乳粉基因组DNA 进行实时荧光PCR实验,结果如图2所示。以试剂盒A提取的样品一的基因组DNA标记为A-1,以试剂盒B提取的样品一的基因组DNA标记为B-1,以试剂盒A提取的样品二的基因组DNA标记为A-2,以此类推。结果表明,以这3种试剂盒提取的基因组DNA分别作为模板,扩增牦牛的线粒体细胞色素b基因,均可获得特异性扩增曲线且Ct值小于35,因此这3种试剂盒提取的基因组DNA都可以满足后续实时荧光PCR检测的要求。
2.3 不同基因组提取试剂盒的基本特征对比
综合比较3种基因组提取试剂盒方法操作的难易程度、耗时长短、成本高低,结果见表2。试剂盒A(细胞/组织/血液基因组提取试剂盒)、试剂盒B(植物基因组提取试剂盒)及试剂盒C(食物核酸提取试剂盒)3种不同类型的试剂盒提取原理相近,操作步骤简单,耗时较短,均在3 h以内,但相比较而言,试剂盒C耗时最短;在成本方面,由于进口试剂盒往往价格昂贵、货期长,因此试剂盒C的提取成本(约为80元/样本)远高于试剂盒A和试剂盒B的提取成本(约为8元/样本)。结果表明,试剂盒C在操作的难易程度、耗时长短及提取DNA 的浓度及纯度分析的表现上均优于试剂盒A和试剂盒B;但若考虑经济成本,试剂盒A可能是试剂盒C的一种替代选择。
3 结论与讨论
基因组 DNA 是生物遗传信息的载体,是最重要的生物信息分子,在研究过程中保证基因组 DNA 的完整性和纯度是分子生物学研究的基础。由于牦牛乳粉加工过程中的机械作用、热效应以及化学处理等对DNA的含量和完整性会造成影响,再加上牦牛乳粉中蛋白质、脂肪、糖类等物质含量较高,DNA含量相对较少,一定程度上干扰乳粉基因组DNA的提取效率和后续分子生物学的实验效果。
传统的乳粉基因组DNA提取方法有十二烷基硫酸钠法(SDS法)、热解法、酚/氯仿法、异硫氰酸胍法、高盐低pH法和十六烷基三甲基溴化铵法(CTAB法)等[7],但传统方法耗时较长、所用试剂毒性较大,长时间操作对实验人员的健康有较大影响,且在提取过程中核酸的损失量较大,回收率较低。相比之下,商品化的基因组DNA 提取试剂盒通过对裂解液、洗脱液、沉淀液等试剂以及吸附材料的优化,从而得到纯度更高的 DNA 产物,同时在提取过程中有效避免了传统方法中使用有机试剂对环境和实验人员的危害,常用的试剂盒法原理主要包括磁珠法、离心柱法和树脂法等。此外商品化试剂盒实验还具有操作步骤简洁明了、提取时间短、产物纯度高、可重复性等优点,因此近年来应用范围较为广泛。
由于牦牛乳粉的特殊加工工艺及提取DNA时采用的样本较少,导致上述实验中3种商品化试剂盒提取的基因组DNA浓度总体较低。DNA模板的浓度与纯度决定着后续分子生物学试验是否能够成功,浓度过低可能会降低PCR灵敏度,造成假阴性结果,因此在实验中还需想办法提高提取的基因组DNA浓度。尹丹韩等[8]通过将乳粉完全溶解后离心富集的方法,对沉淀物进行基因组DNA提取,可有效提高提取的DNA浓度。陈筱婷[9]也采取了富集提取的方法,同时在样本前处理中去除脂肪以减少对后期洗脱的干扰,并且与常规只提取沉淀中DNA的做法不同,对上清液和沉淀物都进行了DNA的提取,并对收集到的裂解液采用了分次、等量过柱的方法全部过柱,以获得更大的提取浓度。吴晓云[10]通过对牛乳粉DNA基因组提取方法进行了裂解时间、洗脱次数和富集次数的比较,发现50 min的裂解时间更适合于牛乳粉蛋白变性,从而使体细胞裂解释放出DNA。因此,在使用基因组DNA提取试剂盒的基础上,通过对样品前处理过程进行优化和改良,可有效提高基因组DNA的提取浓度。首先,可通过增大样本的初始量,采用富集大量提取的方法提高牦牛乳粉中DNA的浓度;其次,由于牦牛乳粉中蛋白质、脂肪含量丰富,在加裂解液之前,先加入无菌水溶解乳粉再通过离心将脂肪分离去除,以防止后续提取过程中堵塞DNA吸附柱;最后,选择合适的裂解时间,并在裂解液过柱和洗脱环节采用少量多次的方法,提高样本DNA的最终浓度。
本研究以牦牛乳粉为材料,通过比较细胞/组织/血液基因组提取试剂盒、植物基因组提取试剂盒及食物核酸提取试剂盒3种不同类型的核酸提取试剂盒对牦牛乳粉基因组DNA提取效果的影响,综合提取操作的难易程度、耗时长短、成本高低及提取DNA 的浓度分析,细胞/组织/血液基因组提取试剂盒为最佳选择。牦牛乳粉生产工艺的特殊性会导致其基因组DNA降解和片段化,食物核酸提取试剂盒虽然提取成本较高,但可以回收短 DNA 片段(低至 100 bp),即使是高度片段化的DNA也能被有效分离,同时提取步骤简单易操作、消解较完全、提取效率较高,更适用于一次性提取较多微量样本的基因组DNA。
参考文献:
[1]" 李龙柱,张富新,贾润芳,等. 不同哺乳动物乳中主要营养成分比较的研究进展[J]. 食品工业科技,2012,33(19):396-400.
[2]" 崔广智,罗丽,苏德亮,等. 甘南全脂牦牛乳粉营养成分分析[J]. 食品工业,2020,41(9):333-335.
[3]" 宋礼,罗丽,李顺成,等. 甘南牦牛乳功能性营养成分含量研究[J]. 食品工业,2022,43(10):323-325.
[4]" 高宇,汪家琦,戴智勇,等. 牦牛乳营养组分及功能特性研究进展[J]. 乳业科学与技术,2021,44(3):43-49.
[5]" 李亚茹,郝力壮,牛建章,等. 牦牛乳与其他哺乳动物乳功能性营养成分的比较分析[J]. 食品科学,2016,37(7):249-253.
[6]" 中华人民共和国国家质量监督检验检疫总局. 出口食品中牦牛源性成分的检测方法 实时荧光PCR法:SN/T 4397—2015[S]. 北京:中国标准出版社,2015.
[7]" 徐伟丽,马莺. 奶粉基因组DNA不同提取方法的比较[J]. 哈尔滨工业大学学报,2012,44(8):73-75+129.
[8]" 尹丹韩,肖舒珺,杜黎丹,等. 基于实时荧光PCR技术的羊乳掺伪检测分析[J]. 浙江科技学院学报,2021,33(5):392-398.
[9]" 陈筱婷. 乳及乳制品真实属性多重实时荧光PCR检测方法研究[D]. 广州:华南理工大学,2016:21-23.
[10] 吴晓云. 基于DNA检测的骆驼乳粉掺假鉴别技术研究[D].呼和浩特:内蒙古农业大学,2022:14-27.
收稿日期:2023-08-10
基金项目:甘肃省市场监督管理局科技计划项目“牦牛乳品中牦牛源性成分定量方法的研究及建立”(项目编号:SSCJG-SP- 202107)。
作者简介:燕妮(1990-),女,硕士,工程师,主要研究方向:食品微生物学及分子生物学。
