帕金森病合并不宁腿综合征患者临床特征及影响因素分析
2023-12-31张永志张立庄刘义晗李艳敏马晓雯赵薇郭记宏邓倩顾平
张永志, 张立庄, 刘义晗,2, 李艳敏,2, 马晓雯, 赵薇, 郭记宏,2, 邓倩, 顾平*
(河北医科大学第一医院∥首都医科大学宣武医院河北医院 1. 神经内科; 2.河北省脑老化与认知神经科学实验室, 河北 石家庄 050000; 3.河北医科大学 研究生学院, 河北 石家庄 050031; 4.武胜县人民医院, 四川 广安 638400)
帕金森病(Parkinson’s disease, PD)是全球第二常见的影响人群的神经退行性疾病,预计到2030年,我国PD患病人数将达到500万,几乎占全球总患病人数的二分之一[1]。PD中便秘、抑郁、焦虑、冷漠、睡眠障碍等非运动症状在临床研究中受到广泛重视[2],常见的睡眠障碍包括不宁腿综合征(restless legs syndrome,RLS)、快速眼动睡眠期行为异常(rapid eye movement sleep behavior disorder,RBD)、白日嗜睡等。其中RLS是一种易被忽视的感觉运动障碍综合征,与多种身心疾病相关[3],其临床表现为强烈活动下肢的欲望,常伴有如蠕动、蚁行、瘙痒、烧灼等难以描述的不适感,症状多在夜间或休息时出现而在活动后减轻,严重影响患者的生活质量[4]。
在过去的三十年中,多项研究试图评估PD患者RLS的发病率,其结果差异非常大,范围从0%到52.3%[5],其中PD患者罹患RLS的风险是正常人群的2.98倍[6],且流行病学数据表明,RLS可能为PD发病的先兆或其运动前症状[7]。然而,研究提示PD伴发的RLS与原发RLS在许多方面存在差异[6],与PD相比,原发RLS患者可能有完整的多巴胺转运系统[8],且尸检数据未显示RLS患者有Lewy小体、α-突触核蛋白(α-synuclein)及黑质病变的证据[9],遗传学研究也提示这两种疾病有不同的发病原因[10],因此,上述发现仍存在争议。由于RLS诊断率较低,治疗方法尚不规范,其诊断标准缺乏特异性的临床表现,无明确的基因、生物学标志物及多导睡眠监测诊断金标准,在本研究中,我们研究了PD中RLS的发病率,并对PD伴RLS患者与睡眠、抑郁、焦虑、认知等因素之间的相关性进行探索,为PD伴RLS的防治提供理论依据。
1 资料与方法
1.1 患者资料
收集2019年12月至2022年12月就诊于河北医科大学第一医院神经内科的283例PD患者的资料,包括姓名、性别、年龄、主诉、既往基础疾病等信息。所有患者在国际不安腿综合征严重程度评分量表(IRLSSG)评分前均停服抗PD药物24 h。该试验已征得患者及其家属知情同意,且符合医学伦理学道德规范,通过河北医科大学第一医院伦理委员会批准(审批号:20200351)。
纳入标准:①均符合2016年国际运动障碍协会(Movement Disorder Society,MDS)的PD诊断标准[11];②PD病情分级,Hoehn-Yahr分期≤Ⅲ期;③RLS诊断标准均符合2014年国际不安腿综合征研究小组的RLS /Willis-Ekbom病(WES)诊断标准共识[12]。排除标准:①实验室检查确诊为贫血、肝肾功能不全及糖尿病者;②合并下肢大血管严重狭窄或闭塞者;③严重构音障碍、吞咽障碍、痴呆、精神症状,不能按要求进行相关检查者;④血液系统疾病或恶性肿瘤患者;⑤颅脑外伤、脑炎、药物代谢性疾病或其他神经系统变性疾病引起的继发性PD;⑥接受过脑深部刺激术(deep brain stimulation,DBS)手术治疗患者;⑦伴有其他严重躯体疾病患者。
1.2 研究方法
1.2.1 PD运动、焦虑、抑郁及认知的评估
由专业医师在疾病“开期”对PD患者进行除RLS量表以外的其余量表评定,包括:统一帕金森病评价量表-Ⅲ(unified Parkinson disease rating scale, UPDRS-Ⅲ)、汉密尔顿焦虑量表-14(Hamilton anxiety scale-14, HAMA14)、汉密尔顿抑郁量表-24(Hamilton depression scale-24, HAMD24)、简易精神状态检查量表(mini-mental state examination, MMSE)、匹兹堡睡眠质量指数量表(pittsburghsleep quality index, PSQI)、RBD筛查问卷-香港版(Hong Kong REM sleep behavior disorder questionnaire, RBDQ-HK)、PD疲劳量表(the brief fatigue inventory,BFI)。
1.2.2 分组及评分
(1)RLS分组:根据有无RLS,分为PD伴RLS组(PD-RLS)和PD不伴RLS组(PD-NRLS)。焦虑分组:HAMA14<7分为无焦虑情绪,HAMA14≥7分为有焦虑情绪。(2)抑郁分组:HAMD24<8分为无抑郁情绪,HAMD24≥8分为有抑郁情绪。(3)认知分组:MMSE≥26分为认知功能正常,MMSE<26分为认知功能减退。(4)睡眠分组:PSQI<7分为无睡眠障碍,≥7分为存在睡眠障碍。(5)RBD分组:RBDQ-HK<19分为不伴RBD,RBDQ-HK≥19者分为伴有RBD。(6)日常运动功能:UPDRS-Ⅲ评分越高说明患者日常运动能力越差。(7)BFI:评分越高说明患者疲劳程度越严重。
1.3 统计学分析
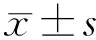
2 结果
2.1 一般资料
本研究中,PD-NRLS组中,男55例,女68例;年龄45~84岁,平均(66.95±9.23)岁。PD-RLS组中,男69例,女91例;年龄35~81岁,平均(64.54±8.88)岁。PD-NRLS组抑郁、焦虑、睡眠障碍和RBD的发病率分别为77.24%、73.17%、59.35%、57.72%,较PD-NRLS组88.75%、93.13%、75.63%、76.88%低,PD-NRLS组发生认知障碍的患病率为60.98%,较PD-RLS组58.75%高(表1)。
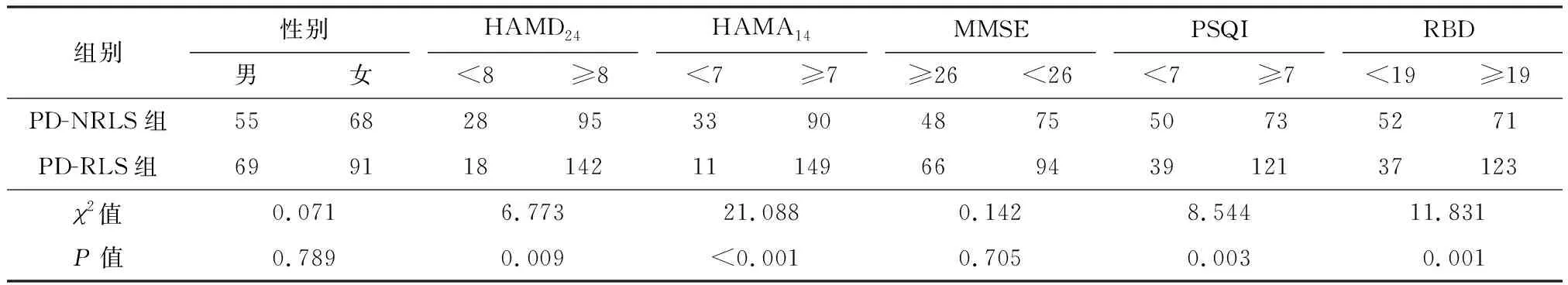
表1 PD组中相关量表临床资料的比较Table 1 Comparison of clinical data of related scales in PD group n
抑郁、焦虑、睡眠、RBD可影响PD伴发RLS的发病率,无抑郁组发病率为39.10%,低于抑郁组(59.90%);无焦虑组发病率为25.00%,低于焦虑组(62.30%);无睡眠障碍组发病率为43.80%,低于睡眠障碍组(62.40%);无RBD组发病率为41.60%,低于RBD组(63.40%),差异有统计学意义(P<0.05)。性别、认知障碍对PD伴发RLS的发病率影响差异无统计学意义(P>0.05,表1)。
2.2 PD-NRLS组与PD-RLS组临床资料的比较
PD-RLS组与PD-NRLS组病程、Hoehn-Yahr分期、MMSE评分差异无统计学意义(P>0.05)。PD-RLS组患者年龄低于PD-NRLS组,HAMD24、HAMA14、PQSI、BFI、RBD、UPDRS-3评分高于PD-NRLS组,差异有统计学意义(P<0.05,表2)。

表2 PD-NRLS组与PD-RLS组临床资料的比较Table 2 Comparison of inflammatory factors between PD-RLS and PD-NRLS M(P25,P75)
2.3 PD患者中RLS与焦虑抑郁、认知障碍等因素的相关性分析
在PD患者中,RLS与性别、Hoehn-Yahr分期、MMSE评分不相关(P>0.05);RLS与年龄呈负相关(P<0.05),与病程及HAMD24、HAMA14、PQSI、BFI、RBD、UPDRS-Ⅲ评分呈正相关(P<0.05,表3)。

表3 PD患者RLS与焦虑抑郁、认知等因素的相关性分析Table 3 Correlation analysis of RLS with anxiety, depression, cognition and other factors in PD patients
2.4 PD患者RLS影响因素分析
以性别、年龄、病程、Hoehn-Yahr分期、HAMD24、HAMA14、MMSE、PSQI、BFI、RBD、UPDRS-Ⅲ为自变量,以是否伴有RLS为因变量,进行二元Logistic回归分析,对单因素分析中的差异有统计学意义(P<0.05)者进行多因素Logistic回归分析(向前:LR法),结果显示年龄、HAMA14为PD患者发生RLS的影响因素(P<0.05,表4)。
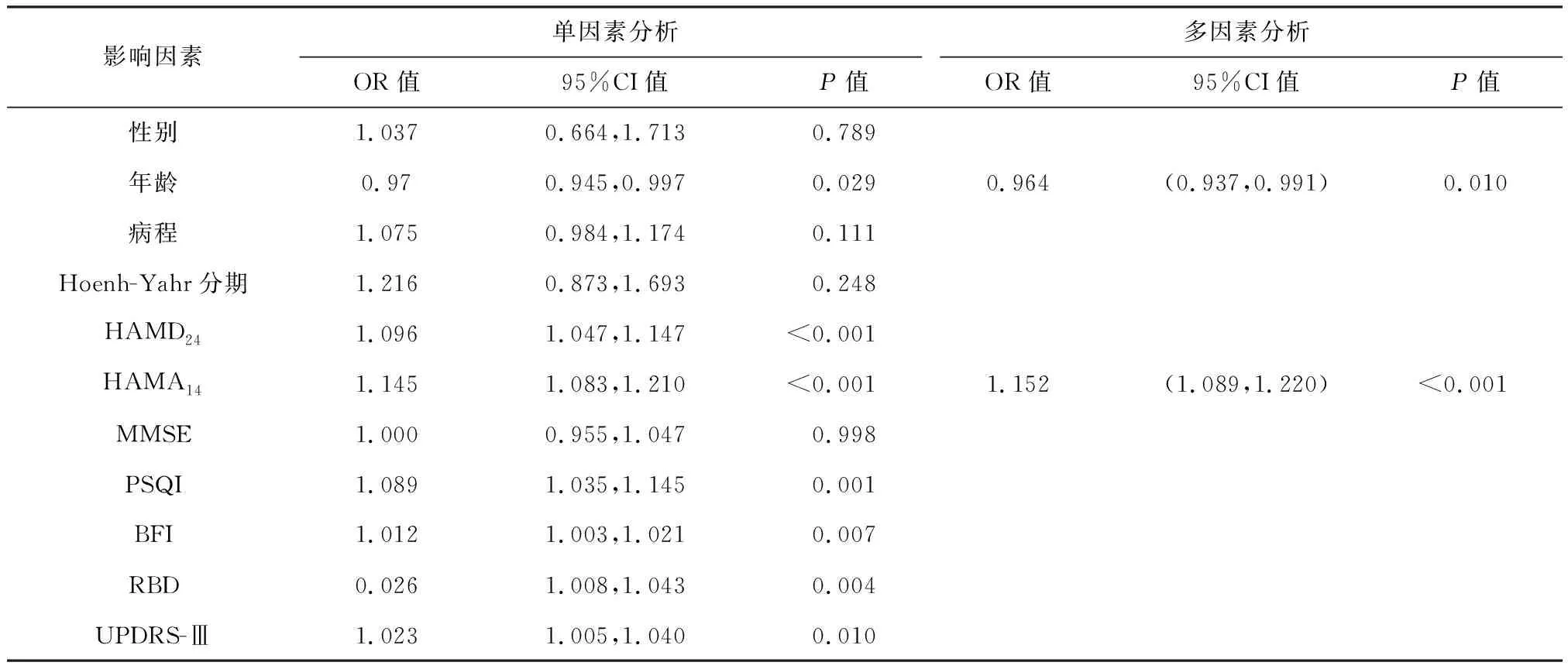
表4 PD患者不宁腿相关影响因素的Logistic回归分析Table 4 Logistic regression analysis of related factors on RLS in PD patients
3 讨论
PD为进行性神经系统退行性疾病,其发病机制是α-synuclein的异常聚集和黑质多巴胺能神经元的丢失而导致出现运动症状和非运动症状。其中睡眠障碍是PD患者最常见的非运动症状,出现在90%的PD患者中[13]。最近研究发现,PD患者中RLS的患病率可高达52.3%[5],并随着PD病程和PD药物治疗时间的延长而加重[14]。但因PD与RLS具有相同的有效治疗方法,且多巴胺能药物的治疗可能掩盖RLS症状[15],迄今还不清楚RLS是PD早期病理过程的一种表现,还是随着PD的进展而发生的并发症。由于目前临床上关于PD合并RLS的研究结论不一,本研究采用回顾性研究的方法,探索RLS与PD运动及非运动症状之间的关系,旨在为PD伴RLS的预防及临床诊治提供理论依据。
RLS临床表现为安静状态下或夜间出现的强烈的、几乎不可抗拒的腿部不适感,安静或休息时加重,活动后可减轻。前瞻性队列研究发现,频发RLS症状(>15次/月)者较无RLS症状者在4年内发生PD的风险将升高2.77倍[16]。目前关于RLS的发病机制尚不明确,其可能与遗传、铁缺乏、靶向RLS中的高敏感皮层终结点、神经递质功能紊乱等因素相关[17]。研究发现PD伴RLS患者有RLS家族史的比例较原发性RLS者高,而多巴胺能药物改善率较原发性RLS者低[18],且在具有RLS家族史PD患者中,RLS可出现在PD之前[19]。其差异提示两者的病理生理机制不完全相同。本研究中观察到PD-RLS组发病年龄小于PD-NRLS组,且回归分析显示年龄大为PD发生RLS的保护性因素,表明特发性RLS和PD合并RLS涉及不同的病理生理改变[20]。另一项经颅超声研究显示,不论患者是否合并RLS,特发性RLS患者的黑质回声性(反映组织铁含量的数量)明显低于PD患者[21]。
在PD患者的非运动症状中,睡眠障碍是复杂和多样的[22]。RLS作为一种易被忽视的感觉运动障碍综合征,其最常见的相关睡眠障碍是入睡困难和睡眠维持困难,直接影响睡眠效率、总睡眠时间和入睡后觉醒时间[23]。目前研究认为RLS严重程度与睡眠质量呈显著相关,RLS症状越严重,睡眠质量越差[24],入睡后觉醒时间与PD不伴RLS患者相比,PD伴RLS患者的PQSI得分高,睡眠质量差,且睡眠障碍更为严重[25]。本研究结果与上述研究相似,发现RLS患者中睡眠障碍发病率明显高于无RLS组,且PD-RLS组中睡眠障碍更为严重。
近年来,PD并发焦虑或抑郁的发病率逐年升高。文献已经探讨了RLS患者经常出现精神类疾病的证据,如抑郁症、焦虑症和失眠[26]。研究发现焦虑为RLS患者常见的合并症状[27],研究显示,在PD患者中,与不伴RLS的PD患者相比,PD伴RLS患者的焦虑和抑郁更加严重[28]。我国的一项观察性研究表明,PD-RLS组的病程更长,其运动症状、抑郁、焦虑、睡眠障碍、疲劳和冷漠更为明显[29]。本研究与上述研究结果一致,合并焦虑抑郁情绪的PD患者RLS发病率明显增高且其情绪障碍更为严重,而且焦虑为PD患者发生RLS的危险因素之一。其机制可能与肠道和/或脑部的炎症反应及5-羟色胺(5-HT)系统功能异常,从而减少大脑多巴胺(DA)和5-HT分泌而导致PD-RLS有关[29-30]。
认知功能障碍是影响PD患者生活质量的重要非运动症状之一,但RLS与认知功能的关系在国内外一直存在争议。目前关于RLS与认知功能的研究很少,Pearson等[31]研究认为RLS患者有明显的认知功能障碍,但其认知功能障碍是由慢性睡眠障碍而不是RLS本身引起的。Xu等[32]研究认为RLS与认知功能之间不存在线性相关关系,通过改善睡眠,可以减少认知缺陷。本研究中PD-RLS组和PD-NRLS组间MMSE评分未见统计学差异,可见PD伴RLS患者有严重的睡眠不足,但不损害其认知功能。但因为PD认知障碍出现较晚,还有待于扩大样本量及纳入中-重度患者进一步研究。
“疲劳”是临床上广泛使用的术语,它可分为外周性疲劳和中枢性疲劳。外周性疲劳是指由反复收缩引起的肌肉力量的丧失;中枢性疲劳是一种被描述为疲劳、虚弱或疲惫的感觉,涉及身体和/或精神领域[33]。在PD中,疲劳被认为是最常见和最致残的症状之一,它对患者的生活质量有重要影响[33],甚至在疾病的前驱期也可能出现,一旦出现,往往会持续或随着时间的推移而恶化[34]。荟萃分析显示PD患者的疲劳发生率为50%[34]。疲劳可能与PD非运动症状有关,如抑郁、冷漠和嗜睡等[33],Piao等[29]研究发现PD-RLS组的疲劳和冷漠症状较PD-NRLS组更为明显。本研究也发现PD伴RLS患者疲劳症状更为严重,严重影响患者的幸福感,并对个人、家庭和社会产生经济负担,但有效的RLS治疗有助于减轻疲劳症状[35]。
RBD是由快速眼动睡眠引起的以骨骼肌麻痹为特征的睡眠障碍,患者可能会表现出梦境表演行为[36]。研究认为RBD为神经退行性病变过程的早期症状,RBD患者10年后发生神经退行性疾病的风险高达82.4%,14年后高达96.6%[37]。Iwaki等[7]研究发现RLS与RBD关系密切,RLS的存在可增加RBD的发生风险。Suzuki等[20]研究同样发现PD伴RLS患者中RBD的比例较高,本研究和上述研究结果类似,合并RBD的患者中RLS发病率明显增高,且其RBD的症状更为严重。相当比例的RBD患者似乎将发展为包括PD在内的突触核蛋白病,因此,其发展的过程可以为未来的神经保护治疗提供一个潜在的治疗时间窗,可通过干预来阻止或延缓更严重的RLS和运动损伤的发展[38]。
RLS不仅与PD患者的非运动症状相关,还影响患者的运动功能。PD本身的运动症状,如在不可预测的“关闭”状态下会致患者在床上翻身困难,这可导致与夜间醒来有关的睡眠障碍[39]。无论患者是否有RLS,治疗睡眠障碍可以改善PD患者的运动症状[27]。但最近研究发现RLS与PD患者运动波动的关系存在相关性,RLS症状越严重,患者出现PD的发病率也越高[40],且PD-RLS组的UPDRS-Ⅲ评分明显高于PD-NRLS组[25,29]。本研究结果与之相类似,这意味着运动症状和RLS可能与DA系统的功能紊乱有关。当PD进入晚期时,DA的合成会进一步减少,从而导致RLS的加重[29]。
综上所述,非运动症状在PD伴RLS患者中较为常见,合并抑郁、焦虑、睡眠、RBD的PD患者中RLS发病率较高,且RLS在PD患者中出现较早,RLS症状可影响PD患者运动、情绪及睡眠质量,其中年龄、焦虑为PD患者发生RLS的影响因素。因此临床医生在PD伴RLS诊治过程中应注重患者情绪的评估。本研究的局限性为样本缺乏早中期PD患者及其全面的神经心理学评估。虽然这提供了一个独特的机会来研究PD伴RLS早期阶段的影响因素,但由于PD存在漫长的前驱期和进展过程,且未能随访追踪PD患者后续的转归变化(出现皮质基底节变性、多系统萎缩、路易体痴呆等),所得结果和结论均具有一定局限性,未来尚需进一步扩大样本量研究,以验证非运动症状在早中期PD-RLS中的作用。
作者贡献声明
张永志:设计实验、收集整理数据、统计分析数据,撰写并修改论文;张立庄,刘义晗,李艳敏,马晓雯,赵薇,郭记宏,邓倩:整理数据,修改论文;顾平:提出研究思路和框架,修改论文。
利益冲突声明
本研究未受企业、公司等第三方资助,不存在利益冲突。
