不同吻合方法应用于腹腔镜全胃切除术食管空肠吻合重建中的对比研究
2023-12-29龚磊喻晶覃相志李敏黄斌任明扬田云鸿彭洪
龚磊,喻晶,覃相志,李敏,黄斌,任明扬,田云鸿,彭洪
[南充市中心医院(川北医学院第二临床医学院)1.胃肠外科;2.肛肠外科,四川 南充 637000]
腹腔镜治疗早期胃癌,行远端胃切除的安全性及有效性已被证实[1]。中国CLASS-01 研究和韩国KLASS-02-RCT研究,为腹腔镜下微创手术治疗局部进展期远端胃癌,提供了高级别的循证医学依据。表明:腹腔镜外科手术在治疗局部进展期远端胃癌,远期疗效确切,患者获益显著[1-3]。随着胃近端癌的发病率逐年上升,腹腔镜全胃切除术的比例越来越高[2]。然而,腹腔镜全胃切除术操作难度大,对技术的要求也非常苛刻。腹腔镜下全胃根治性切除后的难点在于消化道重建,即食管和空肠的吻合,而食管空肠吻合的方式众多,哪种方式更好,当前仍无定论。常见的吻合方式有圆形吻合法和直线吻合法。圆形吻合法,根据钉砧座置入方法的不同,分为:反穿刺法、OrVil 法和荷包缝合法;直线吻合法包括:overlap法和π形吻合法。2009年日本学者OMORI等[4]将反穿刺法应用于腹腔镜全胃切除术,该方法克服了钉砧座置入的难题。随后多位学者相继将食管-空肠π形吻合用于消化道重建中,并在腹腔镜全胃切除术中成功应用,进一步推动了π 形吻合在临床中的应用[5-11]。本研究通过比较腹腔镜全胃切除术食管-空肠π形吻合法与圆形吻合反穿刺法的可行性、安全性和术后近期疗效,旨在为胃外科医生在选择食管-空肠吻合方法时提供依据。
1 资料与方法
1.1 一般资料
采用回顾性研究方法,收集75 例临床确诊为胃癌患者的临床资料。其中,男55例,女20例。75例中,27例行食管空肠π形吻合进行消化道重建,为π形吻合组(n=27);48 例行食管空肠圆形吻合进行消化道重建,为圆形吻合组(反穿刺法组)(n=48);两组患者性别、年龄、体重指数(body mass index,BMI)和术前临床分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
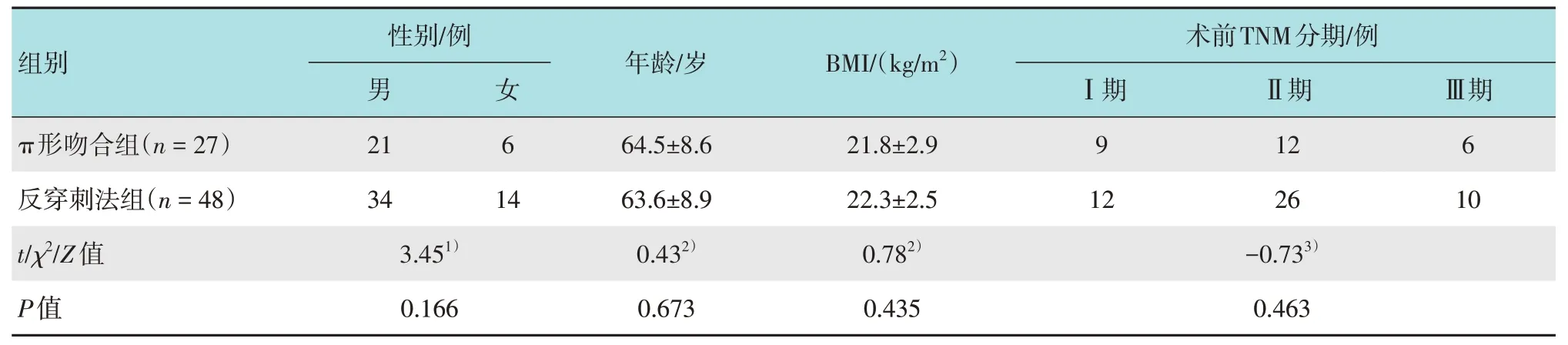
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
纳入标准:1)接受根治性腹腔镜全胃切除术的胃癌患者;2)位于食管胃结合处(Siewert Ⅲ型)和胃体部的肿瘤;3)术后病理证实为胃癌者;4)食管-空肠吻合在全腹腔镜下完成。排除标准:1)肿瘤浸润至齿状线以上的Siewert Ⅰ型和Ⅱ型食管胃结合部腺癌;2)有腹腔相关手术史,腹腔内脏粘连严重,中转为开腹手术者;3)术中探查肿瘤浸润周围组织,器官无法切除,或广泛转移者;4)患有其他系统性疾病,不能耐受全身麻醉和手术者。患者及家属均签署相关知情同意书。
1.2 方法
1.2.1 手术方法 所有患者均由同一手术团队实施腹腔镜全胃切除术,术者有丰富的腹腔镜手术经验,且均有至少50 余例腹腔镜胃癌根治术的经验。麻醉满意后,患者取平卧“人”字位,头部及左侧体部均高于水平线15°,足稍低位。主刀医生通常位于患者左侧,第一助手站在右侧,扶镜医师则位于双腿间。建立气腹后,观察孔用10 mm Trocar建立于脐下,采用5孔法进行手术操作。建立气腹后,脐下建立观察孔(10 mm Trocar),主操作孔位于左上腹腋前线肋缘下2 cm 处(12 mm Trocar),其余三孔分别位于脐水平左侧腹直肌旁(5 mm Trocar)、右侧腹直肌旁(12 mm Trocar)和右侧腋前线肋缘下 2 cm(5 mm Trocar)。按照日本《胃癌处理规约》,行胃癌D2 根治术,即:腹腔镜全胃切除+D2 淋巴结清扫,并离断十二指肠,用3/0 PDS 线荷包包埋十二指肠残端[12]。腹腔镜全胃切除后的消化道重建,均采用全腹腔镜下Roux-en-Y吻合,分别为π形吻合和圆形吻合(反穿刺法)。
1.2.2 π 形吻合 游离腹段食管7~9 cm,若腹段食管较短,可打开左右侧膈肌脚,扩大食管裂孔,用束扎带结扎食管胃结合部,以屈氏韧带为起点,至20 cm 以外的空肠处,用临时缝合丝线做标记,经上腹取标本口提出。体外离断空肠系膜纵行血管1 至2支,使吻合口上提无张力,再游离和离断空肠,直至距远端空肠断端约50~60 cm。理顺系膜后,先与近端空肠做空肠-空肠侧侧吻合,并关闭系膜裂孔。重建气腹,由巡回护士插入普通胃管后,由一助医师向左下腹牵引束带,显露出腹段食管,再用电凝钩或超声刀工作面于食道右内侧壁开窗以待吻合(图1A),上提远端待吻合空肠,观察系膜、肠管张力和血运良好后,用腔管长为60 mm的直线型切割闭合器,将食管和空肠做侧侧吻合(图1B),于腔镜下检查该吻合口完整且无出血后,用1枚钉仓即可关闭食管空肠共同开口,并离断食管(图1C和D)。为了减小吻合口张力,常在吻合口前后壁分别全层缝合加针,以避免闭合不全(图1E和F)。

图1 食管-空肠π形吻合的操作过程Fig.1 Operation process of π-shaped esophagojejunostomy
1.2.3 圆形吻合(反穿刺法)先由洗手护士取一根长约10 cm的牵引线,系于管径25 mm 的管状吻合器的抵钉座的尾部后,经上腹取标本切口放入腹腔。重建气腹,游离腹段食管5 cm,用束扎带结扎食管胃结合部,在胃管支撑下,于食管右侧壁用超声刀切开一3 cm小口(图2A),将抵钉座完全置入食管,外置牵引线位于食管切开线近口端(图2B)。用腔管长为60 mm 的直线型切割闭合器离断食管(图2C),牵引丝线,将抵钉座中心杆轻柔地拖出食管(图2D),解除气腹后,完整移出标本。与π 形吻合组方法相同,体外完成近端与远端空肠的侧侧吻合,并关闭系膜裂孔。由远端空肠断端放置管型吻合器主体,并距空肠断端5 cm 穿出待吻合,用手套制作简易约束带,约束吻合器处空肠,重建气腹,在腹腔镜监视下,避免空肠系膜扭转,管状吻合器主体与抵钉座对合后,完成食管空肠端侧吻合(图2E),保留距吻合口3 cm左右空肠后,远端空肠断端用直线型切割闭合器离断(图2F)。食管空肠吻合口前后壁间断包埋。

图2 食管-空肠反穿刺法吻合的操作过程Fig.2 Operation process of esophagojejunostomy by reverse puncture
1.3 观察指标
1.3.1 术中情况 包括:手术时间、食管空肠吻合时间、术中出血量、淋巴结清扫总数、术中食管空肠吻合相关并发症(吻合口闭锁、吻合口狭窄和吻合口撕裂)等。
1.3.2 术后情况 术后食管空肠吻合口相关并发症(吻合口出血、吻合口狭窄和吻合口瘘)。
1.4 统计学方法
采用SPSS 20.0 统计软件进行数据分析。符合正态分布的计量资料用均数±标准差()表示,比较采用独立样本t检验;计数资料用例或百分率(%)表示,比较采用χ2检验或Fisher确切概率法;等级资料比较采用非参数秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者手术情况比较
75 例胃癌患者均完成了腹腔镜根治性全胃切除术,无中转开腹手术。π形吻合组手术时间和食管空肠吻合时间分别为(221.5±8.8)和(34.7±3.7)min,与反穿刺法组的(246.9±5.6)和(47.2±4.6)min比较,差异均有统计学意义(t=15.19,t=11.81,P<0.05)。两组患者术中出血量和淋巴结清扫总数比较,差异均无统计学意义(P>0.05)。见表2。
表2 两组患者手术情况比较()Table 2 Comparison of surgical conditions between the two groups()

表2 两组患者手术情况比较()Table 2 Comparison of surgical conditions between the two groups()
2.2 两组患者并发症发生情况比较
2.2.1 术中并发症 反穿刺法组发生术中并发症2例,包括:食管空肠吻合口闭锁1 例,吻合口撕裂1例。行食管空肠吻合时,将空肠远端系膜侧黏膜钉合在吻合口上,术中测漏时,胃管不能通过吻合口,经术中胃镜证实为吻合口闭锁。于腹腔镜下沿右侧吻合口切开,直至被钉合的对侧黏膜被切开,在胃管支撑下,用倒刺线连续缝合切开的吻合口右侧壁。吻合口撕裂为吻合口黏膜及肌层撕裂,术中胃管注入美兰,发现有美兰从空肠系膜侧漏出。于腹腔镜下拆除原吻合口,继续游离食道残端,手工完成荷包缝合,空肠做7 cm 长的储袋,完成食管空肠储袋吻合。经过上述处理,2例患者术后均顺利恢复。
2.2.2 术后并发症 反穿刺法组发生术后并发症3例,包括:吻合口狭窄2 例,吻合口出血1 例。吻合口狭窄发生在术后3~6 个月,在胃镜下扩张治疗,症状缓解。吻合口出血发生在术后3 d,给予药物止血等对症处理后,好转。
3 讨论
3.1 腹腔镜全胃切除术的临床应用
随着腹腔镜器械和技术的不断进步,全腔镜下消化道重建是腹腔镜全胃切除术的必然趋势,尤其是对于肋弓夹角狭小、肿瘤位置高和有肥胖症的患者,其优势更为明显[13]。全胃切除术后,全腹腔镜下吻合的安全性,一直是广大外科医生最为关注的问题。术后并发症发生率的高低,决定该手术安全与否,以及其能否在临床推广应用。腹腔镜全胃切除术消化道重建首选Roux-en-Y吻合,但何种吻合方式更佳,尚无定论。根据食管空肠吻合器械的不同,分为:应用腔内直线型切割闭合器行食管-空肠侧侧吻合,以及应用圆形吻合器行食管-空肠端侧吻合[12-18]。
3.2 腹腔镜全胃切除术不同吻合方法的应用
3.2.1 食管-空肠吻合 目前,临床常用的腹腔镜下食管-空肠功能性端端吻合(functional end-to-end anastomosis,FETE)是OKABE等[19]在原FETE基础上改良而来的。吻合前,先将食管和空肠分别离断,于两断端分别开口,分别置入直线型切割闭合器,行食管-空肠的侧侧吻合,再用腔内器械关闭其共同开口[19]。王自强等[20]于2007 年提出完全腹腔镜下食管-空肠侧侧吻合。该方法与UYAMA 等[21]的吻合方法区别在于:小肠食管均未离断,可以将食管向下牵拉,避免食管缩回胸腔,有利于吻合。该方法也就是自牵引,后离断,即π形吻合前身。2016年,KWON等[22]提出π形吻合,也称三合一技术,即用直线型切割闭合器离断食管和空肠,同时关闭共同开口。蒿汉坤等[23]报道了100 例腹腔镜全胃切除术后,应用π 形吻合行食管空肠重建,临床效果明确,进一步证实了π形吻合的安全性。
3.2.2 开展π 形吻合的经验 本团队开展π 形吻合的初步经验如下:1)离断空肠系膜纵行血管1至2支,以减小食管空肠吻合口张力;2)从共同开口常规检查吻合口有无出血;3)在食管空肠吻合口的最高点,前后壁间断加强缝合;4)在吻合口下方5 cm处,将空肠浆肌层和右侧膈肌缝合,减小吻合口张力;5)术毕,经胃管注入美兰,检查有无吻合口渗漏。π形吻合组手术时间和食管空肠吻合时间分别为(221.5±8.8)和(34.7±3.7)min,与反穿刺法组的(246.9±5.6)和(47.2±4.6)min 比较,π 形吻合行消化道重建的时间,比圆形吻合器(反穿刺法)重建更短,更适宜临床推广应用。
3.2.3 反穿刺吻合法 2009 年日本学者OMORI等[4]首次报道了反穿刺法,该方法解决了钉砧座放置困难的问题,使得管状吻合器行全腔镜食管空肠重建变得容易。本中心将反穿刺法应用于全腔镜下食管空肠吻合口重建,取得了良好的效果。值得注意的是:1)在胃管支撑下,切开食管右侧壁,只有一个危险三角,而传统的方法是在食道残端中心穿出,有两个危险三角,术后吻合口瘘的概率会相对大一些;2)避免牵引线夹入直线型切割闭合器中;3)若腹段食管断端预留的穿引孔洞较小,切忌暴力拖拽牵引线,如果牵引线拉断后,抵钉座完全滞留于食管中,可尝试借助腔内扁头弯钳的支撑力,将预留孔洞小心撑开至可拖出抵钉座中心杆为止[24];4)食管空肠吻合口前后壁浆肌层间断加强,间断包埋浆肌层空肠闭合端;5)术毕经胃管注入美兰,检查有无吻合口渗漏。本中心曾用反穿刺法行食管空肠吻合,遇到空肠较细,伸入25 mm吻合口器较为困难的情况,通过在吻合器机身外涂抹石蜡油,注射解痉药物后,完成了食管空肠吻合[24];然后,在经胃管注入美兰,检查有无吻合口渗漏时,发现吻合口系膜侧有美兰渗出,切开空肠侧系膜,可见吻合口撕裂,只有外面浆膜层完整,拆除原吻合口,行空肠储袋和食管吻合。
综上所述,全腹腔镜下食管空肠π形吻合和反穿刺法吻合均是安全、可行的。在食管空肠吻合时间方面,π形吻合重建时间更短;当肿瘤位于胃体和胃上部,肿瘤未累及齿状线,小肠较细,伸入吻合器较为困难时,π形吻合优势较为明显。由于π形吻合是先吻合后离断,不能判断近切缘有无侵犯,特别是黏膜下浸润的肿瘤。所以,当肿瘤为浸润至齿状线以上的SiewertⅠ型和Ⅱ型食管胃结合部腺癌,不推荐运用π形吻合,推荐反穿刺法,使用管状吻合器重建。临床可根据患者具体情况和各中心的吻合经验,做出个体化选择。
