人参皂苷CK的生物制备及抗肿瘤作用机制研究进展*
2023-12-28陈胤臣任晗归席志超徐宏喜
陈胤臣,任晗归,席志超**,徐宏喜**
(1. 上海中医药大学中药学院 上海 201203;2. 中药创新药物研发上海高校工程研究中心 上海 201203)
根据GLOBOCAN 2020 年发布的最新统计数据显示,中国的癌症发病数和死亡人数占全球的23.7%和30.2%,且发病率和死亡率均呈现不断上升的趋势[1]。研发安全有效的抗肿瘤药物一直以来都是癌症研究的重点和难点。天然药物是发现活性先导化合物的宝库,为药物创新提供宝贵资源[2],其中不乏结构新颖,低毒高效的天然药效物质,值得更深入地研究。
人参(Panax ginsengC. A. Meyer)为五加科人参属植物人参的根和根茎,被誉称为“中药百草之王”。中医认为其具有大补元气、复脉固脱、补脾益肺、生津养血和安神益智等功效[3]。20 世纪60 年代,Fujita 等[4]日本天然药物化学家首次分离出了多种人参皂苷,并鉴别出化学结构。随后越来越多的学者开始着眼于人参皂苷的药理活性研究,如Rb1 被证明对心血管疾病和代谢类疾病等均具有一定的治疗作用[5]。其中,CK被发现具有抗炎、抗动脉粥样硬化、抗糖尿病和神经保护等作用,具有良好的临床应用前景[6]。1997 年,Wakabayashi 等[7]首次发现CK 可以抑制黑色素瘤细胞的肺转移,从此开启了研究CK 抗肿瘤活性及作用机制研究的热潮。迄今,CK 已经被证实对肝癌、肺癌和胃癌等多种癌症具有显著的抑制作用[8],并且与顺铂(Cisplatin,DDP)[9]、环磷酰胺(Cyclophosphamide,CTX)[10]等常用化疗药物联合使用时,可以有效地提高治疗效果。进一步深入的机制研究发现,CK 具有多重抗肿瘤作用机制,如促进肿瘤细胞凋亡、抑制肿瘤细胞侵袭转移和诱导肿瘤细胞周期阻滞等。
作为一种肠道代谢产物,CK 不能从人参中直接提取获得,需要由Rb1 等天然人参皂苷经肠道转化而成[11]。尽管Akao 等[12]的实验证明,CK 比Rb1 具有更高的生物利用度,但是代谢动力学研究表明,CK 在体内的生物转化速率有限,并且一些肠道细菌会影响CK的生物转化效率[13]。因此,实现CK 的体外人工制备,提升CK 的产量,将对降低CK 价格和促进CK 开发成有潜力的临床药物具有重要意义。目前,通过生物转化或生物合成是获得CK 的主要途径。多种酶和微生物已被用于提高CK 的生物转化效率,实现了多种天然人参皂苷向CK 的转化的过程。此外,研究者还发现了生物合成CK 的多种途径及关键酶和基因,可将结构相对简单化合物合成为CK,这大大加快了制备CK的研究进展。
近年来,徐宏喜教授团队一直致力于人参的化学、作用机制和临床应用的研究。在化学研究方面,课题组利用包括UPLC-QTOF-MS/MS 在内的多种方法,成功发现用于区分生晒参与红参的9 种人参皂苷标志物和特征性组分,进一步完善了生晒参与红参的质量评价标准[14-15]。为了促进林下山参年份鉴定检测方法的发展,课题组基于UPLC-Q-TOF/MS 的非靶向代谢组学技术,鉴定出可用于区分4-10 年、11-15 年、16-20 年林下参的指标成分群,为山参的年份鉴定提供了新方法。基于以上研究基础,课题组进一步改进了人参皂苷的提取方法以及检测条件,优化了野山参提取液的制备工艺并实现了野山参口服液的成果转让。此外,还开展了一系列人参临床应用的研究,发现红参复方提取物具有降血脂的功效,对于“虚证”的患者具有抗疲劳的功效,且没有明显“上火”副作用和其他不良事件[16]。这些研究为规范人参质量,促进人参从传统中草药向现代临床应用提供了科学依据。基于上述CK 的重要药理活性,课题组着重开展了CK的药理药效研究,发现CK 可以有效缓解缺血性脑卒中导致的神经损伤,缓解脑损伤后导致的身体机能障碍;CK 还可以特异性杀伤休眠期癌细胞,从而抑制肿瘤的增殖和复发。以上研究成果将进一步阐明“百草之王”人参药理作用的物质基础,揭示CK 的药效作用机制,促进以CK为主要成分的新型药物研发及应用。
本篇综述系统梳理并总结了CK 的生物制备及抗肿瘤作用机制研究进展。按照不同生物制备方法,对近10 年来CK 生物制备的最新研究成果进行了归类,整理了各方法的反应条件和效率产量,同时对不同方法的优势和不足进行了探讨。在CK 抗肿瘤研究方面,本文根据CK 的作用机制进行归纳分类,分别从CK 诱导肿瘤细胞周期阻滞、诱导肿瘤细胞凋亡和调控肿瘤细胞自噬等方面进行阐述,并对其成药潜力进行了分析与评价。
1 CK生物制备的研究进展
CK 的生产制备方法主要为化学合成法、生物转化法以及生物合成法(图1)[17]。通过化学合成法合成CK 具有反应速度快和成本低廉的特点,但该方法步骤繁琐、产率较低且副产物多,因此相关的研究及报道较少[18]。相较而言,采用生物转化法和生物合成法制备CK 是更常用的方法。生物转化法主要通过酶解其他二醇型人参皂苷C-3 和C-20 位上的多余糖基得到CK,所用的生物催化剂多为酶和微生物。生物转化法具有专属性高、制备流程简便和产率高的特点,但通过生物转化法制备CK 的成本较高且对转化前体的纯度有一定要求。生物合成法则是通过将结构相对简单且价格低廉的化合物合成为CK,目前已经实现了从葡萄糖到CK 的从头生物合成。这大大缩减了生产成本,使CK 可以由价格低廉的原料合成获得,但是生产周期仍然较长[19]。

图1 CK的生物制备示意图
1.1 CK的生物转化法
根据使用的生物催化剂种类,CK 的生物转化法可以分为酶转化法和微生物转化法。酶转化法是利用不同种类和来源的酶,酶解其他人参皂苷或人参皂苷结构类似物,从而获得CK 的方法。主要使用的酶包括单一糖苷酶(如β-葡萄糖苷酶、α-L-阿拉伯呋喃糖苷酶等)和混合酶(黑曲霉胞外酶、蜗牛酶等)(表1)。

表1 CK的生物转化
β-葡萄糖苷酶是一类最常用的单一糖苷酶,它能将多种人参皂苷或人参皂苷类似物转化为CK。Zhong等[20]通过在大肠杆菌BL21 中克隆表达β-葡萄糖苷酶基因(bgy1)来获得β-葡萄糖苷酶,发现其能将绞股蓝苷XVII 转化成为CK。Zhang 等[21]从短双岐杆菌ATCC 15700(BbBg1)中获得的新型β-葡萄糖苷酶,可以将人参皂苷Rd 转化为CK,其12 小时内的摩尔转化率高达96%。此外,Shin 等[22]从嗜热厌氧菌中获得了一种能够水解人参皂苷多位点上糖基团的β-葡萄糖苷酶,该酶可以将Rb1、Rb2 和Rc 转化为CK,转化率达100%。Choi 等[23]通过改造β-葡萄糖苷酶得到L213A变异型酶,该酶能更高效地将Rc转化为CK,转化效率是自然酶的1.5倍。
除使用单一生物酶进行生物转化外,一些复合酶也被用于制备CK。如Zheng 等[24]发现柚皮苷酶(鼠李糖苷酶和葡萄糖苷酶的混合物)可以酶解二醇型绞股蓝苷,将其转化成CK。Li等[25]通过蜗牛酶(纤维素酶、半纤维素酶、果胶酶和β-葡萄糖醛酸酶的复合物)将二醇型人参皂苷水解为CK。Jiang 等[26]和Jeong 等[27]发现黑曲霉胞外酶对于人参皂苷有很强的生物催化活性,能将含量较大的人参皂苷如Rb1 等转化为CK。Shin 等[28]将α-L-阿拉伯呋喃糖苷酶同β-葡萄糖苷酶联合使用,大大增强了红参提取物中Rb1、Rb2 和Rc 转化为CK 的效率,摩尔转化率达到100%,产率为348 mg·L-1·h-1。
微生物转化法是利用微生物代谢过程中产生的一系列生物酶,对含量较高的人参皂苷进行有目的的结构改造与修饰,从而得到稀有人参皂苷的方法(表1)。如LH4 是从韩国泡菜中分离得到的类食品乳杆菌,其可以在30℃、pH 6.0 的条件下将Rb1 水解成CK,摩尔转化率为88%[29]。类似地,Yoo 等[30]用从泡菜中分离得到的短乳杆菌发酵人参细根,能高效地制备CK。Wang 等[31]利用冬虫夏草菌将Rb1 转化为CK,摩尔转化率可达82%。
1.2 CK的生物合成法
CK 的生物合成法是利用合成生物学在微生物中构建异源途径生产CK[32],以达到降低生产成本和提升产量的目的的方法(表2)[33]。CK的生物合成首先通过对CK 的生物合成酶基因等进行表征与鉴定,精确控制CK 的生物合成途径。其次需选取适合实现生物合成途径的细胞工厂,多项CK 的生物合成研究已证实,通过基因工程技术获得的人参酵母,其安全性高和遗传背景较为明确,已被公认为是常用来生产CK 的细胞工厂[34]。

表2 CK的生物合成
CK 生物合成的主要难点在于对专一生产CK 的UDP-糖基转移酶类(Uridine diphosphate glucosyltransferase,UGTs)的筛选,因各二醇型人参皂苷结构相近,基本母核均为四环三萜,CK 的特异性主要体现在C-20 位的糖苷键。而各类UGTs 能够通过催化不同种原人参二醇,将不同糖苷键连在特定位点,最终生产出各类人参皂苷[35]。因而,从各类UGTs中筛选出能将葡萄糖特异地修饰在原人参二醇的C-3及C-20位点的UGTs对CK的生物合成至关重要。
2014 年,Yan 等[36]成功鉴定出UDP 糖基转移酶——UGTPg1,这是首个用于植物四环三萜类底物糖基化的UGT,成功实现了从葡萄糖到CK 的生物从头合成。在此基础上,Li 等[37]利用解脂耶氏酵母构建了一条制备CK 的生物合成途径,通过增加天然甲羟戊酸途径关键基因的表达,促进细胞色素P450氧化还原酶生成,进而提升了CK 的合成产量。Wang 等[38]通过增强酵母中UDP-葡萄糖合成基因的表达,构建了能特异性生产CK 的菌株—YS01-CK,使CK 的产量达到了1.17 g·L-1。Nan等[39]在酿酒酵母菌株WLT-MVA5中诱导PGM2、UGP1和UGTT基因表达,获得了能高效合成CK 的菌株WLN1。通过进一步对酵母培养基的优化,发现当培养基中甘油提供的碳含量达到20%时,CK的产量最高(1.7 g·L-1),摩尔转化率为77.37%。
CK 的生物制备(包括生物转化和生物合成)在近年来取得了长足的发展,使CK 的制备更为简便和高效,为其大规模生产提供了可能。在CK 的生物转化方面,其发展主要体现在:拓宽转化途径、提升摩尔转化率与产量和简化反应步骤等[40]。例如,引入黑曲霉胞外酶拓宽了转化底物谱,不但可以转化Rb1,还可以转化Rc、Compound Y 和Compound O[26-27]。在生物合成CK 方面,其进步主要体现在CK 细胞工厂及生物合成酶方面的优化,尤其是对UGTs 研究的深入,使葡萄糖修饰能特异性地定位在原人参二醇的C-20 位点,提升了CK 合成的特异性。此外,多种生物合成新技术的应用如基因组工程和代谢工程等,也使CK 的合成更加高效。例如,采用基因干扰手段提高菌株中特定基因的表达,使改造过的菌株成为特异性生产CK 的菌株,可显著提升CK合成的专属性和产量[39]。
2 CK抗肿瘤机制研究进展
研究证实,CK 对于多种肿瘤都具有显著地抑制作用,并通过不同的作用机制发挥疗效(图2),在癌症治疗中有一定的临床应用前景。本文从肿瘤细胞增殖、凋亡、迁移、自噬及耐药等方面,对CK 的抗肿瘤药理活性进行了系统地总结与阐述。
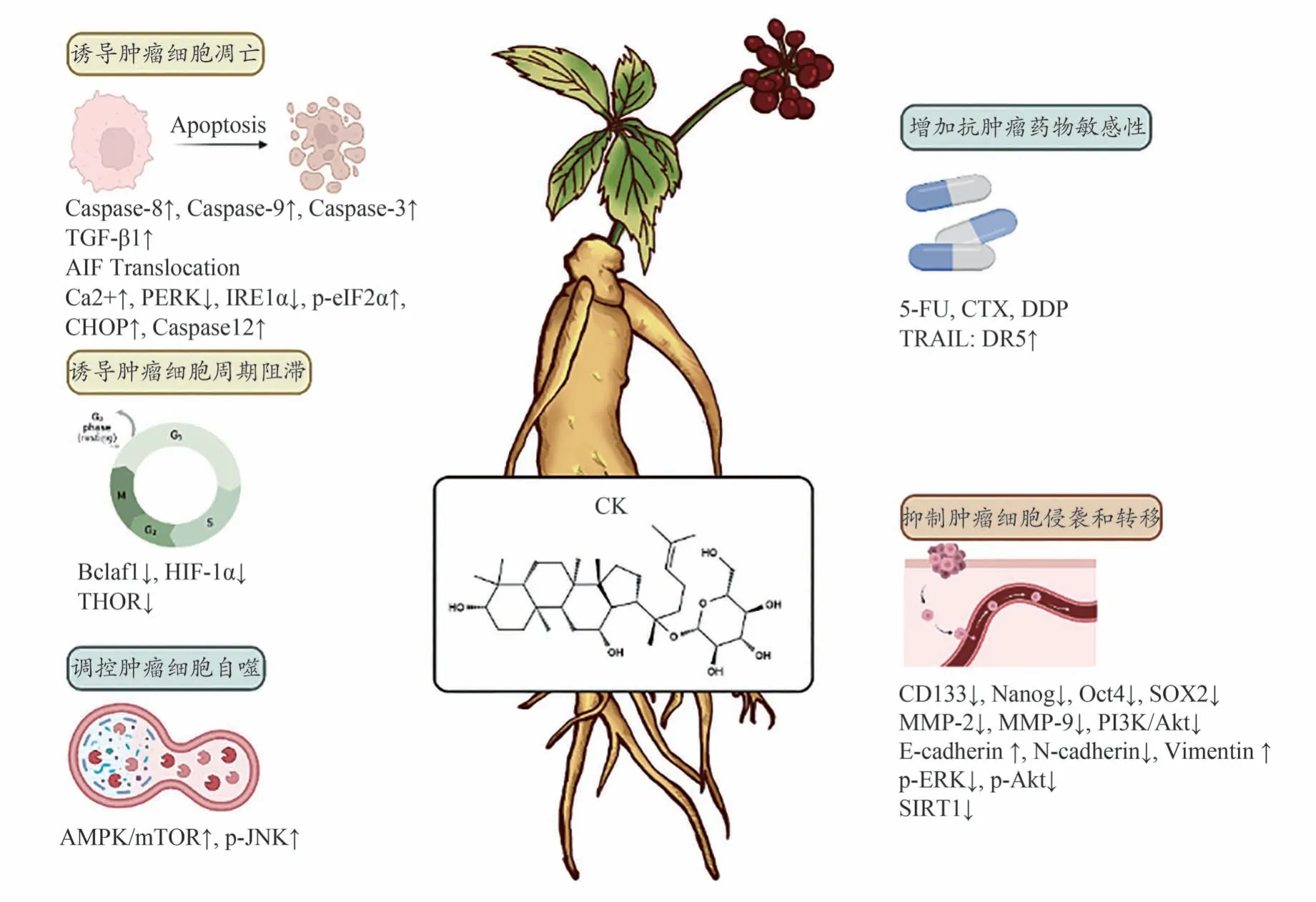
图2 抗肿瘤活性及作用机制
2.1 诱导肿瘤细胞周期阻滞
细胞周期异常引起的细胞增殖失控是肿瘤细胞的重要特征之一[41],因此阻滞肿瘤细胞的周期进程是抑制肿瘤细胞增殖的重要手段。研究发现,CK 对于多种肿瘤细胞的周期均具有调控作用。例如,CK 可通过下调抗凋亡蛋白Bcl-2 的转录因子1(Bcl2-associated transcription factor 1,Bclaf1)和抑制低氧诱导因子1α(Hypoxia inducible factor-1,HIF-1α)介导的糖酵解代谢途径,诱导肝癌Bel-7404 细胞和Huh7 细胞发生G0/G1期周期阻滞,从而抑制肝癌细胞的增殖。动物实验证明CK 可呈剂量依赖地抑制肿瘤生长,并显著降低了肿瘤组织中Bclaf1及糖酵解相关蛋白的表达[42]。Wang 等[43]发现CK 能显著抑制结肠癌HCT-116细胞和肿瘤抑制因子p53 突变型SW480 细胞的增殖,将肿瘤细胞阻滞在G1期。此外,肾癌RCC细胞中的睾丸相关的高度保守的致癌性长链非编码RNA(Testisassociated highly-conserved oncogenic long non-coding RNA,THOR)与非癌细胞相比表达异常升高。Chen等[44]发现CK 能显著抑制THOR 的表达,并呈剂量依赖地阻滞RCC细胞从G2向M期的转化。
2.2 诱导肿瘤细胞凋亡
细胞凋亡是由基因控制的细胞自主而有序的程序性死亡,细胞增殖与凋亡的失衡是导致肿瘤发生的重要原因之一[45]。研究表明,CK 可通过调控多种蛋白及分子通路诱导肿瘤细胞凋亡。如CK 可呈剂量依赖地诱导卵巢癌CAOV3 细胞发生含半胱氨酸的天冬氨酸蛋白水解酶(Cysteinyl aspartate specific proteinase,Caspase)Caspase-8 介导的外源性途径以及Caspase-9调控的内源性凋亡,进一步激活Caspase-3 蛋白,诱导多聚(ADP-核糖)聚合酶[Poly(ADP-ribose)polymerase,PARP]的剪切,导致细胞凋亡[46]。CK 通过激活肝癌SMMC-7721 细胞中的转化生长因子-β(Transforming growth factor-β,TGF-β)信号通路,引起Caspase-3 蛋白剪切,诱导肿瘤细胞的凋亡[47]。此外,在鼻咽癌HK-1 细胞中,CK 可同时激活Caspase 蛋白级联反应、诱导细胞凋亡诱导因子(Apoptosis inducing factor,AIF)易位和线粒体功能损伤,并在体内证实了CK 对HK-1细胞裸鼠皮下移植瘤的抑制作用[48]。另有研究发现,CK还可通过诱发持续且高强度的内质网应激,诱导肿瘤细胞凋亡。如Yin 等[49]证实CK 可以增加宫颈癌Hela细胞中的钙离子浓度,引起内质网钙离子紊乱,降低蛋白激酶样内质网激酶(Protein kinase R-like endoplasmic reticulum kinase,PERK)、肌醇必需酶1α(Inositol-requiring enzyme 1α,IRE1α)蛋白,增加磷酸化α 亚基的真核起始因子2(Phosphorylated α subunit of eukaryotic initiation factor 2,p-eIF2α)、CCAAT/增强子结合蛋白同源蛋白(Enhancer-binding protein homologous protein,CHOP)和Caspase-12 蛋白的表达水平,引起内质网应激介导的细胞凋亡。
2.3 抑制肿瘤细胞侵袭和转移
肿瘤细胞的侵袭和转移是恶性肿瘤的特征[50],其主要标志物有基质金属蛋白酶(Matrix metalloproteinases,MMPs)MMP-2 与MMP-9、N-钙粘蛋白(N-cadherin)和E-钙粘蛋白(E-cadherin)等。研究发现,CK 可以通过减少肿瘤细胞的侵袭和转移来抑制多种肿瘤的发生发展,如Lee等[51]发现CK减少了胶质瘤U87MG细胞和U373MG 细胞中肿瘤干细胞标记物CD133、同源盒转录因子Nanog、八聚体结合转录因子4(Octamer binding protein 4,OCT4)和性别决定区Y 框蛋白2(Sex determining region Y-box 2,SOX2)的表达,同时降低MMP-2 和MMP-9 的表达,从而抑制肿瘤细胞的侵袭和转移能力。
上皮间质转化(Epithelial-mesenchymal transition,EMT)是上皮细胞表型获得间质细胞特征的过程,其中当上皮细胞标志物(E-cadherin)表达减少,间质细胞标志物(N-cadherin)表达增加,肿瘤细胞的侵袭和迁移能力增强[52]。研究发现,CK可抑制乳腺癌MCF-7细胞中的EMT 转化,显著上调E-cadherin 的mRNA 表达水平,减少N-cadherin 和波形蛋白(Vimentin)的mRNA 表达。其作用机制可能与CK 抑制磷脂酰肌醇三激酶(Phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Protein kinase B,PKB,又称Akt)信号通路有关[53]。类似地,彭等发现CK 显著下调人肝癌HepG2 细胞中磷酸化细胞外调节蛋白激酶(Extracellular regulated protein kinases,ERK)、磷酸化Akt蛋白以及N-cadherin蛋白的表达水平,上调E-cadherin蛋白表达水平,通过抑制EMT 过程降低HepG2 细胞的侵袭和转移能力[54]。此外,在裸鼠尾静脉肺转移模型中,CK 通过降低信息沉默调节因子2 同源物蛋白1(Silent information regulator 2 homologue 1,SIRT1)的表达抑制了非小细胞肺癌A549细胞的转移[55]。
2.4 调控肿瘤细胞自噬
自噬是一种细胞内降解系统,能将受损的蛋白质或细胞器等在溶酶体中降解以供细胞进行循环利用[56]。大量研究表明,自噬对于肿瘤的发生发展具有双重调控作用[57]。有趣的是,CK 对于肿瘤细胞的自噬也具有双重调控作用。一方面,CK 可通过诱导自噬抑制肿瘤细胞增殖,例如CK 通过激活A549 细胞和肺腺癌H1975 细胞中的腺苷酸活化蛋白激酶(Adenosine 5’ -monophosphate-activated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)信号通路,增强c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)蛋白的磷酸化水平,促进细胞自噬发生,抑制肺癌细胞的增殖[58]。另一方面,Oh 等[59]研究发现,CK 可以通过阻断神经母细胞瘤SK-N-BE 和SH-SY5Y 细胞中自噬过程晚期的自噬体和溶酶体融合,抑制肿瘤细胞增殖,发挥抗肿瘤作用。
2.5 增加抗肿瘤药物敏感性
鉴于CK 在多种肿瘤中被证实具有潜在的治疗作用,越来越多的研究着眼于将CK 与临床抗肿瘤药物进行联合使用。研究发现,CK 与化疗药物联用不仅可以增强化疗药物的敏感性还可以逆转肿瘤细胞耐药。例如,CK 与5-氟尿嘧啶(5-fluorouracil,5-FU)联用可显著增强对胰腺癌PANC-1 细胞的增殖抑制作用,减少EMT 转化,抑制肿瘤转移[60]。将CK 与治疗乳腺癌的常用药物顺铂联用,可增强顺铂对乳腺癌MCF-7 细胞的增殖抑制作用[9]。此外,CK 还可增加对肿瘤坏死因子相关凋亡诱导配体(Recombinant tumor necrosis factor related apoptosis inducing ligand,TRAIL)药物耐受的结肠癌HT-29 细胞的敏感性,联用导致促进细胞存活的蛋白表达下降,促凋亡蛋白的表达上升,进而诱导死亡受体5(Death receptor 5,DR5)在细胞表面的表达增加[61]。值得注意的是,在使用CK作为联用药物时需考虑常规抗肿瘤药物的使用剂量,避免产生拮抗作用。例如在CK 同顺铂联合治疗A549 细胞时发现,较大剂量顺铂与CK 联用(50 μg·mL-1CK+20 μg·mL-1顺铂)可协同诱导A549 细胞凋亡,而当使用较小剂量顺铂同CK 联用(1.5625 μg·mL-1CK+0.625 μg·mL-1顺铂)时会产生拮抗[62]。
以上研究表明,CK 在癌症治疗中通过不同的作用机制发挥疗效,包括诱导肿瘤细胞周期阻滞、诱导肿瘤细胞凋亡、抑制肿瘤细胞侵袭和转移、调控肿瘤细胞自噬和增加抗肿瘤药物敏感性等,具有显著的抗肿瘤作用。尽管现有研究已证实CK 对于多个蛋白和信号通路具有调控作用,但其直接作用的靶蛋白仍不明确,需对其抗癌作用机制进行更加深入的研究。例如CK 可通过调控细胞自噬抑制肿瘤细胞增殖,但具体影响了自噬过程中的哪一环节尚未阐明;CK 导致的细胞凋亡是否和自噬存在信号通路间的调控;线粒体是否为CK 作用的关键细胞器等问题仍有待研究。此外,研究发现CK在免疫性疾病中能够抑制T细胞及免疫趋化因子的表达[63],减轻自身免疫性关节炎。随着近年来肿瘤免疫治疗的发展,其在免疫应答中的作用值得更详细的研究。综上所述,通过对CK 抗肿瘤作用机理的系统阐述进一步提升了CK 的药用价值,为其日后的临床开发应用具有积极意义。
3 讨论与展望
CK 是二醇型人参皂苷在肠道内的主要代谢物,具有较好的抗肿瘤活性,对治疗结肠癌、肝癌和乳腺癌等具有潜在的应用价值[11]。随着近年来对CK 抗肿瘤机制的深入研究,发现CK 不仅能够诱导肿瘤细胞周期阻滞[42-44]和细胞凋亡[46-49],还具有调控细胞自噬[58-59]和抑制肿瘤转移[51,53-55]等作用。此外,CK 作为辅助用药在与临床常规抗肿瘤药物如顺铂[9]和环磷酰胺[10]等联用时展现出了良好的协同抗肿瘤作用,具有增强常规抗肿瘤药物疗效和逆转肿瘤细胞耐药性等作用。有研究表明,在多种肿瘤细胞中,CK 的有效治疗剂量往往小于其他人参皂苷[64],且CK表现出更好的生物利用度。尽管目前尚无证据表明CK 发挥抗肿瘤作用的效应基团是什么,但相对于其他二醇型人参皂苷,CK含有的糖基较少,仅在C-20上连有一个葡萄糖基。这使得CK 比其他人参皂苷的分子量更小和极性较小[65],更易透过细胞膜[65],这可能是CK 对于具有较高抗肿瘤生物活性的潜在原因。
由于CK 不能从人参中直接提取获得,研发高效制备CK 的方法十分必要。目前通过化学合成法制备CK 的产率较低、步骤繁琐,因此优化CK 的化学合成路线、工艺条件和提高合成产率非常重要。相比之下,生物转化法和生物合成法发展迅速,且各有优势。其中,生物转化法转化流程简便、中间产物少、选择性好。除了使用β-葡萄糖苷酶等单一酶外,一些复合酶以及微生物也可以将不同类型人参皂苷转化为CK,不仅提高了CK 的产量还增加了转化途径,未来如何进一步开发能够同时转化多种二醇型皂苷的酶和微生物,或许是CK 生物制备法实现突破的关键点。另外,生物合成法所用原料(葡萄糖、甘油等)廉价易得,大大降低了CK 的生产成本,为CK 的大规模生产奠定了基础,后续仍可进一步降低生产周期与生产步骤的工艺条件进行优化。
尽管目前对CK 的生物制备到抗肿瘤活性已有了较为全面的认知,但尚存在一系列科学问题需要更加深入和系统的研究,如提高CK 抗肿瘤活性评价的精确性、进一步明确CK 抗肿瘤的作用靶点、进行系统的毒理评价及临床疗效研究等。在今后的CK 抗肿瘤活性研究中可采用更精准的细胞和动物肿瘤模型对其抗肿瘤活性进行更准确地评价,如建立临床来源的肿瘤细胞株、构建转基因小鼠肿瘤自发模型和原位转移及复发模型等。关于CK 的抗肿瘤作用靶点研究,现有研究往往限定于经典通路如PI3K/Akt[53]、AMPK/mTOR[54]等,没有对其特异性靶点深度挖掘,后续研究应着重探究其关键作用靶点,为临床药物开发提供支持。此外,还可通过CK 的构效关系研究,明确其抗肿瘤的活性基团,进一步优化CK 的结构。目前CK 抗肿瘤研究大多停留于药效研究,应加强系统的动物毒理学研究及临床研究,为后续CK 开发成抗肿瘤药物提供科学权威的药效学和毒理学数据。并且,还可探究人体CK 转化过程中起重要作用的肠道菌群,研究这些肠道菌群是否会影响CK 的生物活性进而影响其抗肿瘤的效果。在药剂学方面,或可通过纳米载药及抗体偶联药物等靶向剂型的开发,可帮助CK 实现增效减毒的作用,促进其药物的研发与转化。
综上所述,在癌症高发病率及抗肿瘤药物研发成本居高不下的大背景下[66],需要积极开发新的抗肿瘤活性先导化合物。CK 在抗肿瘤活性方面已经积累了较好的前期研究基础,未来值得进行更深入和系统的研究,最终服务于不幸罹患癌症的患者。
