基于网络药理学研究安石榴苷治疗炎症性肠病的作用机制*
2023-12-28毛旭文古丽若依帕尔哈提张雍正阿米尔泽布程路峰
毛旭文,古丽若依·帕尔哈提,张雍正,阿米尔·泽布,程路峰**
(1. 新疆医科大学药学院 乌鲁木齐 830017;2. 新疆天然药物活性组分与释药技术重点实验室 乌鲁木齐 830017;3. 新疆医科大学国际教育学院 乌鲁木齐 830017)
近年来,炎症性肠病(Inflammatory bowel disease,IBD)在我国的发病率呈现逐年上升态势,且其发生因素复杂,主要有:遗传因素、环境因素、肠道微生物菌群、肠道免疫系统紊乱、肠道粘膜屏障功能障碍等[1-3]。IBD 病程漫长、其症状反复发作,长期可发展为结肠癌。据统计,亚洲IBD 患者发生结肠癌30 年的累积风险为13.91%[4-5]。目前在临床上IBD 防治的药物主要有:柳氮磺吡啶、对氨基水杨酸、糖皮质激素等。但是患者长期使用上述药物会产生耐受性,并且引起多种不良反应,停药后症状容易复发,给患者造成一定的烦扰,有待寻找一种疗效显著且不良反应少的天然药物[6-7]。
安石榴苷(Punicalagin,Pun)来源于石榴皮,是其发挥药理作用的重要物质基础。《本草纲目》记载石榴皮主治:“赤白痢下,久痢久泻,积肿恶毒,胃部生疮”。现代研究报告安石榴苷具有消炎、防癌、抗菌、抗病毒、抗氧化等多种药理作用[8-13]。有研究报道安石榴苷通过调节肠道菌群结构,缓解由致病性大肠杆菌O101建立的急性细菌性肠炎模型[14]。但是安石榴苷对化学损伤引起的炎症性肠病,其治疗作用及分子机制还没有得到系统性阐明。本研究拟利用网络药理学方法和分子对接技术,对安石榴苷治疗IBD 的潜在作用机理进行预测,并对预测结果进行全面、详细的分析,对安石榴苷开发利用提供理论依据。
1 材料与方法
1.1 分析平台和数据库
数据库及数据分析软件见表1。
表1 数据库与分析平台
1.2 仪器与试药
组织包埋机,型号:Histostar,Thermo Fisher Scientific 公司生产;酶标仪,型号:CoDa,Bio-Rad 公司生产;组织切片机,型号:CM1900,Lecia 公司生产。葡聚糖硫酸钠盐(上海麦克林生化科技有限公司,批号:C12750877);肿瘤坏死因子(TNF-α)酶联免疫吸附测定试剂盒(上海将来实业股份有限公司,批号:063016HLP104840701);白细胞介素-6(IL-6)酶联免疫吸附测定试剂盒(上海将来实业股份有限公司,批号:063016HLP202680701);小鼠粪便隐血试剂盒(上海酶联生物科技有限公司,批号:0701A22);CCK-8试剂盒(北京博奥森生物技术有限公司,批号:A109295084);髓过氧化物酶(MPO)检测试剂盒(上海将来实业股份有限公司,批号:063016HLP10367070 1);趋化因子配体1(CXCL1)检测试剂盒(上海将来实业股份有限公司,批号:063016HLP201500701);地塞米松(北京索莱宝科技有限公司,批号:LOT20235125);安石榴苷由新疆医科大学药理教研室提取。
1.3 实验动物
选取SPF级C57BL/6J小鼠60只(购买于北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0006),雌雄各半,6-8 周龄,体质量18-22 g。SPF 级实验动物使用许可证号SYXK(新)2016-0002,每天光照12 h、黑暗12 h,温度21±2℃,湿度40%-45%。本实验经过新疆医科大学实验动物中心伦理委员会批准,伦理批号:IACUC-20211016-39。
1.4 网络药理学
1.4.1 药物-疾病靶点预测
借助PubChem 数据库和SwissTarget Prediction 平台,以Norm Fit>0 筛选获得药物靶点,通过Uniprot 数据库对获得药物靶点名称进行统一,得到安石榴苷的作用靶点。利用GeneCards、OMIM 以及CTD 数据库,以“Inflammatory bowel disease”为关键词进行检索,去掉重复后得到IBD 的相关靶点。通过Venny2.1 绘制韦恩图,获得安石榴苷作用靶点与IBD 相关靶点交集靶点,导入Cytoscape3.8.2软件,构建“药物-疾病-作用靶点”网络图。
1.4.2 PPI网络构建及核心靶点筛选
使用STRING 数据库,以获得的药物和疾病的交集靶点导入进行检索,蛋白种属选择Homo Sapiens、阈值选择0.4,建立蛋白互作关联网络图。利用Cytoscape3.8.2 软件中的NetworkAnalyzer 功能拓扑学分析蛋白互作关联网络图,最终构建“药物-疾病-作用靶点”网络。
1.4.3 基因功能和通路富集分析
借助David 6.8 数据库,对安石榴苷治疗IBD 的靶点进行GO 分析和KEGG 通路富集分析,以P<0.05 为筛选条件,按差异显著性大小进行排序,选择KEGG通路富集前16条结果绘制气泡图。
1.4.4 药物-核心靶点的分子对接验证
将安石榴苷的3D结构从Pubchem数据库中检索,保存为可处理格式,也就是为配体,并最小化其能量。利用PyMOL软件对靶蛋白进行预处理后,从RCSBPDB数据库下载预测得到的安石榴苷靶蛋白3D结构,获得受体。通过AutoDock vina 1.1.2 软件运用盲法对接分析安石榴苷与靶蛋白之间的亲和力和对接位点。
1.5 动物实验
1.5.1 动物造模分组及给药
将60 只鼠龄6-7 周,体质量18-22 g C57/BL6J 小鼠随机分为对照组、IBD 模型组、安石榴苷组(低、中、高)、阳性药组,每组10只。对照组小鼠每日正常饮食饮水,不进行其他处理。IBD 模型组、安石榴苷组(低、中、高)、阳性药组小鼠每日自由饮用2.5%葡聚糖硫酸钠盐(Dextran sulfate sodium,DSS)溶液代替饮水,自由进食。对照组与模型组小鼠每天以0.1 mL·10 g-1体质量灌胃灭菌水,安石榴苷组灌胃安石榴苷水溶液10 mg·kg-1、20 mg·kg-1、40 mg·kg-1每日1 次,连续灌胃7 天。阳性药组以地塞米松0.4 mg·kg-1腹腔注射,每日1次,连续注射7天。
1.5.2 疾病活动指数(Disease activity index,DAI)评分
每日对小鼠DAI 进行评估,DAI=(体质量下降分数+大便性状分数+便血分数)/3,具体评分标准见表2。

表2 DAI评分标准
1.5.3 苏木素-伊红(HE)染色
取4%多聚甲醛固定的小鼠结肠,石蜡包埋、切5 μm 连续切片,二甲苯脱蜡,梯度乙醇脱水。苏木精染色7 min,1%氨水浸泡30 s,0.5%伊红乙醇浸泡30 s。乙醇梯度脱水,二甲苯透明,中性树胶封片。于显微镜下观察各组小鼠结肠组织形态变化并进行病理学评分,评分标准见表3。

表3 组织学评分标准
1.5.4 ELISA法检测结肠组织中细胞因子
将结肠组织于冰上匀浆,匀浆液于4℃,3500 r·min-1离心15 min,收集上清液,按ELISA 试剂盒说明书检测TNF-α、IL-1β、MPO、CXCL1、IL-6、IL-18、IFN-γ、IL-10水平。
1.5.5 肠道通透性检测
小鼠于给药第7 天后,禁食不禁水12 h,灌胃给予1 mg·mL-1异硫酸荧光素-硫酸葡聚糖(FITC-dextran),4 h 后小鼠采用乙醚麻醉,眼眶静脉丛取血。血液于3500 r·min-1离心15 min。吸取100 μL 在波长480 nm和520 nm处检测样品的荧光强度。
1.6 细胞实验
1.6.1 CCK8法测定caco-2细胞增殖活性
将caco-2 细胞经计数后稀释为1×105个·mL-1的细胞悬液,每孔100 μL 接种到96 孔板,以含10%胎牛血清的1640 培养液在培养箱中孵育24 h,模型组与安石榴苷组加入2% DSS造成IBD模型,安石榴苷组加入不同浓度的安石榴苷溶液,使安石榴苷培养液的终浓度分别为0 μmol·L-1、0.01 μmol·L-1、0.1 μmol·L-1、1 μmol·L-1、10 μmol·L-1、20 μmol·L-1、50 μmol·L-1、100 μmol·L-1,每个浓度设6 个复孔。继续孵育48 h后,每孔加入10 μL CCK-8 溶液,轻轻摇匀,37℃孵育1 h,用酶标仪在450 nm处测定吸光度。
1.6.2 ELISA 法检测脂多糖(LPS)诱导的caco-2 细胞释放细胞因子
将caco-2 细胞经计数后稀释为1×105个·mL-1的细胞悬液,每孔100 μL 接种到96 孔板,以含10%胎牛血清的1640 培养液在培养箱中孵育24 小时,将细胞分为5 组:对照组、LPS 组、安石榴苷+LPS 组(低、中、高),对照组不做处理,LPS组加入1 μg·mL-1LPS,安石榴苷+LPS 组(低、中、高)加入1 μg·mL-1LPS 和25 μmol·L-1、50 μmol·L-1、100 μmol·L-1安石榴苷,每个浓度设3个复孔。继续孵育48 h后,收集细胞上清液,按ELISA试剂盒说明书检测TNF-α、IL-10水平。
1.7 统计学方法
采用GraphPad 软件分析,计数资料以均值±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 网络药理学预测结果
2.1.1 药物-疾病交集靶点获取结果
运用Swiss Target Prediction 平台得到安石榴苷作用靶点27 个,利用GeneCards、OMIM 和CTD 数据库筛选得到1757 个与IBD 相关的靶点,将上述两者取交集后得到14个疾病和药物共同靶点,见图1。
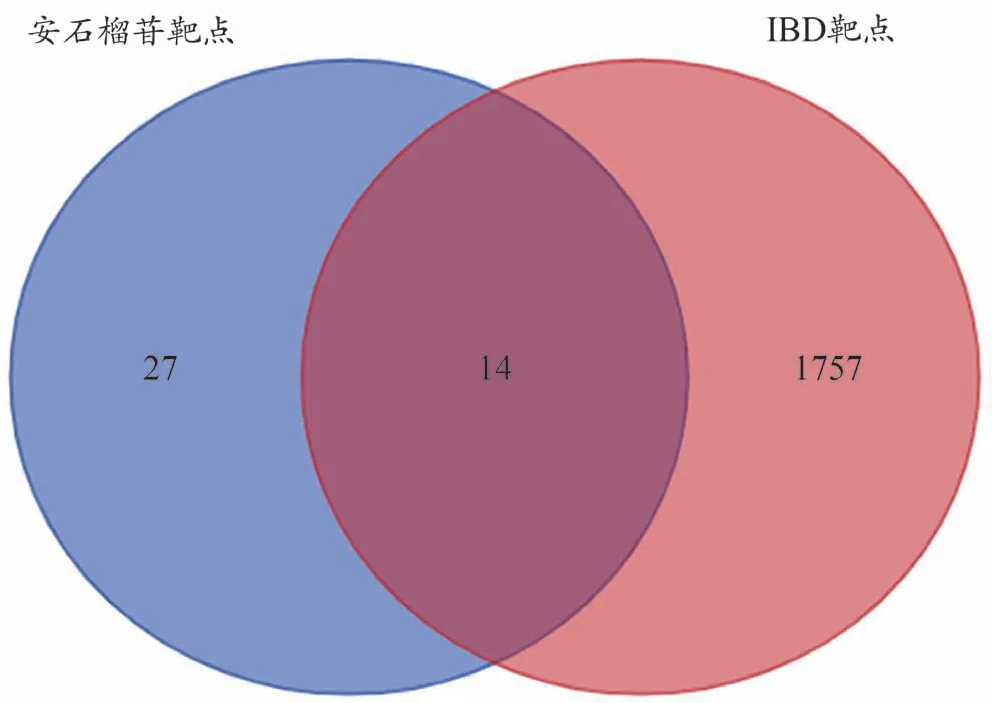
图1 安石榴苷和IBD交集靶点
2.1.2 PPI网络分析及关键靶点获取结果
将14 个交集靶点导入String 在线网站进行分析后,将有相互作用的11 个靶点数据导入Cytoscape 软件得到靶点PPI 图,靶点大小及颜色越深浅随与该靶点相互作用的靶点数多少变化,靶点间连线宽度与颜色深浅随两靶点相互作用密程度变化,见图2。其中相关性较高的节点分别是肿瘤坏死因子(Tumor necrosis factor,TNF)、血管内皮生长因子(Vascular endothlial growth factor,VEGFA)、前列腺素内过氧化物合成酶2(Prostaglandin-endoperoxide synthase 2,PTGS2)、白细胞介素2(Interleukin2,IL2)、花生四烯酸-5-脂氧合酶(Arachidonate-5-lipoxygenase,ALOX5)、人纤溶酶原激活物抑制剂1(SERPINE1)、IIA 组磷脂酶 A2 重组蛋白(Phospholipase A2 group IIA,PLA2G2A)、血小板生长因子(PGF)、蛋白酪氨酸磷酸酶非受体型2(Protein tyrosine phosphatase nonreceptor type 2,PTPN2)、CD38 蛋白、黄嘌呤脱氢酶(Xanthine dehydrogenase,XDH)等,见图3。这些节点在PPI 网络中起着关键作用,可能是安石榴苷治疗炎症性肠病的关键靶点。
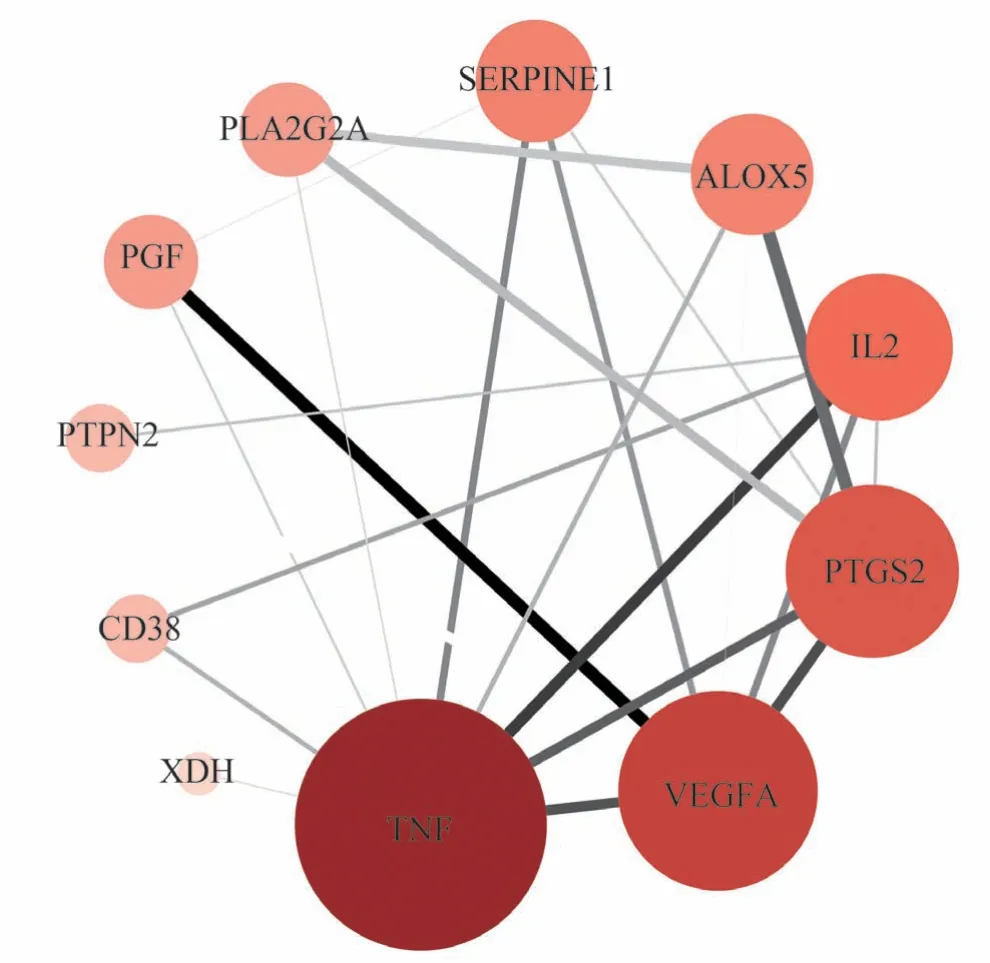
图2 PPI网络互作图

图3 拓扑分析PPI靶点度值图
2.1.3 GO功能分析及KEGG通路富集分析
GO 分析结果显示核心靶点主要参与炎症反应的调节、对外部刺激反应的正向调节、血管伤口愈合的负调节、内肽酶活性的调节、调节细胞对压力的反应等生物过程。获得190 条分子功能,包括:蛋白酶结合、细胞因子受体结合、水解酶活性、蛋白质同二聚化活性、脂质结合等方面。获得134 条细胞组成,主要有:分泌颗粒管腔、细胞质核周区等方面,见表4,图4。核心靶点经过KEGG 通路分析得到16 条信号途径,主要集中在Ras 信号通路、花生四烯酸代谢信号通路、AGE-RAGE 信号、胰腺分泌物以及C 型凝集素受体等信号途径,见图5。
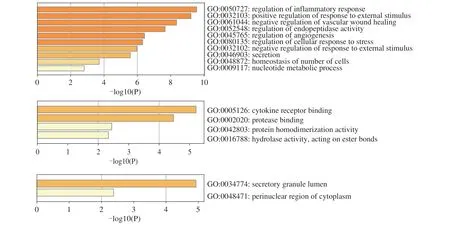
图4 生物过程(Biological process,BP)、分子功能(Molecular function,MF)及细胞组分(Cell component,CC)GO富集分析图

图5 KEGG富集分析图
表4 GO功能分析
2.1.4 分子对接验证
分子对接结果显示,安石榴苷与TNF 的结合分值最高(-10.4 kcal·mol-1),表明安石榴苷与TNF 之间具有较强的结合活性,对接结果见表5、图6。
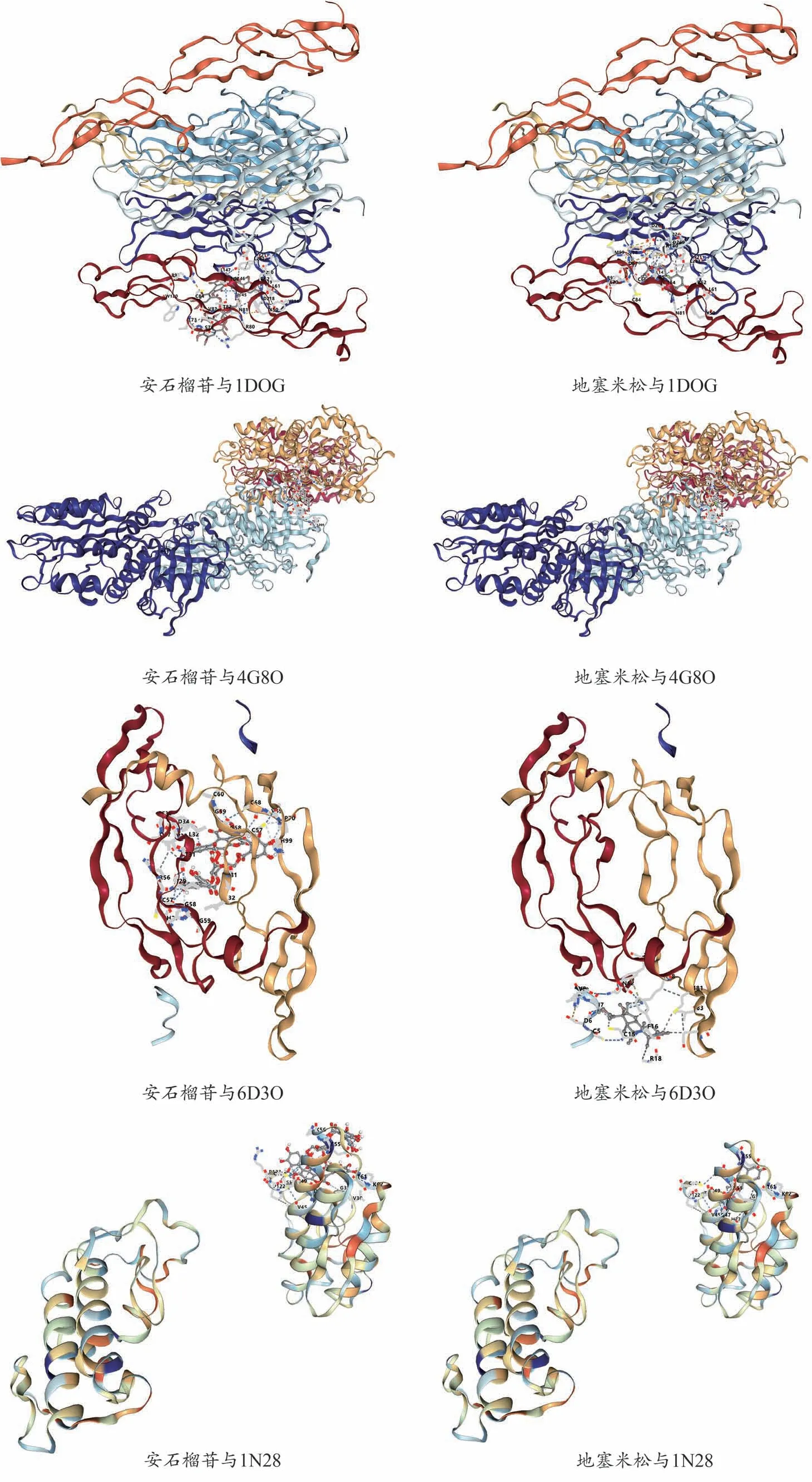
图6 安石榴苷与预测靶点的分子对接图

表5 安石榴苷与预测靶点的结合能
2.2 动物实验结果
2.2.1 安石榴苷对IBD小鼠体质量的影响
小鼠于饮用2.5% DSS 溶液后第3 天出现懒动、排稀便、体质量下降、粪便隐血阳性,进食和饮水量减少。造模第4 天,模型组体质量与对照组比较明显下降(P<0.001)。造模第7 天,与对照组比较,IBD 模型组小鼠体质量明显降低(P<0.001);与IBD 模型组比较,高剂量安石榴苷组给药后小鼠体质量显著升高(P<0.001),中剂量安石榴苷组给药后小鼠体质量显著升高(P<0.05),低剂量安石榴苷组给药后小鼠体质量差异无统计学意义;低、中、高剂量安石榴苷组比较小鼠体质量差异无统计学意义;结果表明中、高剂量安石榴苷可以明显减小IBD 小鼠体质量下降幅度;与IBD 模型组比较,阳性药地塞米松干预后的小鼠体质量显著升高(P<0.01),表明地塞米松可以明显减小IBD 小鼠体质量下降幅度。与地塞米松组比较,中、高剂量安石榴苷组小鼠体质量差异无统计学意义,见图7。
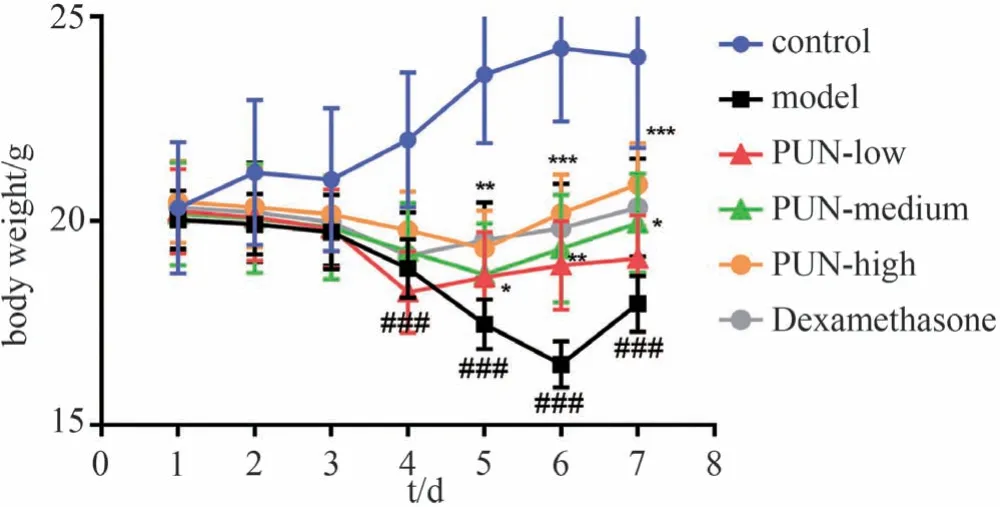
图7 安石榴苷对炎症性肠病小鼠体质量变化的影响(±s,n=10)
2.2.2 安石榴苷对IBD小鼠DAI评分的影响
随造模时间延长,IBD 模型组小鼠症状逐渐加重,DAI 评分逐渐升高,第5 天开始出现不同程度的肉眼血便。造模第7 天,与对照组比较,IBD 模型组小鼠DAI 评分明显升高(P<0.001);与IBD 模型组比较,低、中、高剂量组安石榴苷干预后的小鼠DAI 评分显著降低(P<0.001),高剂量组DAI 评分显著低于低剂量组(P<0.001),表明安石榴苷可以明显降低IBD 小鼠DAI评分,高剂量组治疗效果更显著;与IBD 模型组比较,阳性药组地塞米松干预后的小鼠DAI 评分显著降低(P<0.001),高剂量组小鼠DAI评分显著低于地塞米松组(P<0.001),表明地塞米松可以明显降低IBD 小鼠DAI评分,高剂量安石榴苷治疗效果更优,见图8。
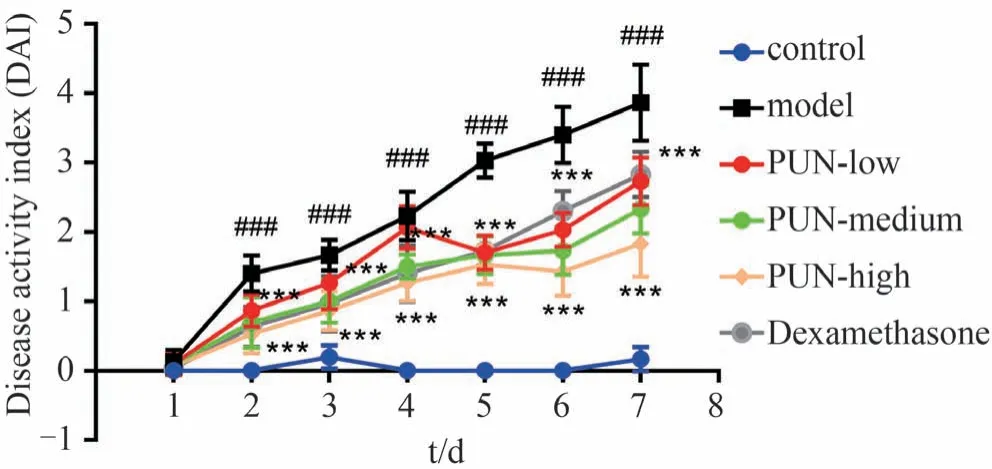
图8 安石榴苷对炎症性肠病小鼠DAI评分的影响(±s,n=10)
2.2.3 安石榴苷对IBD小鼠结肠组织学损伤的影响
对照组结肠结肠黏膜完整、结构清晰、未发现炎性细胞明显浸润及溃疡;隐窝结构完整,杯状细胞丰富。IBD 模型组小鼠结肠黏膜不完整,大部分腺体被破坏,腺体正常结构丧失,排列紊乱,部分杯状细胞消失,隐窝结构被破坏。安石榴苷干预组结肠组织炎性细胞浸润明显减少,腺体破坏较轻,炎性细胞数量也显著减少,炎症程度明显减轻,见图9。
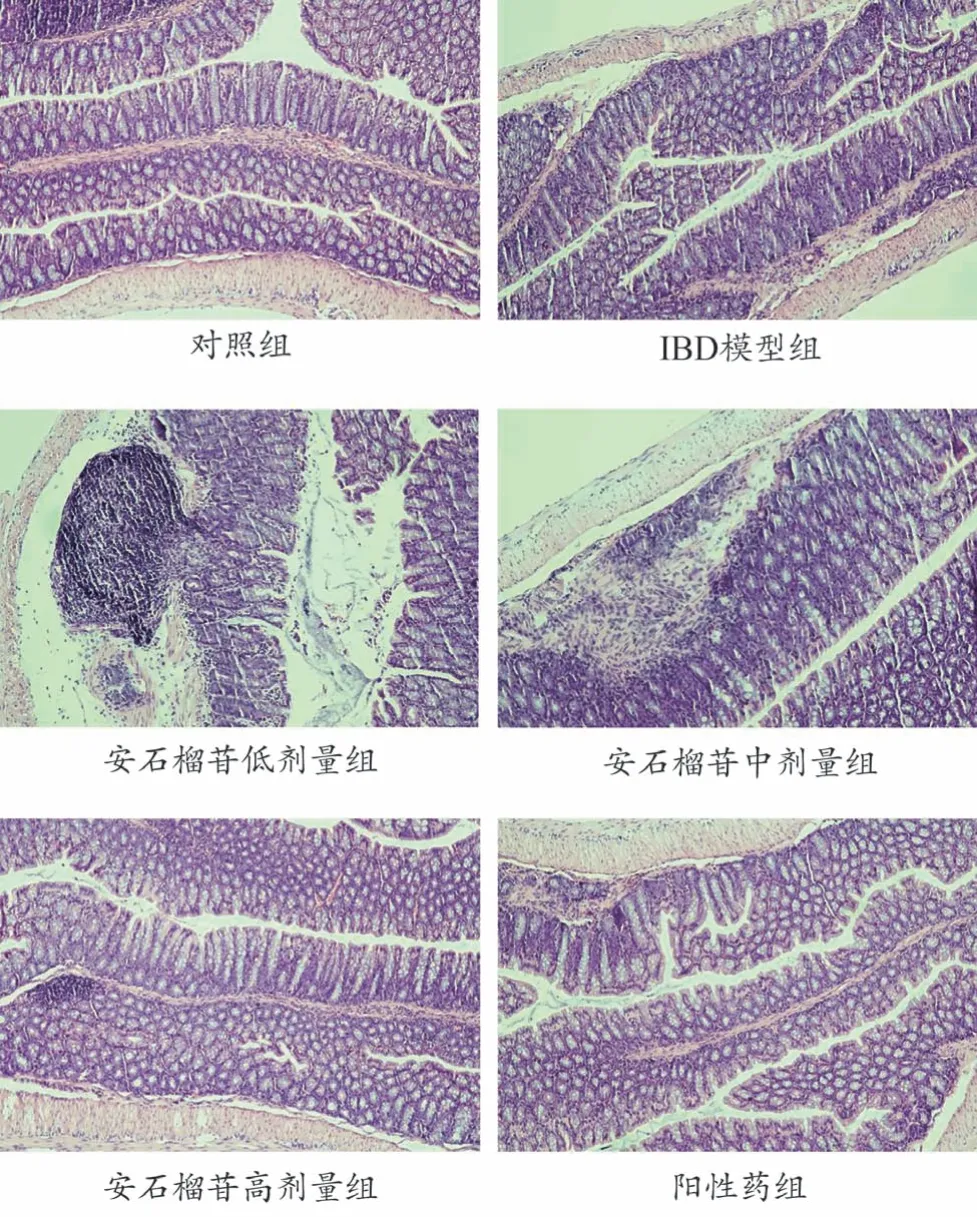
图9 安石榴苷对炎症性肠病小鼠肠壁病理变化的影响(HE,×10)
2.2.4 安石榴苷对小鼠结肠组织学损伤评分的影响
IBD 模型组的组织学评分明显高于对照组的组织学评分(P<0.001);中、高剂量安石榴苷组的组织学评分明显低于模型组的组织学评分(P<0.01、P<0.001);阳性药组的组织学评分也明显低于模型组的组织学评分(P<0.001)。安石榴苷组与阳性药地塞米松组的组织学评分的差异无统计学意义,见图10。

图10 安石榴苷对小鼠结肠组织学损伤评分的影响(±s,n=10)
2.2.5 安石榴苷对小鼠炎症因子水平的影响
模型组TNF-α、IL-1β、MPO、CXCL1、IL-6、IL-18、IFN-γ 水平明显高于对照组(P<0.001),高剂量安石榴苷干预后TNF-α、IL-1β、MPO、CXCL1、IL-6、IL-18、IFN-γ 水平明显下降(P<0.001)。阳性药地塞米松干预后,TNF-α、IL-1β、MPO、CXCL1、IL-6、IL-18、IFN-γ 水平明显下降(P<0.001)。高剂量安石榴苷组TNF-α、IL-1β、MPO、CXCL1、IL-6、IL-18、IFN-γ 水平与阳性药地塞米松组比较差异无统计学意义。模型组IL-10 水平明显低于对照组(P<0.001),高剂量安石榴苷干预后IL-10 水平明显升高(P<0.001)。阳性药地塞米松干预后,IL-10 水平明显升高,差异有统计学意义(P<0.01)。高剂量安石榴苷组IL-10 水平与阳性药地塞米松组比较差异无统计学意义,见图11。
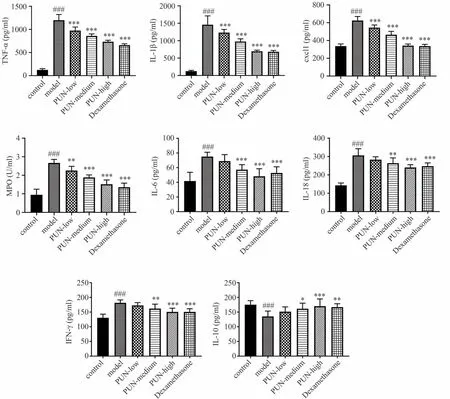
图11 安石榴苷对炎症性肠病小鼠炎症因子水平的影响(±s,n=10)
2.2.6 安石榴苷对肠通透性的影响
模型组肠通透性明显高于对照组(P<0.001),低、中、高剂量安石榴苷干预肠通透性明显下降(P<0.01、P<0.001、P<0.001)。阳性药地塞米松干预后,肠通透性明显下降(P<0.001)。高剂量安石榴苷组肠通透性与阳性药地塞米松组比较差异无统计学意义,见图12。
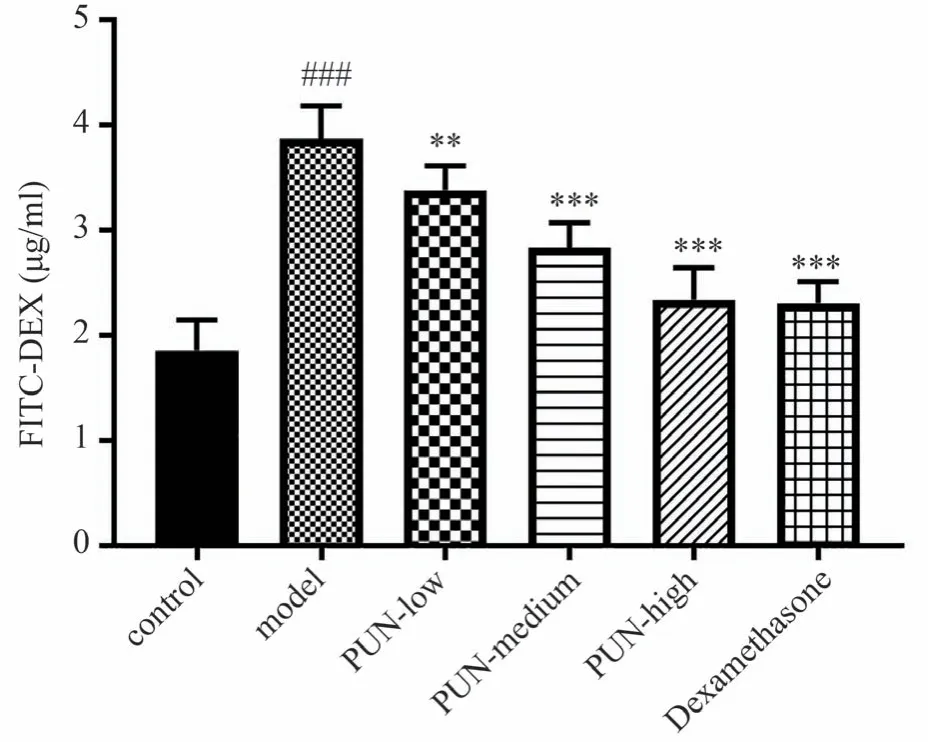
图12 安石榴苷对炎症性肠病小鼠肠通透性的影响(±s,n=10)
2.3 细胞实验
2.3.1 安石榴苷对caco-2细胞增殖活性的影响
利用2% DSS 制造IBD 细胞模型,CCK8 法测定不同浓度安石榴苷对caco-2 细胞增殖影响,安石榴苷在0-10 μmol·L-1浓度范围内对caco-2 细胞增殖无影响;安石榴苷在20、50、100、200、300 μmol·L-1浓度范围内,caco-2细胞呈现出增殖增加趋势(P<0.05、P<0.05、P<0.001、P<0.01、P<0.001),见图13。

图13 安石榴苷对caco-2细胞增殖的影响(±s,n=6)
2.3.2 安石榴苷对LPS诱导caco-2细胞释放细胞因子的影响
模型组TNF-α 水平明显高于对照组(P<0.001),中、高剂量安石榴苷干预后TNF-α 水平明显下降(P<0.001)。阳性药地塞米松干预后,TNF-α 水平明显下降(P<0.001)。高剂量安石榴苷组TNF-α 水平与阳性药地塞米松组比较差异无统计学意义。模型组IL-10水平明显低于对照组(P<0.001),中、高剂量安石榴苷干预后IL-10 水平明显升高(P<0.05、P<0.01)。阳性药地塞米松干预后,IL-10 水平明显升高(P<0.01)。高剂量安石榴苷组IL-10水平与阳性药地塞米松组比较差异无统计学意义,见图14。

图14 安石榴苷对caco-2细胞分泌炎症因子水平的影响(±s,n=6)
3 讨论
该研究通过网络药理学对安石榴苷治疗IBD的作用靶点进行了预测,PPI 网络分析显示,与安石榴苷治疗IBD 有关的前10 位靶点分别是TNF、ALOX5、VEGFA、SERPINE1、PLA2G2A 等。TNF 是一种可诱发肿瘤细胞死亡或凋亡的细胞因子,包括:TNF-α 和TNF-β。TNF 是免疫反应中最先释放的细胞因子,具有强大的促炎作用,诱发了IBD 等多种炎症性疾病。TNF 通过不同的机制介导肠道炎症,可直接诱导肠上皮细胞凋亡,IBD 患者肠上皮细胞中TNF 分泌水平增高,并伴随肠上皮细胞凋亡[15-17]。TNF 还可以通过激活NF-ΚB 信号通路,导致肠道免疫反应过度激活,促炎因子与趋化因子分泌增多,在损伤组织中过度集聚,从而造成局部组织炎症损伤[18]。NF-ΚB 信号通路激活导致肌球蛋白轻链激酶过度表达,破坏肠黏膜屏障的紧密连接[19-21]。肠黏膜屏障通透性增强导致细菌和内毒素侵袭几率增加,过度激活免疫系统,从而引发炎症和组织损伤。
TNF-α 作为IBD 的易感基因,是IBD 治疗的关键靶点。目前被批准用于IBD 治疗的TNF-α 拮抗剂有:英夫利昔单抗、阿达木单抗等。英夫利昔单抗开创了生物制剂治疗IBD 的新时代,对中、重度IBD 临床疗效显著[22-23]。英夫利昔单抗可以中和TNF-α,调节促炎症细胞因子分泌,与TNF-α 结合后抑制其与受体结合,抑制CD4+T 细胞和Th17 细胞分化产生的促炎细胞因子,如:IFN-γ、IL-13、IL-17A、IL-12、TNF 等水平,从而促进炎症消退,有效缓解IBD 患者临床症状[24]。
本研究对安石榴苷治疗IBD 的14 个靶点进行GO功能富集分析,结果涉及炎症反应的调节、外部刺激反应的正向调节、血管伤口愈合的负调节、蛋白激酶活性等生物学过程。KEGG 富集分析得到了与安石榴苷治疗IBD 相关的信号通路总共有16 条,其中涉及有花生四烯酸代谢通路、Ras 信号通路等。花生四烯酸经过环氧合酶-2(Cyclooxygenase-2,COX-2)产生前列腺素(Prostaglandins,PGs),COX-2 的过表达会促进PGs生成,引起组织炎症及细胞功能破坏[25-29]。安石榴苷可能作用于花生四烯酸代谢通路中COX-2、PLA2G2A、ALOX5、PTGS2 等多种酶表达,抑制炎症反应,发挥治疗IBD 作用。Ras/Raf-1/ERK 作为介导细胞生存代谢及炎症的一条重要信号通路,在微小血管生成、肿瘤、糖尿病、类风湿性关节炎等疾病发生发展过程起到关键的调控作用[30-35]。另一方面,Ras/Raf-1/ERK 是参与组织损伤愈合过程的主要信号通路之一,能够通过调控VEGF、VEGFR 的表达水平,调节血管新生的全过程,从而促使组织损伤创面愈合[36-40]。安石榴苷可能作用于Ras/Raf-1/ERK 信号通路,调控VEGFA表达水平,促进结肠溃疡创面愈合。
正常情况下,结肠组织中促炎因子与抑炎因子处于平衡状态,当组织损伤时,促炎因子分泌增多,抑炎因子分泌相对不足,导致了损伤组织中促炎因子与抑炎因子表达失衡,而过多分泌的促炎因子又会激活机体免疫系统,导致持续的炎症免疫反应,造成组织炎症损伤[41-42]。因此恢复促炎因子与抗炎因子间的平衡,可以抑制肠道免疫过度激活,缓解结肠组织损伤,促进损伤组织的修复,是治疗IBD 的主要策略。本实验研究证实了石榴皮中活性成分安石榴苷可以缓解小鼠结肠炎的症状,并且在测试剂量下未见明显毒性反应。安石榴苷在实验中显示出明显的抗IBD 活性,给药7 天后小鼠的体质量下降幅度减小、粪便成型、DAI评分降低、小鼠结肠组织中促炎因子水平下降、抗炎因子水平升高、肠黏膜通透性降低。安石榴苷与TNF-α 靶点蛋白的结合分值为-10.4 kcal·mol-1,表现出较强的结合活性。ELISA 实验结果显示,安石榴苷能够有效抑制促炎因子TNF-α、IL-1β、MPO、CXCL1、IL-6、IL-18、IFN-γ分泌,上调抗炎因子IL-10水平,恢复促炎因子与抗炎因子间的平衡,抑制由TNF-α 介导的肠道炎症反应。大量的促炎因子(如TNF-α、IL-1β)能够下调紧密连接蛋白的表达,导致肠黏膜屏障功能紊乱,增加肠通透性。安石榴苷能够有效降低肠道通透性,对肠黏膜屏障具有保护作用。细胞实验结果发现安石榴苷在20-300 μmol·L-1浓度范围内可促进caco-2 细胞的增殖,对DSS 诱导的caco-2 细胞损伤具有保护作用。同时抑制TNF-α分泌,上调IL-10水平,缓解LPS诱导的caco-2细胞炎症反应,发挥抗炎作用。
本研究运用网络药理学对安石榴苷治疗炎症性肠炎的作用靶点进行了分析与预测[43-50],并进一步采用分子对接及动物实验对安石榴苷药效进行验证,结合动物实验与细胞实验结果明确安石榴苷抑制TNFα 等促炎因子的分泌,上调抗炎因子IL-10 水平,恢复促炎因子与抗炎因子间的平衡,减轻肠道炎症反应而发挥抗IBD 作用,为以后安石榴苷抗IBD 的分子机制深入研究提供了理论依据。
