基于HMGB1/TLR4/NF-κB通路探讨参芪抑瘤方联合顺铂对H22肝癌荷瘤小鼠的抑瘤作用及免疫功能的影响*
2023-12-28杨玉萍段永强梁建庆曹力仁虎峻瑞范红丽
杨玉萍,段永强,梁建庆**,白 敏,冯 鑫,曹力仁,虎峻瑞,范红丽
(1. 甘肃中医药大学基础医学院 兰州 730000;2. 甘肃省实验动物行业技术中心 兰州 730000;3. 宁夏医科大学中医学院 银川 750004)
原发性肝癌(Primary liver cancer,PLC)是我国常见的恶性肿瘤之一,其死亡率高居国内恶性肿瘤第二位[1-3],中国占全球发病率的48.4%以上[4]。其作为最常见的消化道恶性肿瘤,早期起病隐匿,发现时已处于晚期,西医常规治疗首选手术及放化疗,但由于确诊时患者肝癌已处于晚期,常规治疗对患者的伤害较大,且复发率和转移率高[5],其中对不能进行肝移植患者,只能用靶向药物(索拉非尼和伦伐替尼)给肝癌患者进行治疗,但仅能延长患者生存期2-3个月[6],并且对全身各个系统都产生不同程度的损伤,其中对免疫系统的影响最为显著[7],极大地降低了患者的生活质量,而中医药有明显的减毒增效特性,能够提高患者生活质量,增强机体免疫力,减轻手术、放化疗等不良反应,同时延长患者生存时间以及提高生存率[6,8],因此在治疗肿瘤免疫抑制方面有着独特的优势和不可或缺的地位。
《金匮要略·妇人妊娠病脉证并治第二十》篇中载:“妊娠,小便难,饮食如故,当归贝母苦参丸主之”。吴红彦教授结合临床精究此段文意,并在长期的疾病诊疗中,认识到肿瘤之核心病机与当归贝母苦参丸主治之证有诸多相似之处,只不过肿瘤的虚象和瘀象更加明显。故此,吴教授在当归贝母苦参丸的基础上加减化裁,创立了治疗肿瘤疾病的常用方——参芪抑瘤方。此方由黄芪、当归、贝母、苦参、山慈菇等药组成,方中重用黄芪补肺健脾,扶正益气;贝母入肝经,化痰散结,苦参清热燥湿解毒;当归补血活血,山慈菇清热化痰、软解散结,诸药相配,攻补兼施,共奏补气活血,扶正祛邪,解毒散结之功。前期课题组研究已表明参芪抑瘤方在抑制肿瘤生长、改善机体免疫力、防止肿瘤复发转移等方面具有一定的疗效[9-11]。但关于其具体的机制尚不明晰,而HMGB1/TLR4/NF-κB信号作为抑制免疫发挥作用的经典通路,在肿瘤的发病过程中具有十分重要的作用,因此,深入研究HMGB1/TLR4/NF-κB 信号通路在H22 肝癌荷瘤小鼠病理反应中的作用机制,并应用参芪抑瘤方进行干预,这有助于从新的角度认识肝癌的发病本质,并为采取积极的治疗措施提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物、细胞及药物
SPF级雄性KM 小鼠,由甘肃中医药大学SPF级动物实验中心提供,许可证号:SCXK(甘)2020-0009,伦理审查批准号:2021-205,70日龄,体重18-22 g。H22肝癌细胞株,购自武汉普诺赛生命科技有限公司(BRF1A0KT3Q)。
参芪抑瘤方所有药材均购自甘肃中医药大学附属医院,并经甘肃中医药大学中药生药学教研室李岳峰教授鉴定为正品,黄芪30 g、当归20 g、山慈菇10 g、土贝母10 g、苦参15 g、八月札30 g、莪术10 g、半枝莲20 g、白术18 g、枳壳12 g、人参15 g。所有药材按比例加水煎煮,浓缩至含生药量2.5 g·mL-1,装瓶,4℃保存备用。注射用顺铂(购自甘肃中医药大学附属医院,OKO554B03)。
1.1.2 试剂与仪器
试剂:RIPA裂解液(Cat#R0010)、BCA蛋白浓度测定试剂盒(Cat#PC0020)、4×蛋白质上样缓冲液(P1016),北京索莱宝科技有限公司;HMGB1(Cell Signaling Technology,6893S)、TLR4(GTX64330)、MyD88(ImmunoWay,YT2928)、NF-κB(Cell Signaling Technology,8242S)、β-actin(ImmunoWay,YM3028)、羊抗兔二抗(ImmunoWay,HRP-conjugated affinipure goat anti-rabbit IgG(H+L),RS0002);ECL 化学发光超敏显色试剂盒(Lot NO:57105010);FITC-CD3+(Lot:A10913)APC-CD4+(Lot:A10811)与Anti-Mouse-CD8+(Lot:A10514)单克隆抗体,联科生物;总RNA 提取试剂盒(Lot#W9414);逆转录试剂盒(LOT:G7106010);实时qPCR Mix(LOT:H9114010)。
仪器:电泳仪(041BR69450)、VE-180 型垂直板电泳装置(153BR111209)、酶标仪(iMark)、伯乐生命医学产品(上海)有限公司;GeLView 6000 plus 凝胶成像系统,广州博鹭腾生物科技有限公司;高端分析型流式细胞仪(FACSCelesta),美国BD 公司;实时荧光定量PCR仪(CG-05),杭州晶格科学仪器有限公司。
1.2 实验方法
1.2.1 复制H22肝癌荷瘤小鼠模型
复苏H22 肝癌细胞,细胞复苏后,将细胞浓度调至1×107·mL-1,每只KM小鼠腹腔接种0.2 mL。腹腔传至第三代,抽取淡黄色腹水,进行细胞计数后,选取上述最佳细胞浓度3×106·mL-1,每只小鼠消毒后于右侧腋窝接种细胞悬液0.1 mL,待触到黄豆大小肿块提示模型复制成功[12],可纳入实验研究。
1.2.2 小鼠分组及干预
50 只SPF 级雄性KM 小鼠,采用随机数字表法取10 只小鼠作为空白组,(0.1 mL·10 g-1,qd,生理盐水灌胃),其40只小鼠复制H22肝癌荷瘤小鼠模型,模型复制成功后将模型小鼠随机分为模型组(0.1 mL·10 g-1,qd,生理盐水灌胃)、顺铂组(0.1 mL·10 g-1,biw,腹腔注射2.5×10-3g·kg-1)、参芪抑瘤方组(含生药2.5 g·mL-1,0.1 mL·10 g-1,qd,灌胃)以下简称中药组)、参芪抑瘤方(含生药2.5 g·mL-1,0.1 mL·10 g-1,qd,灌胃)+顺铂组(0.1 mL·10 g-1,biw,腹腔注射2.5×10-3g·kg-1)(以下简称联合组)。顺铂和参芪抑瘤方给药均按照人与动物体质量进行折算[13],顺铂给药量为2.5×10-3g·kg-1,参芪抑瘤方给药量为27.03 g·kg-1。空白组与模型组均给予相同体积生理盐水灌胃及腹腔注射,连续干预13天,末次给药24 h 后,用戊巴比妥钠(每只0.2 mL)麻醉处死小鼠,取材待检。
1.2.3 肿瘤抑瘤率及脏器指数测定
在无菌环境下完整剥离出小鼠瘤组织和脏器组织,电子天平秤重后计算抑瘤率和脏器指数。抑瘤率(IR)=[模型组瘤质量(g)-用药组瘤治疗(g)]/模型组瘤质量(g)×100%],脏器指数=[脏器质量(㎎)/小鼠体质量(g)][14]。
1.2.4 HE染色观察各组小鼠肿瘤组织病理学变化
肿瘤组织用4%多聚甲醛固定,石蜡包埋切片后用苏木精和伊红染色,封片。光镜下观察肿瘤组织形态学变化。
1.2.5 流式细胞术检测脾组织CD4+、CD8+细胞水平
摘取新鲜脾脏并用300目细胞筛网研磨,用PBS冲洗筛网,收集细胞悬液,并调整细胞浓度为1×106mL,分别用CD3 偶联FITC、CD4 偶联APC、CD8 偶联PE 染色30 min,检测CD3+、CD4+、CD8+T 细胞的比例,通过测量T 细胞总数(CD3+细胞)中CD4+和CD8+淋巴细胞的百分比来计算结果。
1.2.6 Western blot检测肿瘤组织中相关蛋白表达
称取肿瘤组织,蛋白裂解液裂解,并定量变性,通过SDS-PAGE 凝胶电泳分离蛋白质,转膜,封闭,一抗4℃孵育过夜,1×TBST 洗膜,二抗(1∶20000)室温孵育1 h。用1×TBST 洗涤后,加入ECL 发光溶液并用凝胶成像仪曝光。采用Image J 8.0分析蛋白条带灰度值。
1.2.7 RT-PCR检测肿瘤组织中相关mRNA表达
称取肿瘤组织,提取RNA,超微光学分光光度计测量总RNA 浓度。根据逆转录试剂盒将总RNA 反转录成cDNA。GAPDH 为内参基因,每组相同基因设4 个重复,根据RT-PCR 扩充试剂盒说明扩增靶基因,并计算每个mRNA 的相对表达。引物由上海百赛生物技术股份有限公司公司合成,序列见表1。

表1 引物序列
2 数据分析
实验数据均用SPSS 24.0 软件处理,并采用均数±标准差(±s)表示,以P<0.05 表示差异有统计学意义,图片采用Image J 8.0处理。
3 结果
3.1 各组小鼠肿瘤病理学特征的变化
HE 染色显示,在模型组中,肿瘤组织细胞排列紧密,边界清晰,核大浆少,核深染,未见坏死区域(图1A);在顺铂组肿瘤细胞排列疏松,边界模糊,细胞核出现缩小破裂现象,出现坏死细胞现象(图1B);中药组肿瘤细胞坏死不明显(图1C);在联合组肿瘤细胞核固缩破裂明显,且不同程度出现片状坏死区域(图1D)。用Image J 8.0 进行肿瘤细胞核数目占比分析,与模型组相比,各治疗组肿瘤细胞核数目均减少,组间差异均有统计学意义(P<0.05);与顺铂组和中药组相比,联合组肿瘤细胞核数目减少显著(P<0.05)(见表2)。

图1 H22肝癌荷瘤小鼠肿瘤组织学变化(HE,×400)
表2 肿瘤细胞核数目占比(±s,n=6)

表2 肿瘤细胞核数目占比(±s,n=6)
注:与模型组相比,*P<0.05;与顺铂组相比,#P<0.05;与中药组相比,&P<0.05。
细胞核占比(%)-39.39±1.833 27.67±0.91*33.83±2.36*24.75±2.22*#&组别空白组模型组顺铂组中药组联合组
3.2 各组小鼠体质量、瘤体积及抑瘤率的变化
与模型组相比,各治疗组平均瘤质量均降低(P<0.05)见表3。与模型组相比,各治疗组小鼠瘤体积均减小,联合用药组小鼠瘤体积减小显著(P<0.05),见图2A;与模型组相比,各治疗组小鼠体质量均升高,联合用药组升高明显(P<0.05),见图2B。

图2 各组小鼠瘤体积和体质量变化
表3 各组瘤质量和抑瘤率(±s,n=10)

表3 各组瘤质量和抑瘤率(±s,n=10)
注:与模型组相比,*P<0.05。
组别空白组模型组顺铂组中药组联合组瘤质量(g)-5.30±1.16 3.01±0.88*4.11±1.31*2.44±0.93*抑瘤率(%)--43.15%22.32%53.97%
3.3 各组小鼠脾指数、胸腺指数的变化
与空白组相比,模型组小鼠脾指数、胸腺指数均降低(P<0.05);与模型组和顺铂组相比,中药组和联合用药组小鼠脾脏指数、胸腺指数均升高(P<0.05);与中药组相比,联合组小鼠脾脏指数、胸腺指数均降低,但差异无统计学意义(P>0.05),见表4。
表4 各组小鼠脾指数和胸腺指数(±s,n=10)

表4 各组小鼠脾指数和胸腺指数(±s,n=10)
注:与空白组相比,¥P<0.05;与模型组相比,*P<0.05;与顺铂组相比,#P<0.05。
组别空白组模型组顺铂组中药组联合组脾指数(mg·g-1)8.59±2.02 4.00±2.69¥3.45±1.71 7.34±3.08*#6.94±2.75*#胸腺指数(mg·g-1)2.51±0.93 0.79±0.29¥0.70±0.40 2.13±0.92*#1.53±0.53*#
3.4 各组小鼠脾脾淋巴细胞亚群水平的变化
流式结果显示(图3、表5),与空白组相比,模型组小鼠脾脏组织中CD4+T细胞水平降低,CD8+T细胞水平升高(P<0.05);与模型组和顺铂组相比,中药组和联合组小鼠脾脏组织中CD4+T细胞水平、CD4+/CD8+比值均升高,CD8+T细胞水平降低(P<0.05);与中药组相比,联合组小鼠脾脏组织中CD4+T细胞水平、CD4+/CD8+比值降低,CD8+T 细胞水平升高(P>0.05)。结果表明,在调节机体免疫方面,单用中药略优于联合用药。

图3 各组小鼠脾淋巴细胞亚群水平变化
表5 各组小鼠脾淋巴细胞亚群水平变化(±s,n=3)

表5 各组小鼠脾淋巴细胞亚群水平变化(±s,n=3)
注:与空白组相比,¥P<0.05;与模型组相比,*P<0.05;与顺铂组相比,#P<0.05。
组别空白组模型组顺铂组中药组联合组CD4+24.73±1.00 19.13±0.38¥17.77±1.99 24.17±3.10*#21.57±1.70#CD8+18.17±1.33 25.17±2.59¥27.30±1.97 19.90±1.44#22.00±2.85*#CD4+/CD8+1.52±0.15 0.77±0.07¥0.65±0.07 1.21±0.09*#1.00±0.20*#
3.5 参芪抑瘤方联合顺铂对H22 肝癌荷瘤小鼠肿瘤组织中HMGB1、TLR4、MyD88 和NF-κBmRNA 表达的影响
RT-PCR 结果显示(表6),与模型组相比,各治疗组瘤组织中HMGB1、TLR4、MyD88 和NF-κB mRNA 表达均降低(P<0.05);与顺铂组相比,联合组瘤组织中HMGB1、TLR4、MyD88 和NF-κB 蛋白表达均降低(P<0.05);与中药组相比,联合组瘤组织中HMGB1、TLR4、MyD88 和NF-κB 蛋白表达均降低(P<0.05)。
表6 各组小鼠肿瘤组织中HMGB1、TLR4、MyD88及NF-κB mRNA的表达变化(±s,n=4)

表6 各组小鼠肿瘤组织中HMGB1、TLR4、MyD88及NF-κB mRNA的表达变化(±s,n=4)
注:与模型组相比,*P<0.05;与顺铂组相比,#P<0.05;与中药组相比,&P<0.05。
NF-κB/GAPDH 1.00±0.00 0.64±0.04*0.87±0.05*0.47±0.03*#&组别模型组顺铂组中药组联合组HMGB1/GAPDH 1.00±0.00 0.57±0.03*0.83±0.05*0.32±0.02*#&TLR4/GAPDH 1.00±0.00 0.74±0.05*0.91±0.07*0.61±0.06*#&MyD88/GAPDH 1.00±0.00 0.48±0.03*0.75±0.10*0.37±0.02*#&
3.6 参芪抑瘤方联合顺铂对H22 肝癌荷瘤小鼠肿瘤组织中HMGB1、TLR4、MyD88和NF-κB蛋白表达的影响
Western Blot 结果显示(图4,表7),与模型组相比,各治疗组瘤组织中HMGB1、TLR4、MyD88 和NFκB 蛋白表达均降低(P<0.05);与顺铂组相比,联合组HMGB1、TLR4、MyD88 和NF-κB 蛋白表达降低(P<0.05);与中药组相比,联合组HMGB1、TLR4、MyD88和NF-κB 蛋白表达降低(P<0.05)。结果表明单用参芪抑瘤方或顺铂能够降低瘤组织中HMGB1、TLR4、MyD88 和NF-κB 蛋白表达水平,抑制炎性反应,但联合用药组治疗效果显著。

图4 参芪抑瘤方对H22肝癌小鼠肿瘤组织中HMGB1、TLR4、MyD88和NF-κB蛋白表达影响图谱
表7 参芪抑瘤方对H22肝癌小鼠肿瘤组织中HMGB1、TLR4、MyD88和NF-κB蛋白表达影响(±s,n=3)
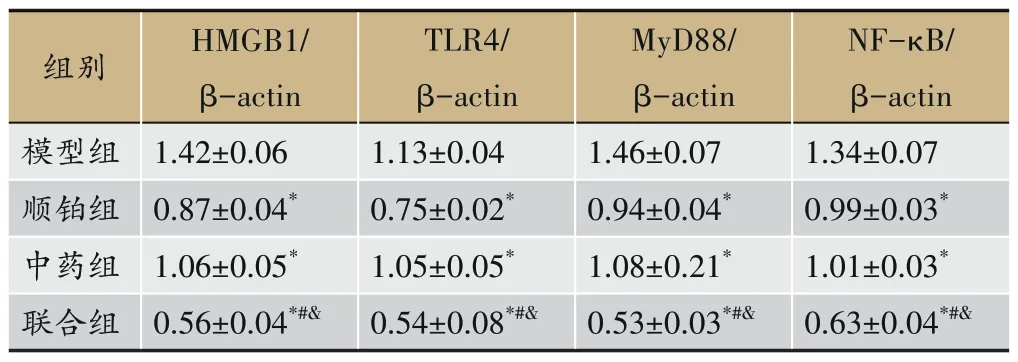
表7 参芪抑瘤方对H22肝癌小鼠肿瘤组织中HMGB1、TLR4、MyD88和NF-κB蛋白表达影响(±s,n=3)
注:与模型组相比,*P<0.05;与顺铂组相比,,#P<0.05;与中药组相比,&P<0.05。
组别模型组顺铂组中药组联合组HMGB1/β-actin 1.42±0.06 0.87±0.04*1.06±0.05*0.56±0.04*#&TLR4/β-actin 1.13±0.04 0.75±0.02*1.05±0.05*0.54±0.08*#&MyD88/β-actin 1.46±0.07 0.94±0.04*1.08±0.21*0.53±0.03*#&NF-κB/β-actin 1.34±0.07 0.99±0.03*1.01±0.03*0.63±0.04*#&
4 讨论
肝癌属于中医“积聚”、“肝积”等范畴。特别是近年来,随着中医药的发展和临床的广泛应用,相较于西医治疗后虽能取得一定的宏观效果,但其不良反应明显、复发率和转移率高等特点[5],5 年生存率仅为10.1%[15],中医药治疗能改善患者临床症状,提高生活质量,增强机体免疫力,延长患者生存时间的优势正更加突出[16]。此已被国内的诊疗指南所推荐[17]。因此,中西医结合疗法已成为临床治疗肿瘤的一种有效手段。本实验通过小鼠腹腔注射H22 肝癌细胞进行传代,传至第3 代,收集细胞,于小鼠右侧腋窝皮下种植的方法复制H22 肝癌荷瘤小鼠模型,并给与参芪抑瘤方和顺铂进行干预治疗,本研究结果显示,各治疗组小鼠的肿瘤抑制率为43.15%、22.31%、53.97%,与模型组相比,各治疗组小鼠平均瘤质量均下降,且联合组对肿瘤抑制效果显著(P<0.05),表明参芪抑瘤方联合顺铂能有效抑制肿瘤生长,且优于单用参芪抑瘤方或顺铂;实验结果表明参芪抑瘤方联合顺铂显著抑制瘤体的生长,病理检测同样证实了这一结论。
顺铂作为临床治疗肿瘤疾病的一线化疗药,能有效抑制癌细胞增殖,促进凋亡,但其选择性差,在杀死肿瘤细胞的同时,损害正常组织细胞和免疫器官,且具有免疫抑制作用[7,18]。脾脏和胸腺作为机体最大的免疫器官,主要通过淋巴细胞调节免疫功能,其脏器指数通常用于评价机体免疫状态[19]。T 淋巴细胞对于维持机体正常免疫功能至关重要[20],其中CD4+为辅助性T 细胞,主要通过促进机体免疫系统抑制肿瘤的发生、发展,CD8+为细胞毒性T细胞,具有免疫抑制作用,CD4+T 和CD8+T 淋巴细胞相互制约,共同调节机体免疫平衡[21],其比值能够直接用于评价机体免疫状态[20,22],本实验结果发现与空白组小鼠比较,H22 肝癌荷瘤小鼠脾指数、胸腺指数、CD4+T 细胞水平以及CD4+/CD8+值显著降低、CD8+T 细胞水平升高,这与既往的研究结果一致[9-11]。而参芪抑瘤方联合顺铂给药干预后,H22 肝癌荷瘤小鼠脾指数、胸腺指数、CD4+T细胞水平以及CD4+/CD8+值不同程度升高、CD8+T细胞水平降低,表明参芪抑瘤方联合顺铂显著改善了H22肝癌荷瘤小鼠机体免疫状态。
高迁移率族蛋白B1(High mobility group protein,HMGB1)是一种高度保守的核蛋白,广泛存在并参与许多疾病的发展,尤其在恶性肿瘤中发挥着至关重要的作用,且参与炎症、免疫、增殖、转移和自噬等多种信号转导通路的调节[23-24]。恶性肿瘤组织中HMGB1的释放,可能与TLR4/MyD88/NF-κB 通路相关[25],其主要作用是诱导机体免疫抑制。TOLL 样受体4(Tolllike receptor 4,TLR4)能够通过髓分化因子88(Recombinant myeloid differentiation factor 88,MyD88)激活核因子κB(nuclear factor kappa-B,NF-κB)信号通路介导炎症反应及免疫抑制作用[26-27],而TLR4 作为内源性HMGB1 受体[28],能够结合HMGB1 激活NF-κB信号通路,从而促进肿瘤的发生发展[29]。本实验结果发现各治疗组能有效降低肿瘤组织中HMGB1、TLR4、MyD88 和NF-κB mRNA 和蛋白表达,且联合用药组效果显著(P<0.05),实验结果表明参芪抑瘤方联合顺铂可能通过抑制HMGB1/TLR4/NF-κB 信号通路相关蛋白表达而抑制肿瘤生长。
综上所述,参芪抑瘤方联合顺铂能有效抑制肿瘤的生长,调节T淋巴细胞亚群平衡,逆转免疫抑制并增强抗肿瘤免疫应答,改善肿瘤微环境,提高机体免疫功能,其机制可能与抑制HMGB1/TLR4/NF-κB信号通路活化有关。
