黄芪总皂苷抑制胆管反应抗胆汁性肝纤维化的作用机制研究*
2023-12-28胡永红慕永平陈佳美
方 静,胡永红,梁 悦,慕永平,刘 伟,刘 平,3,吕 莹,陈佳美**
(1. 上海中医药大学附属曙光医院 上海 201203;2. 上海市中医药研究院肝病研究所,肝肾疾病病证教育部重点实验室,上海市中医临床重点实验室 上海 201203;3. 上海中医药大学交叉科学研究院 上海 201203)
胆汁性肝纤维化是慢性肝病尤其是胆汁淤积性肝病累及胆管的特征性病理变化,可进一步发展为胆汁性肝硬化,甚至引起肝衰竭[1]。控制病因、药物治疗缓解或阻断胆汁淤积以及抗肝纤维化治疗是其主要治疗手段。熊去氧胆酸或奥贝胆酸等药物治疗面临着应答不完全、剂量依赖性瘙痒、以及经济负担重等问题[2]。因此,探索胆汁性肝纤维化发生发展的病理机制及其治疗手段具有重要的临床应用价值。
胆管反应(Ductular reaction,DR)的病理特点包括胆管增生、基质变化和炎性细胞的浸润,是胆汁性肝纤维化发生发展的重要病理环节[3]。DR 可通过分泌促炎介质和促纤维化细胞因子促进炎症反应和肝纤维化进展[4-5],而抑制DR可治疗胆汁性肝纤维化[6]。
黄芪总皂苷(Astragalosides,ASTs)是中药黄芪的主要有效组分。课题组前期研究发现ASTs 可显著抑制胆管结扎(Bile duct ligation,BDL)诱导的大鼠胆汁性肝纤维化的进展,且主要与抑制胆管反应有关[7]。然而ASTs如何抑制胆汁性肝纤维化中的胆管反应,其主要作用机制尚未十分明确,深度解析ASTs抗胆汁性肝纤维化的作用机制可为临床研发新药奠定良好的科学基础。因此,本研究旨在探索ASTs 抑制DR 改善胆汁性肝纤维化的部分作用机制。
1 材料
1.1 实验动物
Sprague-Dawley(SD)雄性大鼠24只,SPF 级,体质量160-180 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2017-0005。所有大鼠饲养于上海中医药大学实验动物中心,环境温度25±2℃,相对湿度40%-60%,自由饮水饮食。本研究动物实验由上海中医药大学实验动物伦理委员会审批,伦理审查号:PZSHUTCM190531003,符合实验室动物管理与使用准则。
1.2 实验细胞
大鼠肝祖细胞株WB-F344 购于复祥生物技术有限公司。
1.3 实验药物及主要试剂
黄芪总皂苷(ASTs):购自西安鸿生生物技术有限公司,纯度>90%。蛋白酶磷酸酶抑制剂混合液(货号:P1050),RIPA 裂解液(货号:P0013B),APS(货号:ST005),封闭液(货号:P0220),BSA(货号:ST023),30% Acr-Bis(货号:ST003),SDS-PAGE 蛋白上样缓冲液(5×)(货号:P0015L),均购自碧云天生物技术研究所。丁酸钠(Sodium butyrate,SB)(货号:B5887),购自Sigma公司。PVDF 膜(货号:162-0177),购自Bio-Rad公司。羟脯氨酸试剂盒(货号:A030-2),购自南京建成生物工程研究所。RNA 提取试剂盒(货号:742100),逆转录试剂盒(货号:831300),均购自日本TOYOBO 公司。α-平滑肌肌动蛋白抗体(alphasmooth muscle actin,α-SMA,货号:ab124964)、上皮细胞粘附分子抗体(Epithelial cell adhesion molecule,Epcam,货号:ab71916)、结蛋白抗体(Desmin,货号:ab152500),均购自美国Abcom 公司。细胞角蛋白19抗体(Cytokeratin 19,CK19,货号:10712-1-AP)和CK7抗体(货号:15539-1-AP)购自美国Proteintech 公司。卵圆细胞标记物6 抗体(Oval Cell Marker 6,OV6,货号:sc-101863)和LOXL1 抗体(货号:sc-166632)购自美国Santa Cruz公司。
2 方法
2.1 胆管结扎模型制备及分组
将大鼠随机分为假手术组和模型组,模型组大鼠根据课题组常用的胆管结扎方法制备胆汁性肝纤维化模型[8]。胆管结扎造模后第2周首日,BDL模型组大鼠随机分为2 组:模型组(8 只),ASTs 组(8 只)。ASTs溶于双蒸水中,给予大鼠160 mg·kg-1·d-1体质量灌胃,每天1 次,连续给药3 周。假手术组和模型组大鼠予以同体积的双蒸水灌胃。第4周末处死取材。
2.2 细胞培养和处理
WB-F344在含有10% FBS的高糖DMEM 中培养,培养箱37℃,5% CO2。采用丁酸钠(Sodium butyrate,SB)(终浓度为3.75 μmol·L-1)诱导WB-F344 细胞向胆管上皮细胞表型转分化模型。同时给予ASTs(100 μg·mL-1)干预,4天后收集细胞检测。
2.3 血清生化学检测
血清天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)和丙氨酸氨基转移酶(Alanine aminotransferase,ALT)活性由上海中医药大学附属曙光医院检验科采用全自动生化分析仪东芝TBA-40FR检测。
2.4 肝组织羟脯氨酸(Hydroxyproline,Hyp)含量测定
使用试剂盒碱水解法测定大鼠肝组织Hyp 含量。取50-80 mg 肝组织,加入1 mL 碱水解液,调整pH=6.0-6.8,定容至10 mL,取4 mL 稀释水解液加活性炭30 mg 混匀,用3500 r·min-1转速离心后取1 mL 上清检测。按照说明书步骤将样品与试剂混匀,放置60℃水浴15 min,自然冷却后,用3500 r·min-1转速离心后取200 μL 上清测吸光度。测吸光度条件:550 nm,1 cm光径,双蒸水调零。
2.5 肝组织苏木精-伊红染色、天狼猩红染色
肝组织福尔马林浸泡后,常规脱水,石蜡包埋。切4 μm 厚度切片,做苏木精-伊红染色(Hematoxylin and eosin staining,HE)、天狼猩红染色(Sirius red,SR),光镜下观察大鼠肝组织炎症与胶原沉积情况。并使用Leica LAS Image Analysis 图像分析软件对SR染色的全片胶原阳性面积进行定量分析。
2.6 免疫组织化学染色
石蜡切片后,梯度酒精脱水,PBS清洗,柠檬酸溶液抗原修复,3% H2O2灭活内源性酶,封闭后一抗(α-SMA 1∶1000、Desmin 1∶200、CK19 1∶400、CK7 1∶400、Epcam 1∶800、OV6 1∶400)孵育过夜,第2 天孵育二抗,37℃孵育30 min,DAB显色,染核,脱水,封片,光镜下观察。
2.7 蛋白免疫印迹法
肝组织匀浆后提取蛋白,BCA 法测定蛋白浓度,蛋白制样后使蛋白充分变性。根据蛋白分子量大小制备分离胶和堆积胶,蛋白上样后恒压80V 电泳至结束;根据湿转转膜法进行转膜,用快速封闭液室温封闭15 min 后加一抗(Epcam 1∶1000、LOXL1 1∶250)孵育过夜;第2 天二抗孵育后,使用Odyssey 仪器进行显影,保存图像。
2.8 实时荧光定量聚合酶链式反应(qRT-PCR)
从肝组织中提取总RNA,测样品RNA 浓度,按500 ng,10 μL体系进行逆转录。按照说明书步骤和实验条件,逐步加入样品含量,4×DN Master Mix 和5×RT Master Mix II,结束取出逆转录后的cDNA 样本。然后用试剂盒SYBR Green PCR Master Mix,10 μL 体系进行PCR 扩增,采用ΔΔCT 法定量。引物序列见表1。引物由BioTNT公司设计及合成。

表1 引物序列
2.9 统计学分析
应用SPSS 22.0 for Windows 统计软件,计量资料用均数±标准差(±s)表示,多组间比较,采用单因素方差分析(One-way ANOVA),符合方差齐性检验(P>0.05),两两比较采用LSD-t法;方差不齐(P<0.05),采用Dunnett T3法,P<0.05为差异有统计学意义。
3 结果
3.1 BDL 大鼠肝组织和体外细胞中赖氨酰氧化酶家族蛋白的变化情况
HE和SR染色显示,BDL组大鼠肝组织已形成明显的肝纤维化(见图1A)。qRT-PCR结果显示,与假手术组比较,BDL 组大鼠肝组织LOX、LOXL1、LOXL2 和LOXL3 的mRNA 表达显著上调(P<0.01),而LOXL4 的mRNA表达显著下降(P<0.01)(见图1B)。体外用丁酸钠诱导WB-F344细胞后,细胞CK19的蛋白表达显著增加(见图1C),提示丁酸钠可成功诱导WB-F344细胞向胆管上皮细胞表型转分化。进一步研究发现,与对照组比较,丁酸钠组细胞LOXL1、LOXL2和LOXL4的mRNA表达显著升高(P<0.01),而LOX 和LOXL4 的mRNA 表达显著降低(P<0.01)(见图1D)。提示在BDL诱导的胆汁性肝纤维化肝组织和体外肝祖细胞向胆管上皮细胞表型分化中LOXL1和LOXL2的表达变化一致。
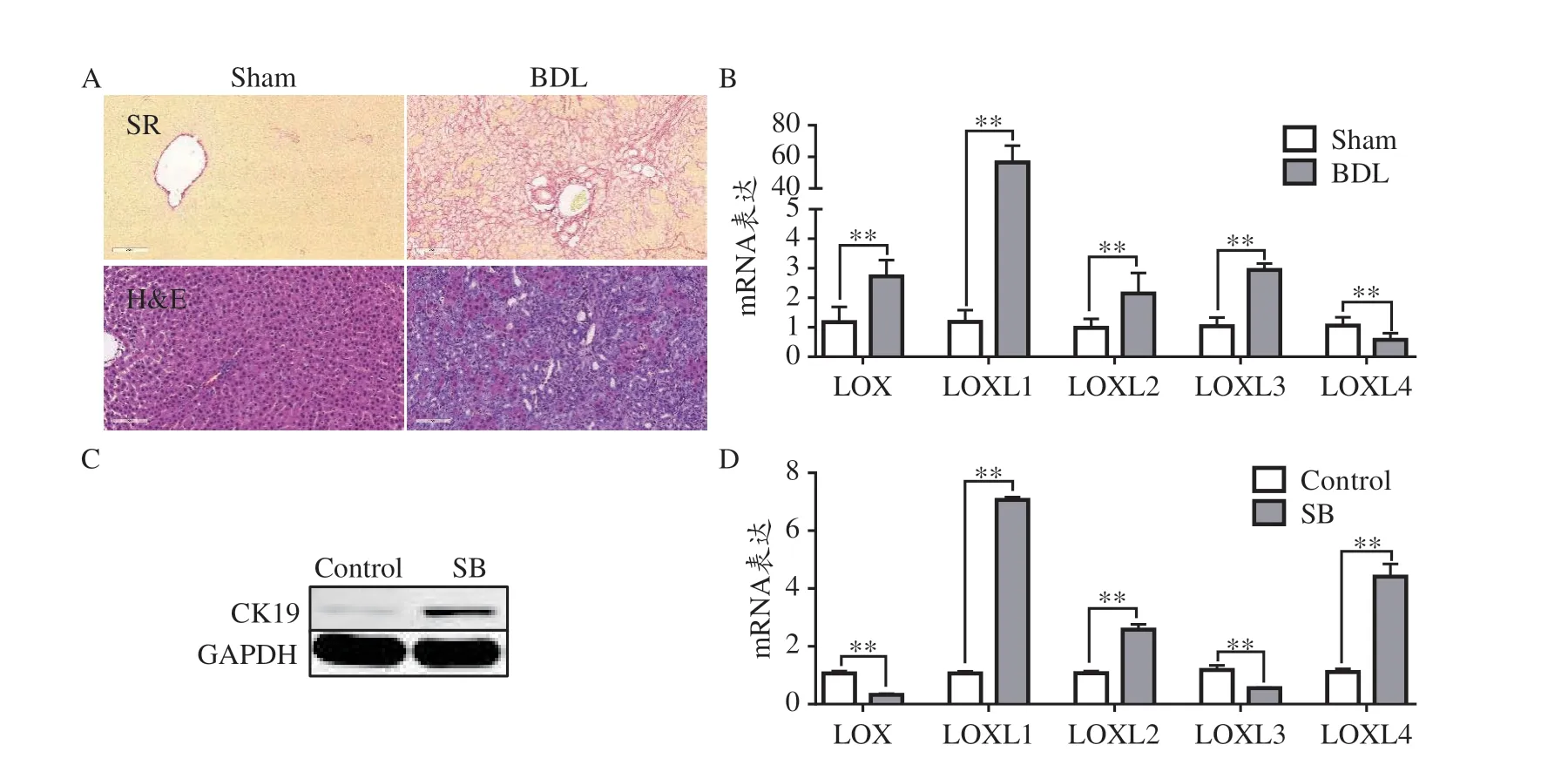
图1 BDL大鼠肝组织和体外细胞中赖氨酰氧化酶家族蛋白的变化情况
3.2 黄芪总皂苷对BDL 大鼠肝损伤和肝纤维化程度的影响
HE 染色显示,假手术组肝组织肝小叶结构完整,肝索排列整齐;与假手术组比较,BDL 组大鼠肝细胞形态结构破坏,汇管区周围可见大量不规则胆管增生和炎性细胞浸润。与BDL组比较,ASTs组肝组织胆管增生和炎性细胞浸润明显减轻(见图2A)。与假手术组比较,BDL 组大鼠血清ALT 和AST 活性显著升高(P<0.01)。与BDL 组比较,ASTs 组大鼠血清ALT 和AST活性显著降低(P<0.01)(见图2B和2C)。提示ASTs可显著改善BDL大鼠肝损伤。

图2 黄芪总皂苷对BDL大鼠肝损伤和肝纤维化程度的影响
SR 染色显示,与假手术组比较,BDL 组大鼠肝组织可见大量胶原纤维沉积,呈团簇状分布于汇管区周围,并向肝实质区域延伸。与BDL 组比较,ASTs 组大鼠肝组织胶原沉积显著减少(见图2A)。与假手术组比较,BDL组大鼠肝组织Hyp含量和SR阳性染色面积百分比均显著增加(P<0.01)。与BDL 组比较,ASTs组大鼠肝组织Hyp 含量和SR 阳性染色面积百分比均显著降低(P<0.01)(见图2D 和2E)。结果表明,ASTs 可显著降低BDL大鼠肝组织胶原沉积,减轻肝纤维化。
3.3 黄芪总皂苷对BDL 大鼠肝组织肝星状细胞活化的影响
免疫组化染色结果显示,假手术组肝组织仅血管壁表达α-SMA和Desmin;与假手术组比较,BDL组肝组织α-SMA 和Desmin 阳性表达增多,α-SMA 和Desmin阳性表达主要围绕着异常增生的胆管细胞(见图3A)。Western blot 和qPCR 结果显示,与假手术组比较,BDL组肝组织α-SMA 蛋白表达显著增加(P<0.01),而ASTs 可显著减少肝组织α-SMA 蛋白表达(P<0.05)(见图3B 和3C)。结果提示,ASTs 可显著抑制BDL 大鼠肝组织肝星状细胞活化。

图3 黄芪总皂苷对BDL大鼠肝组织肝星状细胞活化的影响
3.4 黄芪总皂苷对BDL 大鼠肝组织胆管反应的影响
免疫组化染色结果显示,假手术组大鼠肝组织中仅固有胆管上可见CK19、CK7、Epcam 和OV6 阳性表达。与假手术组比较,BDL 组大鼠肝组织CK19、CK7、Epcam 和OV6 阳性表达增多,呈团簇状不规则分布,并向门静脉和肝实质区域延伸;与BDL 组比较,ASTs组大鼠肝组织CK19、CK7、Epcam 和OV6 阳性表达减少(见图4A)。qRT-PCR 结果显示,与假手术组比较,BDL 组大鼠肝组织CK7 的mRNA 表达明显升高(P<0.01),ASTs 组肝组织CK7 的mRNA 表达较BDL 组显著降低(P<0.05)(见图4B)。Western blot结果显示,与假手术组比较,BDL 组肝组织Epcam 蛋白表达显著增加,ASTs干预后显著降低了肝组织Epcam 的蛋白表达(见图4C)。结果显示,ASTs 可显著抑制BDL 大鼠肝组织胆管反应。

图4 黄芪总皂苷对BDL大鼠肝组织胆管反应的影响
3.5 黄芪总皂苷对BDL 大鼠肝组织赖氨酰氧化酶样蛋白家族表达的影响
qPT-PCR 结果显示,与BDL 组比较,ASTs 组肝组织LOX 和LOXL1 的mRNA 表达显著下降(P<0.05,P<0.01),LOXL4 的mRNA 表达显著升高(P<0.01)(见图5A-5E)。LOXL1 的Western blot 结果与qPCR 结果一致(见图5F)。

图5 黄芪总皂苷对BDL大鼠肝组织赖氨酰氧化酶样蛋白家族表达的影响

图6 黄芪总皂苷对肝祖细胞向胆管上皮细胞表型转分化的影响
3.6 黄芪总皂苷对肝祖细胞向胆管上皮细胞表型转分化的影响
qRT-PCR 结果显示,与对照组相比,丁酸钠模型组细胞CK19、LOXL1 和LOXL2 的mRNA 表达显著升高(P<0.01),而ASTs 组细胞CK19、LOXL1 和LOXL2的mRNA 表达显著降低(P<0.05),提示ASTs可抑制肝祖细胞向胆管上皮细胞表型转分化,且与下调细胞LOXL1和LOXL2的表达有关。
4 讨论
DR 被认为是胆汁性肝纤维化发生、发展的重要起始病理环节。胆汁淤积时,胆管细胞大量增殖,新生的胆管细胞可分泌促纤维化因子,刺激静止的肝星状细胞和成纤维细胞活化、迁移与增殖[4],导致细胞外基质的过度沉积,促进肝纤维化的发生、发展。因此,抑制DR可部分甚至完全逆转胆汁性肝纤维化[9]。
ASTs 是黄芪的主要有效组分,对心肌、肝、肺、肾间质及腹膜纤维化等发挥一定的抗纤维化作用[10-12]。前期研究发现ASTs 可能是通过抑制DR 发挥改善BDL 诱导的大鼠肝纤维化作用[7]。本研究中证实ASTs可显著改善BDL 诱导的大鼠肝损伤、减少肝组织胶原沉积,抑制肝星状细胞活化。进一步研究发现ASTs干预后可显著降低BDL 大鼠肝组织胆管反应标记物CK19、CK7、Epcam 和OV6 的表达;且对丁酸钠诱导肝祖细胞向胆管上皮细胞表型转分化过程中给予ASTs干预发现细胞CK19 表达显著减少,提示ASTs 可显著抑制DR,改善胆汁性肝纤维化。
赖氨酰氧化酶(Lysyl oxidase,LOX)家族蛋白又称蛋白赖氨酸-6-磷酸酶家族蛋白,包括5种蛋白(LOX,LOX 样蛋白(LOXL1-4)),是一种可催化包括肝脏在内的纤维化器官细胞外基质组成(如胶原和弹性蛋白)的铜依赖酶[13-14]。大量的实验研究表明,LOX,LOXL1或LOXL2是治疗肝纤维化的潜在靶点[15-17]。研究报道,胆道闭锁婴儿的肝内胆管大量表达LOXL2[18]。动物实验研究也发现在Mdr2敲除的纤维化肝组织中,LOXL2 主要表达在胆管反应细胞(即肝祖细胞和新生胆管上皮细胞)和肌成纤维样细胞上;且给予LOXL2抗体干预即抑制LOXL2的表达可抑制胆管反应、改善肝纤维化[17]。胆管癌患者血清及肝组织中LOXL1 均高表达,且LOXL1 可介导胆管癌细胞的增殖和转移[19]。这些报道说明LOXL1 和LOXL2 均表达在胆管细胞,且可促进肝纤维化的进展。本研究也发现,BDL诱导的胆汁性肝纤维化肝组织和体外肝祖细胞向胆管上皮细胞表型转分化中LOXL1 和LOXL2 的表达变化一致,提示LOXL1和LOXL2参与了胆管反应导致的胆汁性肝纤维化的发生发展。而进一步研究发现给予BDL 大鼠ASTs 干预后肝组织LOXL1 的表达显著降低;体外结果也显示对丁酸钠诱导肝祖细胞向胆管上皮细胞表型转分化模型给予ASTs 干预后细胞LOXL1和LOXL2 的表达显著降低,提示ASTs 可能通过下调LOXL1的表达抑制胆管反应减轻胆汁性肝纤维化。
本研究表明,ASTs通过抑制胆管反应改善胆汁性肝纤维化,其作用机制可能与下调LOXL1的表达有关。
